海水溶解磷酸盐氧同位素组成的测定
卢阳阳, 郑珍珍, 尹希杰, 陈志刚*, 蔡毅华, 刘广山, 黄奕普
1)厦门大学海洋与地球学院, 福建厦门 361005;2)国家海洋局第三海洋研究所, 海洋与海岸地质环境开放实验室, 福建厦门 361005
海水溶解磷酸盐氧同位素组成的测定
卢阳阳1), 郑珍珍1), 尹希杰2), 陈志刚1)*, 蔡毅华1), 刘广山1), 黄奕普1)
1)厦门大学海洋与地球学院, 福建厦门 361005;2)国家海洋局第三海洋研究所, 海洋与海岸地质环境开放实验室, 福建厦门 361005
生物磷酸盐和水分子间的氧同位素分馏主要受温度和生物活动控制, 因此磷酸盐氧同位素组成既可以测量古温度又可以示踪磷循环。近年来磷酸盐氧同位素研究受到较多关注, 除了传统的生物体磷灰石古温度测量外, 这些研究大多是关于磷循环的。磷酸盐的氧同位素组成可以示踪海洋中磷的源区和生物对磷的利用效率。由于海水的组成十分复杂, 测量前必须对样品进行富集、分离和纯化处理。目前, 加州大学(Santa Cruz)Paytan教授和耶鲁大学 Blake教授的实验室已建立了海水溶解磷酸盐氧同位素的测量方法, 二者各有优缺点。我们结合了这两种方法的优点, 并对一些步骤进行了改进, 建立了海水溶解磷酸盐氧同位素组成的测量方法。通过向海水样品中加入 NaOH, 形成 Mg(OH)2来富集海水中的 PO43-, 也可同时除去部分杂质离子和溶解有机质; 通过将 PO43-转化为 CePO4沉淀来进一步除去杂质离子, 然后用阳离子交换树脂除 Ce3+,再通过阴离子交换树脂柱来除溶解有机质。最后将磷酸盐转换为Ag3PO4沉淀, 在1350℃裂解Ag3PO4, 产生的O2和石墨反应形成CO用IRMS测定。结果显示富集、分离和纯化过程可以获得纯的Ag3PO4颗粒, 不会产生PO43-的氧同位素分馏。测量Ag3PO4用量仅为0.3 mg, 标准偏差在±0.2‰~±0.3‰之间。
海水; 溶解磷酸盐; 氧同位素; 方法
对于所有生物来说, 磷都是一个重要的营养元素。它在基本生化反应中都扮演着关键角色, 包括遗传物质、能量传递、有机质结构支撑的膜及骨骼(Ruttenberg, 2003)。磷在许多水生生态系统中都是限制性营养元素, 因此对初级生产力有着重要的影响(Karl et al., 2001; Wu et al., 2000; Benitez-Nelson,2000; Karl et al., 1997)。在地质时间尺度上通常认为磷是海洋生态系统中最终的限制性营养元素(Tyrrell,1999; Toggweiler, 1999), 进而影响生物泵的效率(Föllmi, 1996)。
然而磷只有一个稳定同位素(31P), 在自然界主要以正五价正磷酸盐形式存在, 因此磷循环的研究手段相对单一。常用的方法是测量无机磷含量、总磷含量和有机磷含量(总磷和无机磷之差)。对于沉积物, 也可以用不同提取液将磷分为弱吸附态、氧化物吸附态、自生磷灰石态、碎屑磷灰石态和有机磷态(Ruttenberg, 1992)。比较有效的示踪剂是32P和33P(Benitez-Nelson et al., 1999), 然而由于它们的含量低、半衰期短, 限制了它们的应用。
在PO43-中P-O键长处于单键和双键之间, 具有颇高的稳定性(键能为 359.8 kJ·mol-1), 使PO43-成为一个很稳定的结构单元。PO43-呈四面体结构, P位于四面体中心, 四个氧分别位于在四面体的四个顶点。多种结合形式的P(V)含氧化合物都是以磷氧四面体为结构基础。研究结果显示, 在地表温度和pH范围内, 若没有生物或酶的作用, PO43-和水分子不会发生氧交换(Liang et al., 2007; O'Neil et al., 2003;Lecuyer et al., 1999)。因此, 很多科学家将目标转移至具有 3个稳定同位素的氧, 即磷酸盐的氧同位素组成研究。磷酸盐的氧同位素组成可用来示踪水体中磷的来源(Young et al., 2009; Elsbury et al., 2009),同时也可示踪海洋中磷的生物地球化学循环过程(Goldhammer et al., 2011; Jaisi et al., 2010; Paytan et al., 2007; McLaughlin et al., 2006a, b, c; Colman et al.,2005), 是海洋磷循环研究中一个不可多得的示踪剂。
磷酸盐氧同位素测量要求把样品中的PO43-转化为纯的Ag3PO4。海水组成十分复杂, 必须对样品进行富集、分离和纯化, 并要求这些处理过程不会产生氧同位素分馏。目前, 国内万德芳等(2001)建立了地质样品磷酸盐氧同位素组成的氟化测量方法, 周爱国等(2008)和甘义群等(2005)建立了硫酸盐氧同位素的测量方法, 还尚未看到海水溶解磷酸盐氧同位素组成的测量方法(林继军等, 2010; 陈志刚等,2010)。国际上只有加州大学(Santa Cruz)Paytan和耶鲁大学Blake的实验室建立了海水溶解磷酸盐氧同位素的测量方法(McLaughlin et al., 2004; Colman,2002)。Paytan实验室的方法是先用氢氧化镁共沉淀法(magnesium-induced co- precipitation, 简称MAGIC)(Karl et al., 1992; Thomson-Bulldis et al., 1998)来富集海水中的溶解磷酸盐, 同时也可以去除一些杂质,然后用PO43-的特征沉淀CePO4进一步纯化PO43-, 最后用阳离子交换树脂除Ce3+, 并将PO43-转化成Ag3PO4后, 用同位素比值质谱(Isotope-ratio mass spectrometry IRMS)测定同位素组成。而Blake实验室则通过多次MAGIC来去除杂质离子(特别是Cl-), 然后用阴离子交换树脂来除溶解有机质, 最后用阳离子交换树脂除Na和HCO32-, 并将PO43-转化成Ag3PO4用IRMS测定。Paytan方法的优点是用PO43-的特征沉淀CePO4对除其他杂质离子具有较好的效果, 缺点是没有专门除溶解有机质的步骤; Blake教授方法的优点是通过阴离子交换树脂能有效地去除海水中大部分溶解有机质, 缺点是多次MAGIC会降低磷的回收率, 也可能会造成有机磷的水解。本研究结合了两个实验室方法的优点, 即用阴离子树脂除溶解有机质, 用CePO4去除杂质离子, 并对一些步骤进行了改进, 建立了海水溶解磷酸盐氧同位素的准确测量方法。
1 实验方法
1.1 试剂与仪器
器皿: 250 mL 聚乙烯塑料瓶, 100 mL, 50 mL聚碳酸酯离心管, 50 mL玻璃烧杯,带砂芯的层析柱,所用器皿均在 10%(体积分数)的硝酸中浸泡, 使用前用Milli-Q水洗涤干净;
试剂: BIO-RAD AG-50X8阳离子交换树脂(Biotechnology Grade, H+型, 100~200 目); BIO-RAD AG1-X8阴离子交换树脂(Biotechnology Grade, OH-型, 200~400目); KH2PO4(AR); AgNO3(AR); Ag3PO4;高纯氮气; Milli-Q水;
仪器: 多管架自动平衡离心机(XiangYi L-530);pH计(Thermo orion Model 868); 百万分之一电子天平(Sartorius ME36S); 热燃烧/元素分析仪(Thermo-Chemical Element Analyzer TC/EA)(Thermo Finnigan); 连续流系统(Thermo Finnigan ConFloⅢ); 同位素比值质谱仪 IRMS(Thermo Finnigan Delta V)。
1.2 方法与步骤
1.2.1 海水中PO43-的富集和纯化
采用 MAGIC法富集海水中的溶解无机磷(Dissolved Inorganic Phosphate, 简称 DIP), 流程见图1。按与海水体积比为1%的比例向海水样品中加入1 mol/L的NaOH溶液, 形成Mg(OH)2白色沉淀,充分搅拌后静置6 h。虹吸弃去上清液, 将沉淀转移至100 mL 聚碳酸酯离心管中, 以3500 r/min的转速离心5 min, 弃去上清液。
用5 mL冰醋酸和15~20 mL 3mol/L的HNO3溶液, 将离心后的 Mg(OH)2沉淀全部溶解, 接着加入1 mol/L的CH3COONa溶液, 调节pH到5.5~6之间。加入3 mL 0.4 mol/L的Ce(NO3)3溶液, 搅拌混匀后静置 5 h。离心分离 CePO4磷酸铈沉淀(3500 r/min, 5 min)。用0.5 mol/L的 CH3COONa溶液, 反复洗涤沉淀并离心, 直至完全去除上清液中的Cl-(Cl-会干扰Ag3PO4沉淀的形成)。用1 mol/L的HNO3溶解CePO4沉淀, 加入4 mL BIO-RAD AG-50×8阳离子交换树脂, 在摇床上振荡10 h, 用带砂芯的层析柱将溶液与树脂分离。该步骤未采用传统的离子交换树脂柱, 是因为实际海水样品处理中,CePO4沉淀加酸不会马上完全溶解, 采用摇床的物理振荡破碎, 以及阳离子交换树脂在吸附交换 Ce3+的同时会释放出H+, 都会促进沉淀的溶解。
用1 mol/L的NaOH溶液调节溶液pH值至4~6,将溶液通过 BIO-RAD AG1-X8阴离子交换树脂柱,流速控制在 0.5 mL/min。用 35 mL 0.2 mol/L的NaHCO3溶液洗脱, 控制流速0.5 mL/min。将洗脱液接在50 mL的带盖玻璃管中, 加入2 mL 7 mol/L的HNO3溶液来除HCO3-。
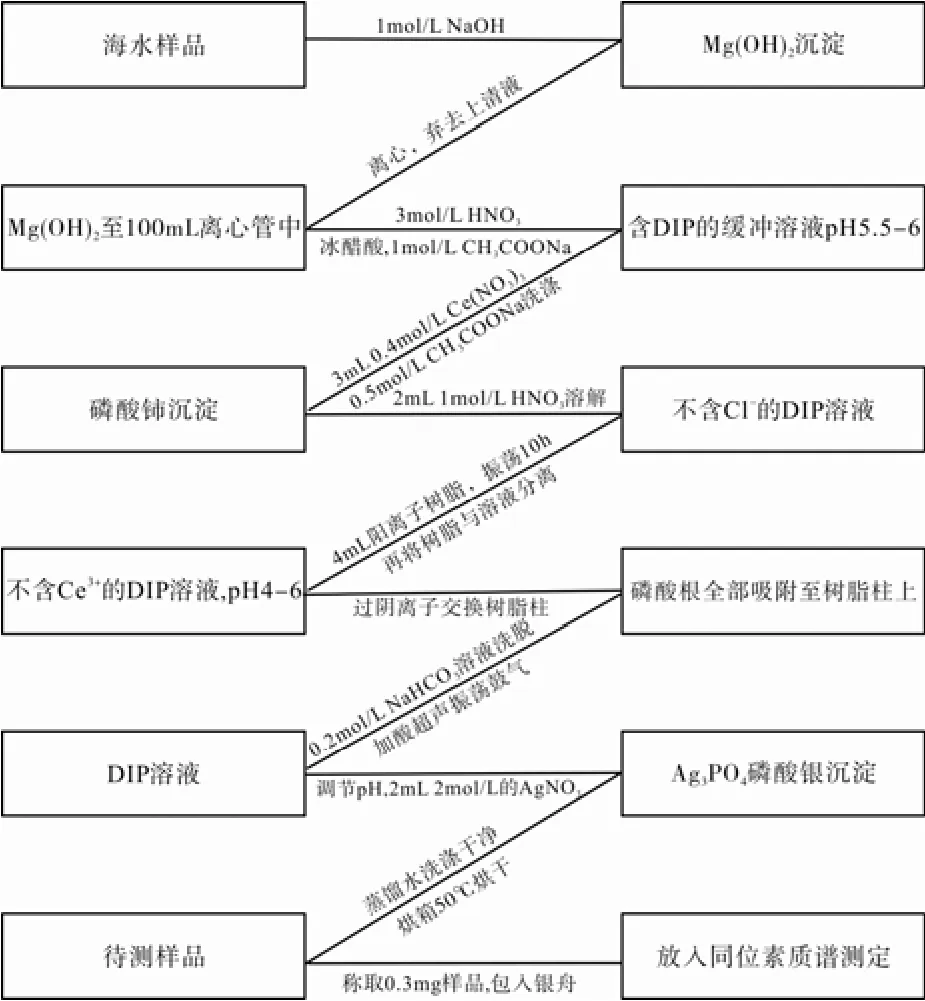
图1 海水中溶解无机磷纯化流程Fig. 1 Procedure for purification of dissolved inorganic phosphate from seawater
加入2滴溴百里酚蓝指示剂和1 mL浓氨水, 溶液由亮黄色变为蓝色, 再用3 mol/L的HNO3调节溶液至蓝绿色, 此时溶液 pH值约为 8.0。加入 2 mL 2 mol/L的AgNO3溶液, 形成亮黄色的Ag3PO4沉淀,静置过夜。分离Ag3PO4沉淀并在60℃烘干待测。
1.2.2 测量
样品采用IRMS测量。将Ag3PO4样品(300 μg)包入银舟(3.5 mm, Thermo), 通过自动进样器进入TC/EA。Ag3PO4在1350℃的条件下裂解, 释放的氧和石墨反应形成 CO。CO气体样品通过水阱(H2O trap)和 GC(气相色谱)柱纯化后, 通过连续流系统载入质谱测量。用仪器所带软件(Isodat NT version 3.0)对数据进行处理,δ18O 值均是相对于VSMOW(Vienna Standard Mean Ocean Water 维也纳标准平均海水)。实验室标准用美国地质调查局提供的 Ag3PO4标准(MR-2,δ18O=1.6‰)刻度。
2 结果与讨论
2.1 试剂空白
向无磷含镁溶液中加入实际样品处理过程中所用到的试剂, 然后采用2次MAGIC方法对磷进行浓缩, 测其磷含量。无磷含镁溶液为向1 L Milli-Q水中加入20 g MgCl2·6H2O配成。试剂的加入量都数倍于实际样品处理时的用量: NH4NO3(AR, 4倍),CH3COONa(AR, 2倍), NaOH(AR, 3倍), 乙酸(AR,10倍), 氨水(AR, 10倍)。试剂用量及结果见表1。
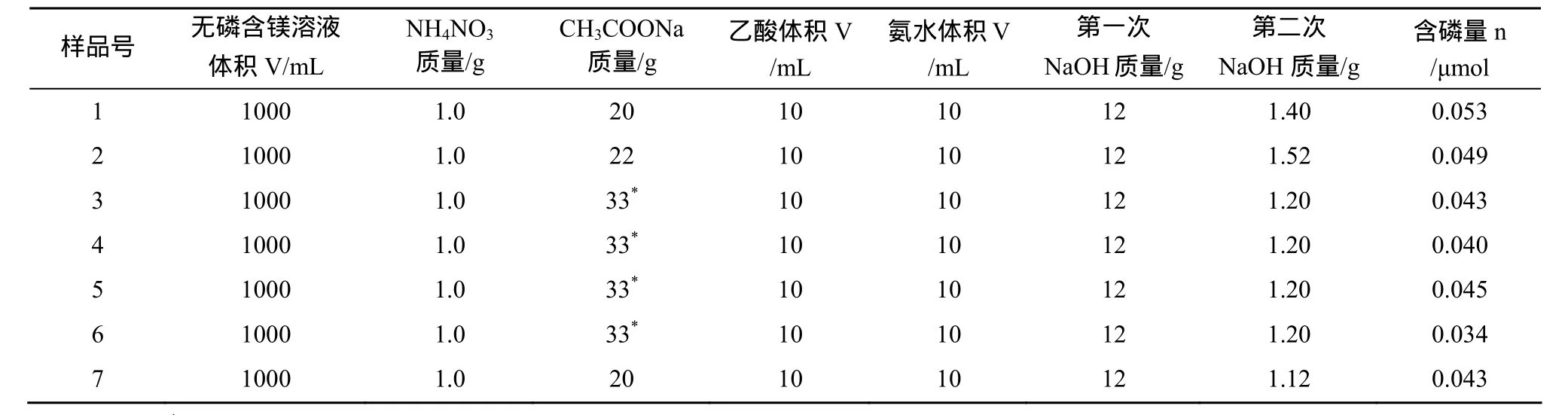
表1 试剂量及其磷空白值Table 1 Regent amount and corresponding phosphorus blank
结果显示磷含量在0.034~0.053 μmol之间。这些试剂的加入量是实际样品处理时用量的2~10倍。实际样品磷含量一般大于30 μmol, 因此可认为该实验所用试剂造成的影响可以忽略不计。
2.2 纯化效果
对分离纯化后形成的Ag3PO4用X’pert PRO X射线衍射(X-ray diffraction XRD)进行测定。一份样品是用20 L厦门湾表层海水按图1流程处理后得到的 Ag3PO4沉淀(厦门湾表层海水)(见图 2a)。第二份样品是5 L海水经MAGIC共沉淀后的上清液(无磷海水)外加 KH2PO4溶液按图 1流程处理后得到的Ag3PO4沉淀(无磷海水+KH2PO4)(见图 2b)。第三份样品是用 KH2PO4溶液和 AgNO3溶液直接形成Ag3PO4沉淀(去离子水+KH2PO4) (见图2c)。
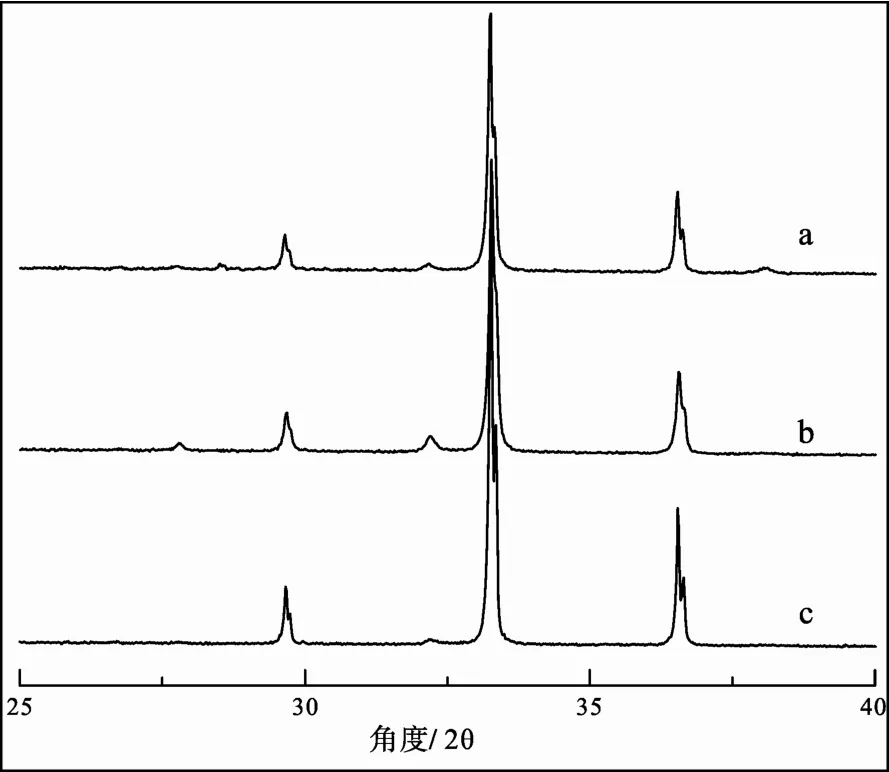
图2 Ag3PO4的XRD谱图Fig. 2 XRD patterns of Ag3PO4
图2显示3个图谱吻合得十分好, 和Ag3PO4标准图谱(JCPDS, card no.: 6-505)也吻合得很好, 说明分离纯化效果很好。
2.3 判断由PO43-形成Ag3PO4时氧同位素是否分馏
称取16 mg Ag3PO4试剂, 用2 mL 1 mol/L的
HNO3溶解, 然后再用溴百里酚蓝指示剂调节pH值至8.0左右, 加入过量AgNO3溶液, 形成Ag3PO4沉淀, 洗涤后烘干测量其δ18O(Ag3PO4试剂溶解再沉淀)。同时也用相同的 Ag3PO4试剂不经处理直接测其δ18O(Ag3PO4试剂)。结果如图3所示。
结果显示, Ag3PO4试剂直接测量δ18O的平均值为 8.7‰, 标准偏差为±0.2‰(n=15); 将 Ag3PO4试剂溶解加入过量 AgNO3溶液重新形成 Ag3PO4的δ18O测量平均值为 8.8‰, 标准偏差为±0.2‰(n=7)。二者在误差范围内一致, 说明在由 PO43-形成 Ag3PO4时不会产生氧同位素分馏。
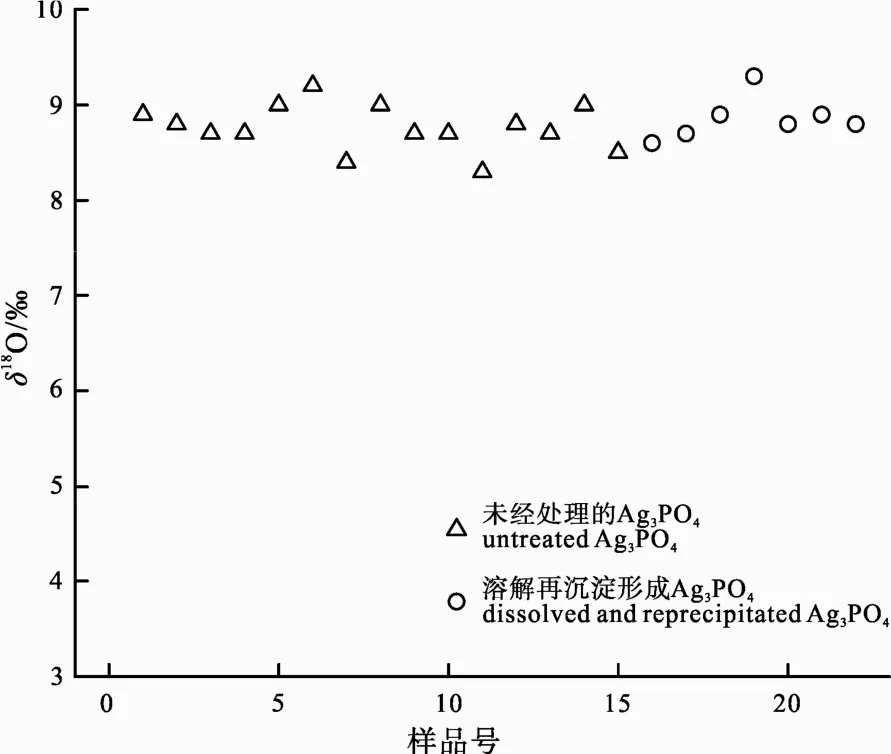
图3 未经处理的Ag3PO4与将其溶解再沉淀形成Ag3PO4之间δ18O测量值的比较Fig. 3 Comparison in δ18O between untreated Ag3PO4 and dissolved and reprecipitated Ag3PO4
2.4 判断全流程氧同位素是否分馏
用移液枪移取5 mL 8000 µmol/L的KH2PO4溶液, 调pH为8.0左右, 加入过量AgNO3形成Ag3PO4沉淀, 洗涤、烘干后测量其δ18O(KH2PO4直接形成Ag3PO4沉淀)。由本文2.3节可知PO43-形成Ag3PO4时不会产生氧同位素分馏, 因此该值即为 KH2PO4试剂的δ18O。
用移液枪移取 5 mL相同的 KH2PO4溶液, 按图1的流程处理后形成Ag3PO4沉淀, 洗涤、烘干后测量其δ18O(KH2PO4经过全流程后形成 Ag3PO4沉淀)。测量结果如图4所示。
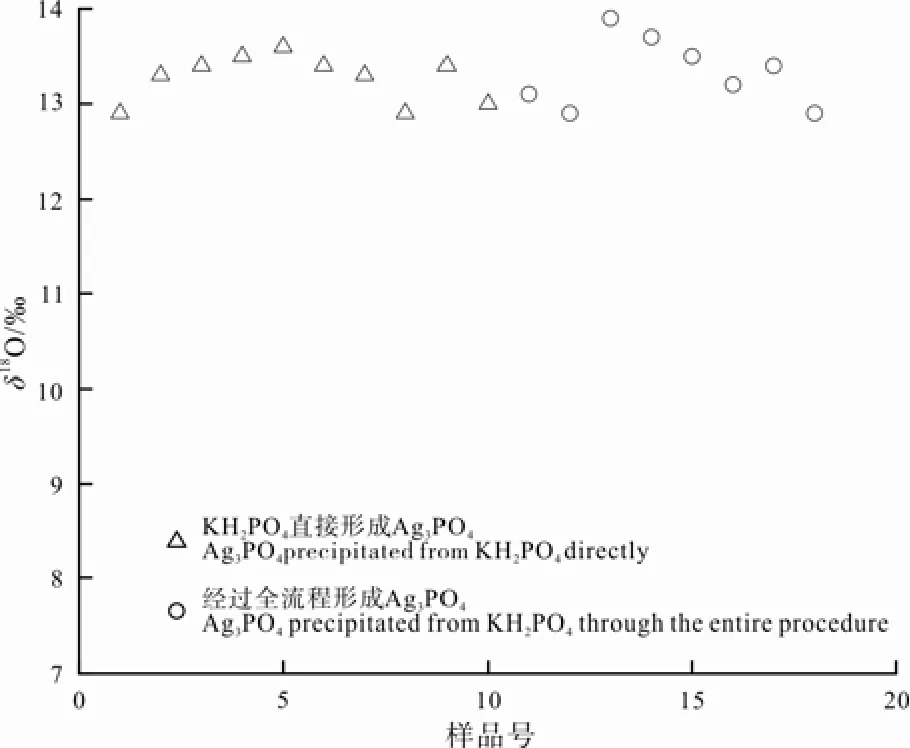
图4 KH2PO4直接形成Ag3PO4与其经过全流程形成Ag3PO4之间δ18O测量值的比较Fig. 4 Comparison in δ18O between Ag3PO4 precipitated from KH2PO4 directly and Ag3PO4 precipitated from KH2PO4 through the entire procedure
结果显示 KH2PO4溶液加 AgNO3直接形成Ag3PO4的δ18O 平均值为 13.3‰, 标准偏差为±0.3‰(n=8); KH2PO4经过全流程形成 Ag3PO4的δ18O平均值为13.3‰, 标准偏差为±0.2‰(n=10)。可以看出二者在误差范围内一致, 说明本研究所采用的富集、分离流程不会产生PO43-的氧同位素分馏。
3 结论
本研究建立了海水中溶解磷酸盐氧同位素的测量方法。XRD结果显示所采用的分离、纯化流程可以获得纯的Ag3PO4沉淀。用KH2PO4试剂经过全流程处理, 结果显示整个富集、分离和纯化流程不会产生氧同位素分馏。测量Ag3PO4用量仅为0.3 mg,标准偏差在±0.2‰~±0.3‰之间。
陈志刚, 黄奕普, 刘广山, 蔡毅华, 卢阳阳, 刘润. 2010. 磷酸盐氧同位素组成的测定方法及分馏机理研究进展[J]. 地球科学进展, 25(10): 1040-1050.
甘义群, 周爱国, 刘存富. 2006. 硫酸盐δ17O和δ18O同时测试新技术: CO2-激光氟化法[J]. 地球学报, 26(Sl): 48-50.
林继军, 陈志刚, 刘广山. 2010. 应用于磷酸盐氧同位素测定的海水中溶解态磷酸盐的富集, 分离与纯化[J]. 厦门大学学报(自然科学版), 49(2): 238-241.
万德芳, 丁悌平. 2001. 磷酸盐中的氧同位素测定[J]. 矿物岩石地球化学通报, 20(4): 448-450.
周爱国, 刘存富, 蔡鹤生, 甘义群, 李小倩, 余婷婷, 刘运德.2008. 硫酸盐三氧同位素测试制样新技术——Ag2SO4热解法[J]. 地球学报, 29(6): 673-676.
BENITEZ-NELSON C R, BUESSELER K O. 1999. Variability of inorganic and organic phosphorus turnover rates in the coastal ocean[J]. Nature, 398(6727): 502-505.
BENITEZ-NELSON C R. 2000. The biogeochemical cycling of phosphorus in marine systems[J]. Earth-Science Reviews,51(1-4): 109-135.
CHEN Zhi-gang, HUANG Yi-pu, LIU Guang-shan, CAI Yi-hua, LU Yang-yang, LIU Run. 2010. Advances in the measurement methods and fractionation mechanism of the oxygen isotope composition of phosphate[J]. Advances in Earth Science,25(10): 1040-1050(in Chinese with English abstract).
COLMAN A S, BLAKE R E, KARL D M, FOGEL M L,TUREKIAN K K. 2005. Marine phosphate oxygen isotopes and organic matter remineralization in the oceans[J].Proceedings of the National Academy of Sciences of the United States of America, 102(37): 13023-13028.
COLMAN A S. 2002. The oxygen isotope composition of dissolved inorganic phosphate and the marine phosphorus cycle[D].Connecticut: Yale University.
ELSBURY K E, PAYTAN A, OSTROM N E, KENDALL C,YOUNG M B, MCLAUGHLIN K, ROLLOG M E, WATSON S. 2009. Using oxygen isotopes of phosphate to trace phosphorus sources and cycling in Lake Erie[J].Environmental Science & Technology, 43(9): 3108-3114.
FÖLLMI K. 1996. The phosphorus cycle, phosphogenesis and marine phosphate-rich deposits[J]. Earth-Science Reviews,40(1-2): 55-124.
GAN Yi-qun, ZHOU Ai-guo, LIU Cun-fu. 2006. The CO2-Laser Fluorination Method: A New Technique for Simultaneous Determination ofδ17O andδ18O in Sulfates[J]. Acta Geoscientica Sinica, 26(Sl): 48-50(in Chinese with English abstract).
GOLDHAMMER T, BRUNNER B, BERNASCONI S M,FERDELMAN T G, ZABEL M. 2011. Phosphate oxygen isotopes: Insights into sedimentary phosphorus cycling from the Benguela upwelling system[J]. Geochimica et Cosmochimica Acta, 75(13): 3741-3756.
JAISI D P, BLAKE R E. 2010. Tracing sources and cycling of phosphorus in Peru Margin sediments using oxygen isotopes in authigenic and detrital phosphates[J]. Geochimica et Cosmochimica Acta, 74(11): 3199-3212.
KARL D M, BIDIGARE R R, LIDIGARE R M. 2001. Long-term changes in plankton community structure and productivity in the North Pacific Subtropical Gyre: the domain shift hypothesis[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 48(8-9): 1449-1470.
KARL D M, TIEN G. 1992. MAGIC: A sensitive and precise method for measuring dissolved phosphorus in aquatic environments[J]. Limnology and Oceanography, 37(1):105-116.
KARL D M, TIEN G. 1997. Temporal variability in dissolved phosphorus concentrations in the subtropical North Pacific Ocean[J]. Marine Chemistry, 56(1-2): 77-96.
LECUYER C, GRANDJEAN P, SHEPPARD S M F. 1999. Oxygen isotope exchange between dissolved phosphate and water at temperatures≤135 ℃ : inorganic versus biological fractionations[J]. Geochimica et Cosmochimica Acta, 63(6):855-862.
LIANG Y H, BLAKE R E. 2007. Oxygen isotope fractionation between apatite and aqueous-phase phosphate: 20–45[J]. ℃Chemical Geology, 238(1-2): 121-133.
LIN Ji-jun, CHEN Zhi-gang, LIU Guang-shan. 2010. The Preconcentration, Separation and Purification of Phosphate for the Seawater Dissolved Phosphate Oxygen Isotope Composition Analysis[J]. Journal of Xiamen University(Natural Science), 49(2): 238-241(in Chinese with English abstract).
MCLAUGHLIN K, CADE-MENUN B J, PAYTAN A. 2006a. The oxygen isotopic composition of phosphate in Elkhorn Slough,California: A tracer for phosphate sources[J]. Estuarine,Coastal and Shelf Science, 70(3): 499-506.
MCLAUGHLIN K, CHAVEZ F, PENNINGTON J T, PAYTAN A.2006b. A time series investigation of the oxygen isotopic composition of dissolved inorganic phosphate in Monterey Bay,California[J]. Limnology and oceanography, 51(5): 2370-2379.
MCLAUGHLIN K, KENDALL C, SILVA S R, YOUNG M,PAYTAN A. 2006c. Phosphate oxygen isotope ratios as a tracer for sources and cycling of phosphate in North San Francisco Bay, California[J]. Journal of Geophysical Research,111: G03003,doi: 10.1029/2005JG000079.
MCLAUGHLIN K, SILVA S, KENDALL C, STUART-WILLIAMS H, PAYTAN A. 2004. A precise method for the analysis of δ18O of dissolved inorganic phosphate in seawater[J]. Limnol Oceanogr: Methods, 2: 202-212.
O'NEIL J R, VENNEMANN T W, MCKENZIE W F. 2003. Effects of speciation on equilibrium fractionations and rates of oxygen isotope exchange between (PO4)aqand H2O[J]. Geochimica et Cosmochimica Acta, 67(17): 3135-3144.
PAYTAN A, MCLAUGHLIN K. 2007. The oceanic phosphorus cycle[J]. Chemical Reviews, 107(2): 563-576.
RUTTENBERG K C. 1992. Development of a sequential extraction method for different forms of phosphorus in marine sediments[J]. Limnology and Oceanography, 37(7):1460-1482.
RUTTENBERG K C. 2003. The Global Phosphorus Cycle[M]//HEINRICH D H, KARL K T, eds. Treatise on geochemistry[M]. Oxford: Pergamon.
THOMSON-BULLDIS A, KARL D. 1998. Application of a novel method for phosphorus determinations in the oligotrophic North Pacific Ocean[J]. Limnology and Oceanography, 43(7):1565-1577.
TOGGWEILER J R. 1999. An ultimate limiting nutrient[J]. Nature,400(6744): 511-512.
TYRRELL T. 1999. The relative influences of nitrogen and phosphorus on oceanic primary production[J]. Nature,400(6744): 525-531.
WAN De-fang, DING Ti-ping. 2001. Determination of Oxygen Isotopes in the Phosphate[J]. Bulletin of Mineralogy,Petrology and Geochemistry, 20(4): 448-450(in Chinese with English abstract).
WU J F, SUNDA W, BOYLE E A, KARL D M. 2000. Phosphate depletion in the western North Atlantic Ocean[J]. Science,289(5480): 759-762.
YOUNG M B, MCLAUGHLIN K, KENDALL C,STRINGFELLOW W, ROLLOG M, ELSBURY K, DONALD E, PAYTAN A. 2009. Characterizing the oxygen isotopic composition of phosphate sources to aquatic ecosystems[J].Environmental Science & Technology, 43(14): 5190-5196.
ZHOU Ai-guo, LIU Cun-fu, CAI He-sheng, GAN Yi-qun, LI Xiao-qian, YU Ting-ting, LIU Yun-de. 2008. A New Sample Preparation Technology for Determining Tri-oxygen Isotopes in Sulfate by Ag2SO4Pyrolysis[J]. Acta Geoscientica Sinica,29(6): 673-676(in Chinese with English abstract).
The Measurement of Oxygen Isotope Composition of Dissolved Inorganic Phosphate in Seawater
LU Yang-yang1), ZHENG Zhen-zhen1), YIN Xi-jie2), CHEN Zhi-gang1),CAI Yi-hua1), LIU Guang-shan1), HUANG Yi-pu1)
1)College of Oceanography and Earth, Xiamen University, Xiamen, Fujian361005;2)Open Laboratory of Coast & Ocean Environmental Geology, Third Institute of Oceanography,State Oceanic Administration, Xiamen, Fujian361005
The oxygen isotope fractionation between biogenic phosphate and water is primarily controlled by temperature and biological activity, so the oxygen isotope composition of phosphate (δ18OP) has been used to measure the paleotemperature and trace phosphorus biogeochemical cycles. Recently the study ofδ18OPhas attracted much attention. In addition to traditional biogenic apatite paleotemperature measurements, the studies are mostly concentrated on the phosphorus cycle.δ18OPof dissolved inorganic phosphate (DIP) is an effective proxy for tracing sources and biogeochemical cycle of phosphorus. Seawater composition is very complex, so the seawater sample must be separated and purified before theδ18OPmeasurement. Professor Paytan of University of California (Santa Cruz), and Professor Blake of Yale University have established their respectiveδ18OPmeasurement methods of seawater DIP, but the two method have their respective advantages and disadvantages.The authors combined the advantages of the two methods and modified some procedures to establish an improvedδ18OPmeasurement method of seawater DIP. In this method, DIP in water samples is concentrated through Mg(OH)2-PO4co-precipitation, which can exclude a portion of the dissolved organic material (DOM) and interfering ions; then the resulting solution is converted to CePO4precipitate to further separate Pi from dissolved salts, especially Cl-, and subsequently the solution is purified through a batch mode cation resin to remove Ce3+from the solution and through anion resin column treatment to remove the dissolved organic material. Phosphate is converted to silver phosphate ultimately, which is in turn pyrolitically decomposed to CO at 1350 and ℃δ18O is analyzed with continuous-flow isotope ration mass spectrometry (IRMS). The results show that this procedure can remove the interfering compounds effectively and preserve the initial oxygen isotope composition. The sample amount needed is 0.3 mg (Ag3PO4), with an average standard deviation between 0.2‰ and 0.3‰.
seawater; dissolved inorganic phosphate; oxygen isotope; method
P578.92; P597.2
A
10.3975/cagsb.2012.06.16
本项目由国家自然科学基金(编号: 11075221, 41006072, 40706033)资助。
2012-09-03; 改回日期: 2012-10-12。责任编辑: 魏乐军。
卢阳阳, 男, 1989年生。硕士研究生。主要从事同位素海洋化学专业研究。E-mail: luyangyang1826@163.com。
*通讯作者: 陈志刚, 1974年生。讲师, 硕士生导师。主要从事同位素海洋化学专业研究。通讯地址: 361000, 福建省厦门市厦门大学曾呈奎楼A栋509。电话: 0592-2189468。E-mail: chzhg@xmu.edu.cn。