桦褐孔菌发酵产物的抑菌活性1)
邹莉 谭昀 杨民宝 孙婷婷
(东北林业大学,哈尔滨,150040)
桦褐孔菌(Inonotus obliguus(Pers.:Fr.)Pilát)属担子菌亚门、层菌纲、非褶菌目、多孔菌科、褐卧孔菌属,是一种重要的药用真菌[1]。民间广泛用于防治消化道疾病、心血管疾病和肿瘤(胃癌、肠癌及肝癌)等[2],临床上用于治疗糖尿病、高血压、癌症、衰老、传染性病毒等,取得显著的效果[3]。桦褐孔菌成分复杂,含有多糖、三萜类化合物、叶酸衍生物、芳香族香草酸、生物碱等活性物质[4-5]。化学研究表明,多糖、香草酸、生物碱有抑菌活性[6-7]。有关真菌的活性成分在病原菌防治方面的研究主要以木霉为主[8],木霉的抑菌作用及机制已被广泛研究[9],而关于桦褐孔菌的抑菌研究少见报道。为探索桦褐孔菌的活性物质对植物病原菌的影响,拓展其应用领域,笔者对其抑菌效果及对病原菌孢子萌发的影响进行了研究,为桦褐孔菌发酵产物植物源农药的开发提供理论基础和科学依据。
1 材料与方法
1.1 材料
桦褐孔菌由东北林业大学林学院森林微生物实验室提供。
培养基:PDA 固体培养基[10]46-47,PD 液体培养基[10]46-47。所有培养基在 121 ℃ 下灭菌 30 min备用。
供试植物病原菌:杨树烂皮病菌(Cytospora chrysosperma)、落叶松枯梢病菌(Botryosphaeria laricina)由东北林业大学林学院森林保护学科病理实验室提供;玉米小斑病菌(Bipolaris maydis)、黄瓜枯萎病菌(Fusarium oxysporum)、番茄褐斑病菌(Helminthosporium carposaprum)、番茄叶霉病菌(Cladosporium fulvum)、稻瘟病菌(Magnaporthe grisea)由东北农业大学植物保护学科提供。
1.2 试验方法
1.2.1 桦褐孔菌不同发酵时间发酵产物抑菌率的测定
将桦褐孔菌液体种子以20%的接种量,接入200 mL液体PD培养基中,150 r/min,25℃避光培养 9、12、15、17、19、20、23、25、27、29 d。采用菌丝生长速率法[10]141测定桦褐孔菌不同发酵时间的发酵产物对7种供试病原菌的抑制作用:将200 μL的发酵产物加入每个PDA培养基,对照加入无菌水,用直径6 mm的打孔器在各病原菌活化后的培养基上打孔取菌饼,接入上述培养皿中,放入恒温培养箱28℃培养72 h,每隔24 h观察1次,用十字交叉法测量菌落直径,每处理设3次重复,计算桦褐孔菌不同发酵时间的发酵产物对病原菌菌丝生长的抑菌率。
抑菌率=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%。
1.2.2 桦褐孔菌发酵产物活性物质提取
1.2.2.1 菌丝体的活性物质提取
将抑菌率最高的发酵液离心分离菌丝体,将菌丝体冲洗干净后60℃烘干,粉碎后过60目筛备用。①菌丝体粉末的抑菌活性测定:将预处理的菌丝体粉末按比例加入PDA培养基中,高温湿热灭菌,接入病原菌,以不加菌丝体粉末的PDA平板培养基为对照,培养72 h。测定菌丝体粉末的抑菌活性。②菌丝体有机溶剂萃取物的抑菌活性测定:将经过预处理的菌丝体用正丁醇和乙酸乙酯在78℃下进行索氏抽取8 h,旋转蒸发除去溶剂,真空干燥后用丙酮配置成一定浓度的样品液,滤膜过滤除菌后采取平板表面涂抹法[11]进行抑菌活性测定。③菌丝体水溶多糖的抑菌活性测定:取1 g干菌丝体粉末加定量热水浸提,浸提液合并后浓缩至原体积的1/4,下层清液置透析袋,蒸馏水透析2 d,流水透析1 d,用3倍95%乙醇沉淀[12],沉淀物用无水乙醇、丙酮、乙醚洗涤,真空干燥得菌丝体水溶性粗多糖。将收集到的菌丝体水溶性粗多糖按比例溶解在无菌蒸馏水中,用无菌滤膜过滤,制成水溶性粗多糖溶液,采用平板表面涂抹法[11]进行抑菌活性的测定。
1.2.2.2 发酵液的活性物质提取
发酵上清液直接抑菌活性测定:将离心去除菌丝的发酵上清液不经任何处理,用平板表面涂抹法[11]进行抑菌活性测定。
高温高压灭菌发酵上清液的抑菌活性测定:将离心去除菌丝的发酵上清液经高温高压湿热灭菌后,采用平板表面涂抹法[11]进行抑菌活性测定。
发酵上清液有机溶剂萃取物的抑菌活性测定:将离心去除菌丝的发酵上清液减压浓缩至原来体积的1/2,分别用5倍体积的正丁醇,3倍体积的乙酸乙酯进行萃取,萃取时间为24 h。之后用分液漏斗分离萃取相,旋转蒸发除去溶剂得固体样品,真空干燥后用丙酮配置成一定浓度的样品液。滤膜过滤除菌后采取平板表面涂抹法[11]进行抑菌活性测定。
发酵上清液醇提物的抑菌活性测定:将离心去除菌丝的发酵上清液加入3倍体积的95%乙醇,4℃下静止12 h,有絮状沉淀出现,冷冻干燥得到沉淀物,然后放置于干燥器中进一步干燥,得到发酵上清液醇提物干品。将醇提物用无菌水按比例溶解,用无菌滤膜过滤,制成水溶性粗多糖溶液,采用平板表面涂抹法[11]进行抑菌活性测定。
1.2.3 桦褐孔菌发酵液抑菌活性多糖的纯化及最小抑菌质量浓度的测定
对抑菌率最高发酵周期的发酵液粗多糖进行分级纯化,参照文献[13-15]并加以调整,采用95%乙醇对粗多糖进行分级沉淀。取一定质量粗多糖溶于适量的水中,边搅拌边加入95%的乙醇,使乙醇的最终体积分数为:30%、50%、70%、90%。在6000 r/min、4℃离心,收集沉淀,冷冻干燥沉淀得到分级醇沉的多糖干品。醇沉分级纯化的多糖按乙醇最终体积分数分类,分别用无菌蒸馏水溶解配置成 50 g·L-1的粗多糖溶液,0.22 μm 无菌滤膜过滤。采用菌丝生长速率法,测定各级别多糖的抑菌率,比较抑菌率,筛选出抑菌活性最强的多糖,用半倍稀释法[16]73、悬滴法[16]72测定抑菌活性多糖对病原菌菌丝生长和孢子萌发的最低抑制质量浓度。以生物农药儿茶素作为影响菌丝生长的对照,以无菌水作为孢子萌发的对照。
2 结果与分析
2.1 抑菌率最高的桦褐孔菌发酵产物的发酵周期
桦褐孔菌发酵产物对病原菌的抑制活性见图1。由图1可知,桦褐孔菌发酵产物对7种病原菌均有抑制作用,抑菌率随着发酵时间的增加逐渐升高,至第23天发酵产物的抑菌活性最强,到25 d后基本保持稳定。因此,可以确定桦褐孔菌分离和纯化抑菌活性物质最佳发酵周期为23 d。桦褐孔菌最佳发酵周期的发酵产物对杨树烂皮病和落叶松枯梢病的抑菌率超过了50%,因此研究其发酵产物所含抑菌活性物质对抑制杨树烂皮病和落叶松枯稍病具有较大的经济价值。
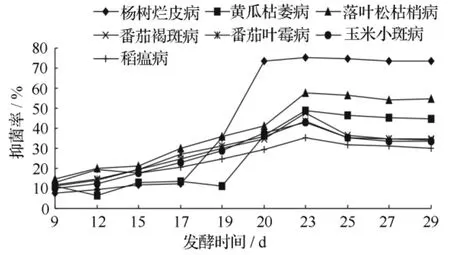
图1 Inonorus obliguus发酵产物对病原菌的抑制活性的影响
2.2 桦褐孔菌发酵产物不同处理的抑菌率比较
桦褐孔菌最佳发酵周期发酵产物的不同处理对杨树烂皮病、落叶松枯稍病的抑菌活性比较如表1所示。可以看出,桦褐孔菌发酵上清液醇提物对杨树烂皮病、落叶松枯稍病抑菌活性均较强,其次为发酵上清液、灭菌后的发酵上清液,其中发酵上清液不同处理的抑菌活性均强于化学试剂萃取组分,可见桦褐孔菌发酵产物中的主要抑菌活性物质存在于发酵上清液的醇提物中。

表1 桦褐孔菌最佳发酵周期发酵产物的抑菌活性
2.3 桦褐孔菌抑菌活性多糖的分级纯化
醇沉最终体积分数为30%、50%、70%、90%时 ,多糖得率分别为1.41% 、2.51% 、10.05% 、2.04%。不同醇沉体积分数多糖的得率区别较大,随着醇沉最终体积分数的增大桦褐孔菌多糖的得率呈增加趋势,当体积分数为70%时达到最高,之后随着体积分数增大多糖得率逐渐减小。结果表明,桦褐孔菌的最佳醇沉体积分数为70%。
2.4 桦褐孔菌分级纯化抑菌活性多糖的抑菌效果
不同醇沉级别的桦褐孔菌多糖对病原菌的抑菌率见表2。为了避免出现偏差,在对抑菌活性多糖分级后抑菌活性比较中将供试的7种病原菌都作了测试。结果表明:醇沉级别为70%的桦褐孔菌多糖(质量浓度为50 g·L-1)对病原菌的抑菌率最高。70%的桦褐孔菌多糖对杨树烂皮病和落叶松枯梢病抑菌率为供试组中最高的,分别为54.65%、67.41%。
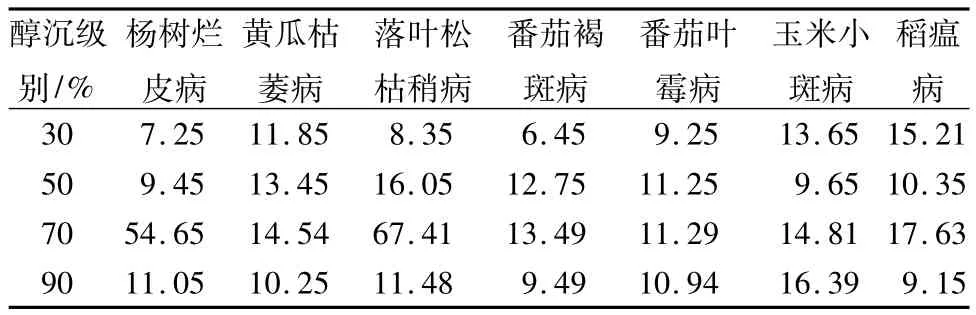
表2 不同醇沉级别的桦褐孔菌多糖对病原菌的抑菌率%
2.5 桦褐孔菌多糖的最小抑菌质量浓度
醇沉级别为70%的桦褐孔菌多糖对杨树烂皮病和落叶松枯稍病菌丝生长的最小抑菌质量浓度分别为65、60 g·L-1;儿茶素对杨树烂皮病和落叶松枯稍病菌菌丝生长的最小抑菌质量浓度分别为75、55 g·L-1,抑制效果见图2和图3。
醇沉级别为70%桦褐孔菌发酵液多糖对杨树烂皮病孢子无明显的抑制作用,对落叶松枯稍病的孢子有较明显的抑制作用,当其质量浓度为55 g·L-1时能抑制50%的孢子萌发(图4),这可能与病原菌孢子的结构有关。
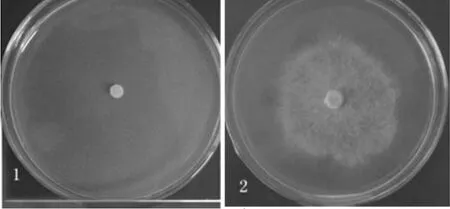
图2 桦褐孔菌最小抑菌质量浓度对杨树烂皮病的抑制效果
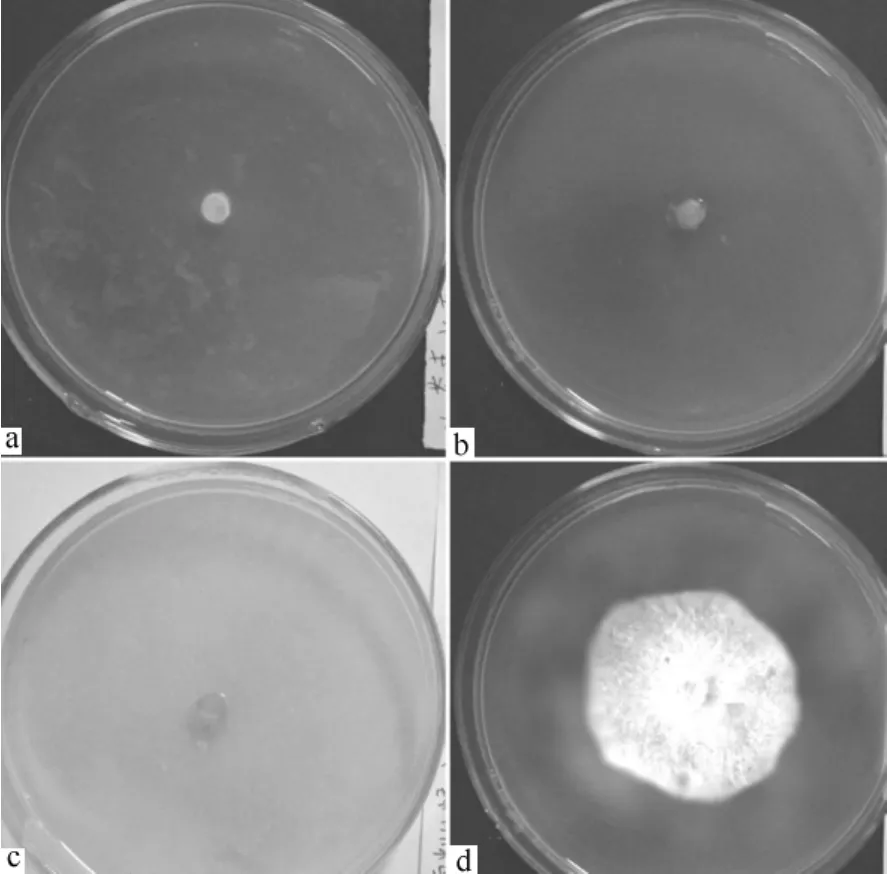
图3 桦褐孔菌最小抑菌质量浓度以及生物农药对落叶松枯稍病的抑制效果
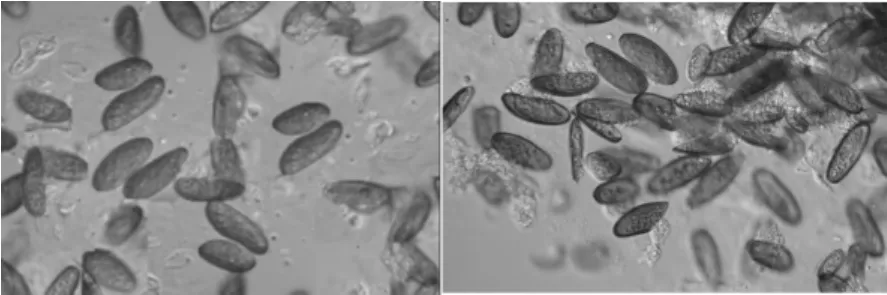
图4 桦褐孔菌对落叶松枯稍病孢子的影响以及无菌生理盐水对照(右)
3 结论与讨论
桦褐孔菌是目前抗癌研究领域的热门药用品种。到目前为止,对桦褐孔菌的研究大多集中在抗肿瘤和提高机体免疫能力方面,而关于桦褐孔菌发酵产物的抑菌活性很少报道。本研究证明了它对7种植物病原菌的菌丝生长和孢子萌发具有抑制作用。已证实,桦褐孔菌发酵上清液的乙酸乙酯和正丁醇提取物均具有抑菌活性,其发酵上清液醇提物对杨树烂皮病、落叶松枯稍病抑菌活性均较强,由此推断,桦褐孔菌抑菌活性物质主要存在于菌丝体醇提取物中。通过对活性成分的初步检测,桦褐孔菌菌丝体甲醇、正丁醇提取物中主要含有多糖类物质。因此,桦褐孔菌菌丝体中所含的多糖类物质可能具有较高的抑菌活性。而发酵液所表现出来的抑菌作用可能与发酵过程中产生的酶类活性物质有关,也可能是由于液体发酵时菌丝断裂而产生抗生素或释放出了抗生素物质,对于桦褐孔菌发酵产物的抑菌作用机制有待于进一步研究。由于病原菌只选用了7种,故不能确定其对未测试的病原菌有无抑制活性。
关于桑黄抑菌的研究已有过报导,2011年孟庆龙等研究了桑黄发酵产物的抑菌作用[17],试验中选取的病原菌为金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌、鼠伤寒沙门氏菌,本研究在此基础上扩展了桦褐孔菌对其他7种植物病原菌的抑制作用研究,对于桦褐孔菌活性物质的提取方法,本研究也分别对发酵液和菌丝体采用了多种不同的试剂提取,得出的结果与孟庆龙的结论相似,但较之其研究有了进一步的深化。
多糖作为真菌的发酵产物之一,已有不少关于其抑菌活性的报导,例如灵芝多糖[18],红菇菌多糖[19],粒毛盘菌和盘针孢菌多糖[20]等。在桦褐孔菌与生物农药的最小抑菌质量浓度的对比中发现:分离出的多糖是一类分子量相近、结构不同的多糖混合物,如果分离出起主要抑菌作用的多糖分子,抑菌效果一定会大大提高。本试验下一步将对桦褐孔菌菌株进行大量发酵,进一步优化菌株的发酵条件,改进和优化抑菌活性物质的提取技术,从其代谢产物中分离和提取出具有杀菌活性成分的化合物,并对分离出的化合物进行活性测定和结构鉴定,以进一步确定发酵液中抗菌活性物质的组分及相应的化学结构,以期能得到高活性的新化合物。
[1]张小青,戴玉成.中国真菌志:第29卷[M].北京:科学出版社,2005.
[2]黄年来.俄罗斯神秘的民间药用真菌:桦褐孔菌[J].中国食用菌,2002,21(4):7 -8.
[3]林碧贤,李晔,毛景华,等.药用真菌白桦茸:桦褐孔菌[J].海峡药学,2004,16(6):74 -76.
[4]何坚,冯孝章.桦褐孔菌化学成分的研究[J].中草药,2001,32(1):4-6.
[5]Shin Y,Tamai Y,Terazawa M.Chemical constituents of Inonotus obliquus IV:triterpene and steroids from cultured mycelia[J].Eurasion Journal of Forest Research,2001,2:27 -30.
[6]张家铭,穆楠,睢玉祥,等.翅果油树总生物碱的抑菌作用[J].安徽农业科学,2010,38(17):8992 -8994,9004.
[7]秦小萍,林壁润,王振中.灰色变异链霉菌2507抑菌活性成分的研究[J].天然产物研究与开发,2007,19:998 -1000.
[8]宋晓妍,孙彩云,陈秀兰,等.木霉生防作用机制的研究进展[J].中国农业科技导报,2006,8(6):20 -25.
[9]惠有为,孙勇,潘亚妮,等.木霉在植物真菌病害防治上的作用[J].西北农业学报,2003,12(3):96 -99.
[10]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998.
[11]祁金玉.毒蘑菇菌株及其提取物对樟子松枯梢病病原菌的影响[D].哈尔滨:东北林业大学林学院,2006:31-35.
[12]靳菊情,丁东宁,王晓美,等.黑石耳多糖的初步化学研究[J].中国药学杂志,1996,31(9):520 -522.
[13]闫吉昌,崔春月,张奕,等.芦荟多糖的分离纯化及结构分析[J].高等学校化学学报,2003,24(3):1189 -1192.
[14]芮海云,吴国荣,陈景耀,等.白芨中性杂多糖的分离纯化与结构分析[J].安徽农业大学学报,2004,31(1):30 -33.
[15]徐双阳.桑黄多糖提取、分离纯化及理化性质研究[D].杭州:浙江工业大学生物与环境工程学院,2006.
[16]慕立义.植物化学保护研究方法[M].北京:中国农业出版社,1994:195-197.
[17]孟庆龙,潘景芝,陈丽,等.桑黄发酵产物的抑菌作用[J].食品科学,2011,32(3):56 -59.
[18]白丹,常迺滔,李大海,等.灵芝多糖抑菌活性初探[J].华北农学报,2008,23(增刊):282 -285.
[19]张巍.红菇菌丝体培养多糖部分生物活性研究[D].哈尔滨:黑龙江中医药大学,2011.
[20]李世艳.两株真菌多糖发酵、提取及生物活性研究[D].合肥:合肥工业大学,2009.

