大兴沙地中11个树种基于根系形态的适应性
柴 源 徐程扬
(北京林业大学,北京,100083)
袁士保 陈 华 段树生
(北京市园林绿化局)
抗逆树种选择是沙地治理的核心内容之一。为了选择适宜沙地生长的植物,在水分胁迫与植物生长[1]、水分胁迫下植物形态变化[2]、植物叶片光合生理[3-5]、保护酶和脯氨酸等生化物质变化[6]、树木繁殖对策[7]等方面开展了大量研究。根系长度、根系表面积、根系体积、根系生物量等是影响产量形成的重要形态指标[8],同时也是反映植物抗旱能力的重要指标[9-11]。植物修改根系分布以获得储藏在土壤深层中的水分的能力是植物避旱的重要机制[12]。在土壤水分胁迫环境下,植物通常向地下部分分配更多的光合产物,提高地下部分生物量所占比例[13],以提高其对土壤资源的获得能力。
尽管各学者在沙生植物根系分布[14]、根系形态变化[15]等方面开展了研究,并在根系分布与土壤水分间的关系进行了部分报导[16],然而在树木根系形态变化与其在沙地中适应性的关系方面研究较少。
根据北京防沙治沙办公室提供的数据显示,北京沙化土地面积现为52448 hm2,其中,大兴区的沙地属于海河水系的永定河洪积-冲积平原,风蚀地表组成物质明显粗化[17],立地条件很差。然而,由于适宜于大兴沙地的树种较少,造林树种选择成为该地区沙地植被建设的主要限制因素。因此,论文以7个乡土树种和4个引进树种为材料开展试验研究,拟从根系形态变化角度探讨各树种在大兴沙地的适应性,为生产中选择耐旱耐瘠薄性强的良种提供参考。
1 试验地概况
试验地位于北京市大兴区六合庄林业试验场,该林场位于永定河南畔,东经 116°27',北纬 39°26',属典型的暖温带半湿润大陆性季风气候。年平均气温12.7℃,年平均最高气温38℃,年平均最低气温-15.4℃,年有效积温4611℃,无霜期189 d,年降水量568 mm,其中6—8月降雨量占全年的76.2%,冬季只有2%,年日照时数为2772小时,全年太阳总辐射量为565 kJ/m2,年均空气相对湿度61%。该地土壤为洪积母质通体沙土,通透性能良好,保蓄水肥的能力很差,缺氮、少磷、富钾。地下水位8~10 m。土壤pH值为7.8,有机质质量分数为12.37 g/kg,全氮质量分数为0.83 mg/kg,碱解氮质量分数为70.46 mg/kg,速效 P 质量分数为 14.49 mg/kg,速效K质量分数为78.39 mg/kg。
2 材料与方法
试验材料:选择7种乡土树种和4种国内外引进树种作为研究对象,按照2 m×3 m株行距栽植于试验地中,每个树种栽植数量不少于110株。为了确保苗木成活,栽植后视土壤水分状况及时浇水,8月份以后停止浇水;栽植第2年主要依靠天然降水维持苗木生长。于栽植2 a后的10月份展开全面调查,不同树种间的各生长指标间差异极显著,见表1。
树种生长和根系形态调查:2002年,将各种苗木按照1650株/hm2的密度栽植于沙地中,并于2004年10月初、树木落叶之前开展调查。首先对树高、直径、冠幅、当年新梢生长量等林木生长状况进行全面调查,在此基础上每个树种选择5株苗木作为根系生长状况调查样本。在根系调查时,统一确定苗木1/4象限部分作为根系调查区域,以南北、东西两个方向根系分布范围计算根幅,并挖取该区域所有根系带回实验室,用WinRhizo根系扫描仪测定各径级根系的长度、表面积和体积。

表1 供试树种及其生长状况
数据处理与分析:新梢相对生长量=新梢生长量/树高;根系分布指数=(最大根系分布深度-最小根系分布深度)/平均根系分布深度;比根长=根系长度/根系干质量。
所有数据均采用SPSS 16 for Windows和Microsoft office Excel 2003等统计软件进行分析。
3 结果与分析
3.1 根系生物量及根系深度
各树种根系生物量和根系分布深度差异较大,根系生物量种间变异系数达26.6%(表2)。其中,酸枣、沙棘和皂角根系分布较深,臭椿、樟子松、圆柏、楸树、沙枣根系分布相对较浅,而饲料桑、果桑和皂角根系垂直分布较为集中。由此推测,这些树种可能在大兴沙地中采取两类适应对策:一是集中于土壤深层次,采取根系避旱对策;另一个是分布范围较大,遍布土层中,采用获取有效资源或者耐旱对策。
3.2 树种根系形态特征
3.2.1 根系长度
由于细根所占比例和绝对量较低、径级较大的贮藏根比例较高,果桑和饲料桑主动获取有限资源的能力相对较差;而皂角、圆柏和臭椿直径d<2 mm根系长度占总根系长度的91%以上,栾树、楸树分别为89.1%和89.9%(表3),这使得树木可通过强烈的根系分枝有效地获取土壤资源,显示出较高的土壤资源利用能力。沙棘、沙枣2 mm≤d≤5 mm径级根系在资源获得能力中起到非常重要的作用,因为2 mm≤d≤5 mm径级根系长度所占比例分别达到12.8%和20.6%,是其他树种相应平均值的1.4和2.2倍。饲料桑和果桑因具有较高比例(分别为23.3%和23.6%)的2 mm≤d≤5 mm 和 d>5 mm 根系长度,降低了细根的分化强度,进而降低了在干旱土壤中获得水分的能力。
表2 供试树种根系生物量及根系深度比较
经计算比根长得知,栾树、圆柏、皂角比根长分别为 128.9、112.0、127.7 cm/g,显著高于其他树种(p<0.001),平均比樟子松、沙枣和酸枣(比根长分别为 54.8、59.7、61.9 cm/g)高出 108.9%,比果桑、饲料桑、沙棘(比根长分别为 24.5、45.6、36.3 cm/g)高出246.6%。这充分表明栾树、圆柏、皂角、臭椿、楸树是以强烈分化细根来适应大兴沙地环境的,而沙棘、沙枣、酸枣仍以向根系投入较低的碳同化物质的特点而适应沙地环境,不同的是沙棘和酸枣根系分布更深。饲料桑和果桑细根分化较弱,且根系分布较集中,如果长期缺乏水分,在大兴沙地将难以存活。

表3 试验树种不同茎级根系的形态变化
3.2.2 根系表面积
各树种根表面积间差异达到极显著水平(表3)。栾树、皂角、圆柏直径d<2 mm的细根表面积总量和所占比例均较高,尽管沙棘d<2 mm根系表面积总量不及前3树种,但所占比例达59%;圆柏、酸枣直径2 mm≤d≤5 mm根系表面积总量较高,可占总表面积的比例仅为39.0%和38.0%;饲料桑、果桑、樟子松、酸枣d>5 mm根系表面积平均较其他树种高121.8%。这表明,皂角、栾树、圆柏、臭椿等树种根系与土壤接触的面积较大,对土壤资源的利用能力也相对较强。饲料桑、果桑、樟子松、酸枣2 mm≤d≤5 mm根系在土壤资源获得上起到了较大的作用。沙棘根系无论总量还是分枝都是相对较弱的,是供试树种中最不发达的树种。
3.2.3 根系体积
各树种根系体积间差异达到极显著水平(表3)。饲料桑、果桑、楸树、酸枣和樟子松根系体积以较高径级为主,皂角、沙棘、栾树、圆柏直径d<2 mm的细根较多,沙枣、沙棘、臭椿直径2 mm≤d≤5 mm的根系较丰富(表3)。由此可以判断,饲料桑、果桑根系对土壤资源变化主动适应能力较其它树种弱,因为,这两个树种的根系主要集中在直径d>5 mm的根系上,代表着吸收能力的d<2 mm细根体积不及总量的10%,这种结构是典型适应丰富土壤资源的结果。酸枣、楸树、臭椿、樟子松d<2 mm细根所占比例仍然较高,同时其d>5 mm根系比例也较高,表明这些树种细根分枝较多,且粗根丰富,2 mm≤d≤5 mm根系相对较少,这是典型的根系对瘠薄环境短期反应的结果。沙枣、沙棘属于主根少、主根上分枝较多、但细根不很发达的特征,是长期适应于干旱、瘠薄环境的结果,也是在北京沙地适应性强的重要表现。
3.3 树种根系特征与地上部分生长的相关性
各树种在根系生物量积累和新梢生长间存在一种交换关系,即根系生物量高者新梢生长量降低(图1A)。这说明供试树种普遍通过控制根系生长提高地上部分生物量积累,反之亦然。这种交换关系主要体现在2 mm≤d≤5 mm根系上,即新梢生长量随着2 mm≤d≤5 mm根系长度的提高而呈降低趋势(图1B、图2B)。
新梢生长量与直径d<2 mm的细根长度、表面积、体积以及根系总长度和总表面积呈极其密切的正相关关系(图1C,图2A、C),而根系2 mm≤d≤5 mm、d>5 mm以及总体积与新梢生长量间无显著关系(图2C、D),这表明,直径d<2 mm根系比其它直径级别根系对树木新梢生长更具有影响力。
3.4 供试树种适应类型划分
以新梢的相对生长、根系分布指数、比根长、根系干质量、径级d<2 mm根长比例、径级d<2 mm根表面积比例、径级d<2 mm根体积比例为变量,对11个树种进行系统聚类分析,可将树种划分为5类(图3)。
这几组树种分别代表了不同的适应方式。皂角、栾树和圆柏细根量较高,因其根系垂直分布范围较小、比根长较高,意味着细根分化较旺盛,属于高土壤资源消耗型树种。臭椿、楸树也具有分化较多的细根,根系垂直分布相对较广,且d>2 mm根系体积较高,细根分化能力较皂角、栾树和圆柏弱,虽然也属于土壤资源消耗相对较高的树种,但土壤资源消耗程度不及前3者。饲料桑和果桑根系垂直分布范围小、细根分化能力较弱,表现出对有效性土壤资源高度依赖特性。沙棘根系分化能力相对较弱,但直径2 mm≤d≤5 mm根系较发达,根系分布较深,表现出较强的土壤深层次资源利用能力,属于低土壤资源消耗性型树种。樟子松、沙枣和酸枣根系垂直分布范围相对较大,比根长和d<2 mm根系所占比例处于中等,既可以充分利用土壤浅层资源,又可利用土壤深层资源。
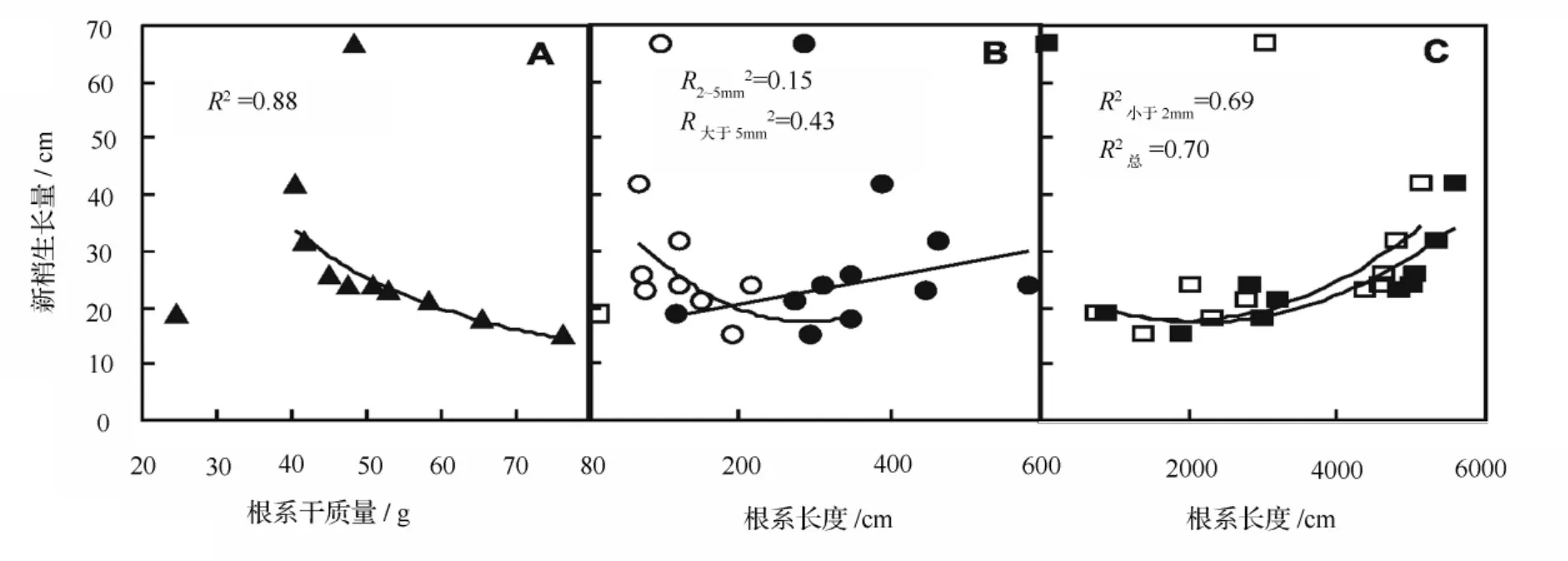
图1 根系干重和长度与主干新梢生长量的关系

图2 根表面积、根体积与新梢生长量间的关系
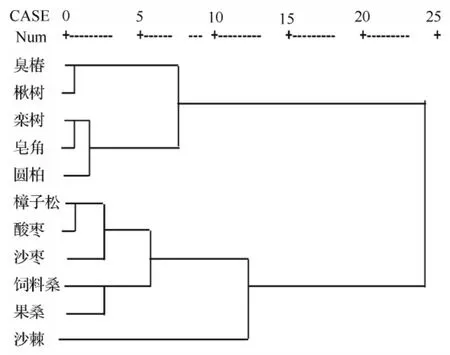
图3 以根系形态和相对生长为变量的综合聚类结果
4 结论与讨论
根系特征是植物遗传特性、植物对生长环境适应的综合结果,所以,根系特性通常可以反映出植物在生长环境中的适应对策。根系结构是动态的,并受环境条件的调节[18]。根系生长发育强烈地受土壤养分(尤其是磷)[18]、水分[19]、机械阻力[20]、植物内源激素[21]等的影响,同时也受地上部分生长的反馈调节[22-23]。根系在干旱土壤中的伸长生长通常受到土壤水分胁迫和机械胁迫的单独或共同限制,而机械胁迫通常是根系在干旱土壤中伸长生长的主要限制因素[20]。沙地的机械胁迫通常较低,所以,各树种根系变化除水分胁迫因素外,主要取决于其遗传因素[11]。
根系垂直分布深度、根系生物量、根系长度以及根长密度是植物抗旱能力的重要指示指标[10-11],分布较深、根系紧凑、根长较大的植物具有较强的抗旱能力[18]。具有提水能力是树木适应干旱半干旱地区环境的重要特性[24],深根系树种可通过提升地下水分而具有较强的利用土壤深层次水分的能力[25],使得树木在土壤水分有效性较低、蒸腾需水较高的阶段接近储存在土壤深层中的水分,以维持树木的光合和蒸腾作用[26]。通常根系分布在30 cm以下就可使生长于降水量较低地区的植物在干旱期间更有效地接近土壤储存的水分,但是,根系生长间存在较小的差异即可导致植物在水分吸收能力上发生较大的差异,因此,根系特点,尤其是根系垂直分布深度是植物提高水分吸收能力和增加抗脱水能力以及避旱能力的重要机制[11]。
虽然11个树种的苗木根系垂直分布有显著差异,但均分布在较浅的土层中,这与北京地区降水量相对较高密切相关。即便如此,各树种间的新梢生长和根系形态特征仍有巨大差别。沙枣、皂角、圆柏新梢生长量较高,而果桑、饲料桑、樟子松、沙棘新梢生长较弱。皂角、栾树、圆柏、臭椿、楸树细根分化能力较强,但是,栾树和皂角根系垂直分布范围较小。饲料桑和果桑直径d<2 mm根系不够发达、根系分布集中,未能表现出主动适应环境的能力;果桑比根长最小、主根最发达,是适应土壤水分充足环境的典型表现[27-28]。沙枣、酸枣、樟子松直径 2 mm≤d≤5 mm和d>5 mm根系所占比例较高,根系垂直分布范围较大,利用土壤深层资源能力较强,表现出一定的主动适应性。沙棘根系不够发达,但因根系垂直分布范围大而具有较强的土壤深层资源利用能力。
植物适应于干旱环境的对策通常有避旱、抗旱和耐旱3种[29]。除果桑和饲料桑外,其余树种分别表现出一定的抗旱、耐旱和避旱能力。皂角、栾树和圆柏通过强烈的根系分化提高其对土壤资源的利用能力而抗旱;臭椿和楸树通过较强烈的根系分化适应大兴沙地环境;樟子松、沙棘、酸枣表现出一定的避旱能力,樟子松存活良好、生长较弱而表现出显著的耐旱特性[30],沙棘、沙枣则表现出显著的避旱特性。
总体上看,在降雨量较为丰沛的条件下,皂角、栾树、圆柏、臭椿和楸树均可作为大兴沙地的造林树种,但是,在较为干旱的年份,这些树种可能会产生生长不良的现象;樟子松、酸枣、沙枣和沙棘可较好地适应大兴沙地,但是,樟子松因生长缓慢,果桑和饲料桑因需要较高的土壤水分而不适宜于大兴沙地造林。
[1]陈忠林,曹微,唐凤德,等.水肥耦合对辽西北沙地胡枝子苗木生物量的影响[J].东北林业大学学报,2011,39(1):34-37.
[2]白玉荣,王林和,孟和,等.毛乌素沙地臭柏变异类型主要形态学性状的比较[J].内蒙古农业大学学报:自然科学版,2009,30(2):151-156.
[3]黄刚,赵学勇,崔建垣,等.水分胁迫对2种科尔沁沙地植物光合和水分利用特性的影响[J].西北植物学报,2008,28(11):2306-2313.
[4]王力刚,赵岭,许成启,等.嫩江沙地4种针叶树光合特性及生态适应性特征[J].东北林业大学学报,2010,38(6):17-19.
[5]Peng Y,Xue D Y,Liu M Z,et al.Leaf gas exchange and water potential characteristics of plants with different photosynthetic pathways in hunshandak sandland[J].Acta Botanica Boreali Occidentalia Sinica,2010,29(10):2000-2006.
[6]孟鹏,李玉灵,张柏习,等.沙地彰武松与樟子松苗木抗旱生理特性比较[J].林业科学,2010,46(12):56-63.
[7]闫德仁,杜敏,王玉华.沙地樟子松天然林自然落种和土壤种子库的特征[J].东北林业大学学报,2009,37(11):11-12(6).
[8]金剑,王光华,刘晓冰,等.东北黑土区高产大豆R_5期根系分布特征[J].中国油料作物学报,2007,29(3):266-271.
[9]Anbumalarmathi J,Nadarajan N,Ganesh S K.Studies on root characters for drought resistance[J].Indian Journal of Agricultural Research,2008,42(1):71-74.
[10]Alil M A,Abbas A,Niaz S,et al.Morpho-physiological criteria for drought tolerance in sorghum(Sorghum bicolor)at seedling and post-anthesis stages[J].International Journal of Agriculture Biology,2009,11(6):674-680.
[11]Henry A,Gowda V R P,Torres R O,et al.Variation in root system architecture and drought response in rice(Oryza sativa):Phenotyping of the Oryza SNP panel in rainfed lowland fields[J].Field Crops Research,2011,120:205-214.
[12]Songsri P,Jogoy S,Vorasoot N,et al.Root distribution of drought-resistant peanut genotypes in response to drought[J].Journal of Agronomy and Crop Science,2008,194:92-103.
[13]Pace P F,Cralle H T,El-Halawany S H M,et al.Drought-induced changes in shoot and root growth of young cotton plants[J].Journal of Cotton Science,1999,3:183-187.
[14]张国盛,吴国玺,王林和,等.毛乌素沙地臭柏(Sabina vulgaris)和油蒿(Artemisia ordosica)群落的细根分布特征[J].生态学报,2009,29(1):18-27.
[15]马阔东,高丽,闫志坚,等.库布齐沙漠不同类型沙地上植物群落根系研究[J].草业科学,2010,27(5):1-9.
[16]成向荣,黄明斌,邵明安.沙地小叶杨和柠条细根分布与土壤水分消耗的关系[J].中国水土保持科学,2008,6(5):77-83.
[17]刘永兵,岳德鹏,王晓东.北京南郊沙地风蚀物理特征及防护对策研究:以大兴区为例[J].水土保持学报,2005,19(1):32-35,48.
[18]Lynch J P.Root architecture and nutrient acquisition in Bassiri Rad H.(Ed.)nutrient acquisition by plants:an ecological perspective[J].Ecological Studies,2005,181:147-183.
[19]Manschadi A M,Christopher J,Dem Voil P,et al.The role of root architectural traits in adaptation of wheat to water-limited environments[J].Functional Plant Biology,2006,33:823-837.
[20]Bengough A G,McKenzie B M,Hallett P D,et al.Root elongation,water stress,and mechanical impedance:a review of limiting stresses and beneficial root tip traits[J].Journal of Experimental Botany,2011,62(1):59-68.
[21]Tanimoto E.Regulation of root growth by plant hormones-roles for auxin and gibberellin[J].Critical Reviews in Plant Science,2005,24:249-265.
[22]Kramer P J.Water relations of plants[M].New York:Academic Press,1983:489.
[23]Wardle D A,Bardgett R D,Klironomos J N.Ecological linkages between aboveground and belowground biota[J].Science,2004,304:1629-1633.
[24]阿拉木萨,周丽芳.科尔沁沙地21种植物水分提升作用的实证检验[J].北京林业大学学报,2011,33(1):70-77.
[25]Oliveira R S,Bezerra L,Davidson E A,et al.Deep root function in soil water dynamics in cerrado savannas of central Brazil[J].Functional Ecology,2005,19:574-581.
[26]Meinzer F C,Goldstein G,Franco A C,et al.Atmospheric and hydraulic limitations on transpiration in Brazilian cerrado woody species[J].Functional Ecology,1999,13:273-282.
[27]胡卫民.果桑在防风固沙与护坡中丰产栽培技术[J].中国生态农业学报,2003(3):60.
[28]赵健,魏天兴,郑江坤,等.黄土区饲料桑栽培技术研究[J].林业实用技术,2010(6):18-19.
[29]樊荣,孙慧彦,刘艳平,等.树木对水分胁迫响应机理研究进展[J].内蒙古农业大学学报:自然科学版,2009,30(3):281-286.
[30]朱教君,康宏樟,李智辉.不同水分胁迫方式对沙地樟子松幼苗光合特性的影响[J].北京林业大学学报,2006,28(2):57-63.

