UC-MSC移植对CIA大鼠炎症因子表达水平的调控作用
李 慧 顾 健 林传明 顾 薇 沈连军
1.江苏省苏北人民医院风湿免疫科,江苏扬州 225001;2.江苏省苏北人民医院血液科 扬州市血液学研究所,江苏扬州 225001
类风湿关节炎(rheumatoid arthritis,RA)是以累及周围性小关节为主的系统性、炎症性自身免疫疾病,以关节滑膜细胞增生、炎症细胞浸润及血管翳形成为主要病理特征[1]。脐带间充质干细胞 (umbilical cord mesenchymal stem cells,UCMSC)是来源于脐带华通氏胶的一类多能干细胞,具有独特的免疫调节功能,以抑制炎性反应为主要特征。本文以胶原诱导型关节炎(CIA)大鼠为研究对象,观察UC-MSC对CIA大鼠炎症细胞因子的调节作用,为临床应用UC-MSC治疗RA提供实验依据。
1 材料与方法
1.1 实验动物
5 周龄,雌性,清洁级 SD 大鼠,90 只,平均体重(175±10)g,购置于南京大学模式动物研究所。
1.2 实验方法
1.2.1 CIA大鼠模型建立 ①分组:90只SD大鼠随机分为三组:空白对照组、模型组、UC-MSC治疗组,每组各30只;②造模:扬州大学医学院实验动物中心清洁级环境中适应性饲养1周,模型组及UC-MSC治疗组在乙醚麻醉下于第1天以每只0.1 mL(含鸡Ⅱ型胶原0.25 mg及0.05 mL完全弗氏佐剂)于SD大鼠右后足跖皮内注射,至第21天同前剂量于大鼠尾根部、左后足跖皮内再次多点激发免疫。空白对照组以生理盐水注射,方法同造模组。
1.2.2 UC-MSC移植 取融合度 85%的 P3代 UC-MSC,用0.25%胰蛋白酶消化,生理盐水清洗3遍,制成浓度为2×106/mL细胞悬液,用1 mL无菌注射器抽吸分装成0.5 mL/支(含1×106个细胞)。于造模完成后1周经大鼠尾静脉注射制备好的UC-MSC悬液0.5 mL/只;空白对照组及模型组同法注射等量生理盐水。
1.3 观察指标
1.3.1 从免疫当日起,采用双人双盲的方式在初免后1、2、3周,及治疗后1~5周,每周观察并采用关节炎指数(AI)评分法评定大鼠关节症状的严重程度。
1.3.2 于UC-MSC移植治疗后第1、3、5周,分别取空白对照组及模型组、UC-MSC组大鼠,麻醉大鼠后,经腹腔静脉取血4 mL置分离胶干燥管中,以3000 r/min、离心10 min后提取血清,置-20℃冰箱保存待测。用ELISA法检测血清白介素-1(IL-1)、IL-10、IL-17、IL-18。
1.4 AI评分法标准
据关节红肿范围和变形情况对大鼠进行评估。每只大鼠四肢评分相加,总分最高为16分。评价标准:0分=无关节炎;1分=有红色斑点或轻度肿胀;2分=关节部位中度肿胀;3分=严重肿胀,甚至皮肤破溃;4分=严重肿胀且不能负重。
1.5 统计学方法
采用Excel 2003软件及统计软件SPSS 16.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CIA大鼠一般情况及关节症状
所有CIA大鼠饮食及活动减少,神疲乏力,体重增长减慢;于初次免疫后第2天注射处足踝、趾、膝关节即出现瘀斑、轻度红肿;第6天开始红肿加重,关节处皮肤充血发亮,甚至破溃,关节活动受限伴负重困难、活动障碍,红肿逐步向对侧后肢及双前肢蔓延。空白对照组无上述表现,见图1。
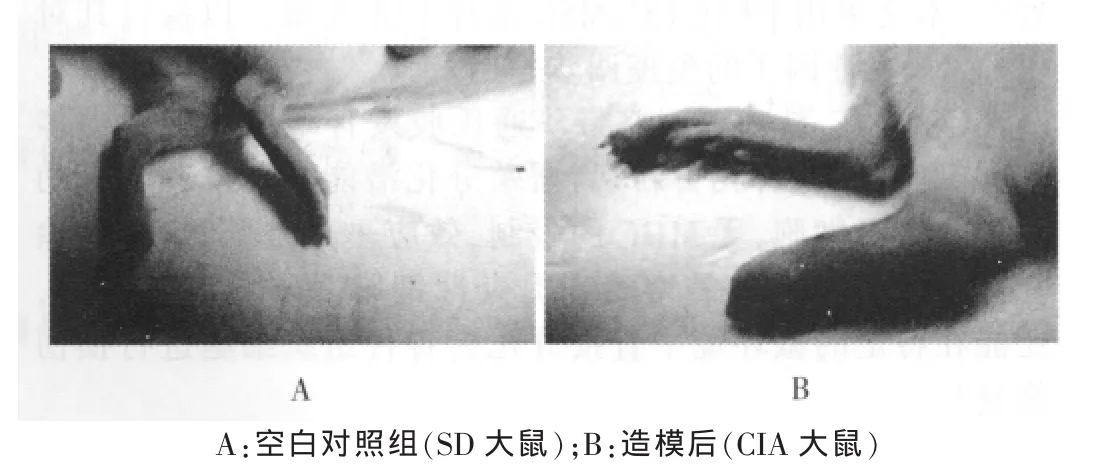
图1 造模前后大鼠关节表现
2.2 各组不同时期AI评分结果比较
模型组及UC-MSC治疗组CIA大鼠AI评分于初次免疫后第1周开始升高,至加强免疫后1周达最高,此后虽有下降,但仍维持在高水平状态,与同时期空白对照组比较,差异均有统计学意义 (均P<0.05);UC-MSC治疗组大鼠经UC-MSC治疗后AI评分逐渐降低,与同时期模型组比较,差异均有统计学意义(均P<0.05)。见表1。
2.3 各组不同时期血清 IL-1、IL-10、IL-17、IL-18 浓度比较
模型组 CIA 大鼠于治疗后第 1、3、5 周 IL-1、IL-17、IL-18平均水平明显高于同期空白对照组,差异均有统计学意义(均P<0.05),而IL-10水平明显低于同期空白对照组,差异有统计学意义 (P<0.05);UC-MSC治疗组治疗后第1、3周时IL-1、IL-17、IL-18水平较同期模型组显著降低、IL-10水平逐步上升,差异均有统计学意义(均P<0.05),至第5周上述指标与空白对照组相近,差异无统计学意义(P>0.05)。见表2。
表1 不同组期大鼠关节炎指数AI评分(±s,分)
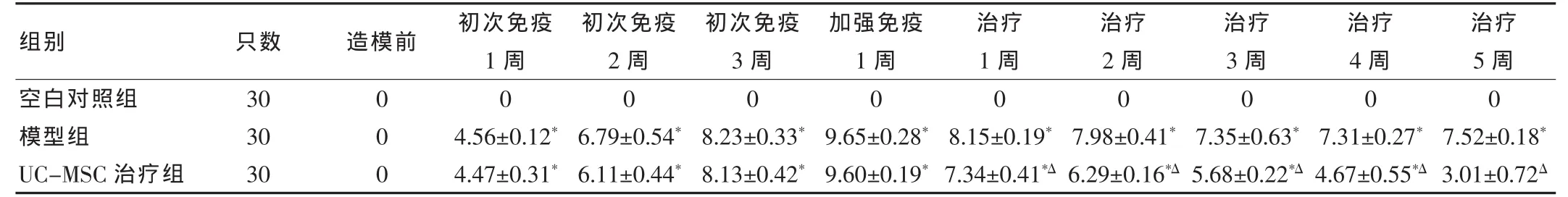
表1 不同组期大鼠关节炎指数AI评分(±s,分)
注:与同时期空白对照组比较,*P<0.05;与同时期模型组比较,ΔP<0.05
组别 只数 造模前 初次免疫1周初次免疫2周初次免疫3周加强免疫1周治疗1周治疗2周治疗3周治疗4周治疗5周空白对照组模型组UC-MSC治疗组3030300000004.56±0.12*4.47±0.31*6.79±0.54*6.11±0.44*8.23±0.33*8.13±0.42*0000009.65±0.28*9.60±0.19*8.15±0.19*7.34±0.41*Δ 7.98±0.41*6.29±0.16*Δ 7.35±0.63*5.68±0.22*Δ 7.31±0.27*4.67±0.55*Δ 7.52±0.18*3.01±0.72Δ
表2 各组不同时期血清IL-1、IL-17浓度结果比较(±s,pg/mL)
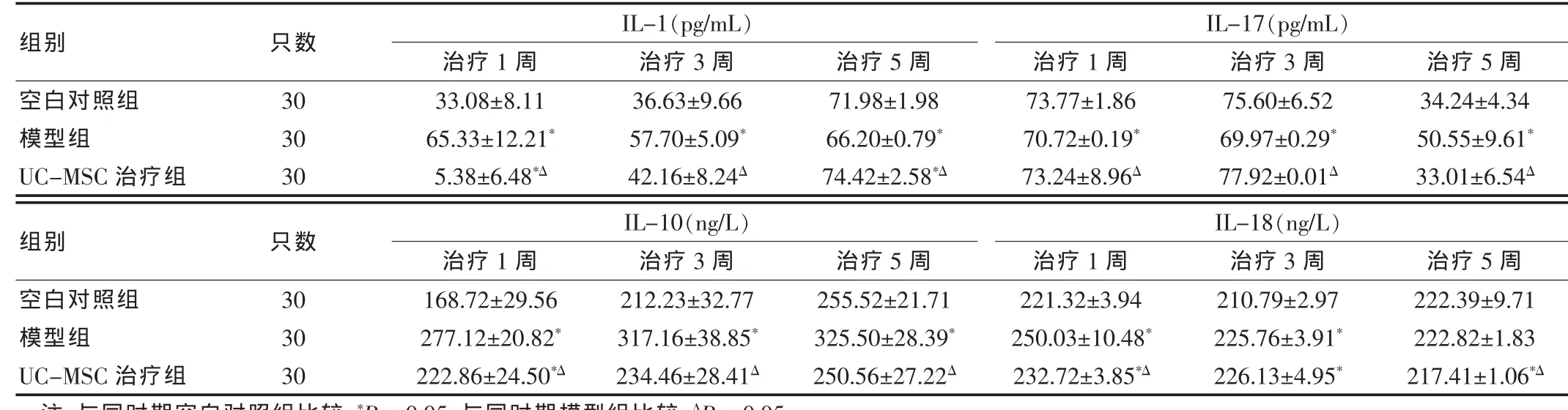
表2 各组不同时期血清IL-1、IL-17浓度结果比较(±s,pg/mL)
注:与同时期空白对照组比较,*P < 0.05;与同时期模型组比较,ΔP < 0.05
组别 只数 IL-1(pg/mL)治疗1周 治疗3周 治疗5周IL-17(pg/mL)治疗1周 治疗3周 治疗5周空白对照组模型组UC-MSC治疗组30303033.08±8.1165.33±12.21*5.38±6.48*Δ 36.63±9.6657.70±5.09*42.16±8.24Δ 71.98±1.9866.20±0.79*74.42±2.58*Δ 73.77±1.8670.72±0.19*73.24±8.96Δ 75.60±6.5269.97±0.29*77.92±0.01Δ 34.24±4.3450.55±9.61*33.01±6.54Δ组别 只数 IL-10(ng/L)治疗1周 治疗3周 治疗5周IL-18(ng/L)治疗1周 治疗3周 治疗5周空白对照组模型组UC-MSC治疗组303030168.72±29.56277.12±20.82*222.86±24.50*Δ 212.23±32.77317.16±38.85*234.46±28.41Δ 255.52±21.71325.50±28.39*250.56±27.22Δ 221.32±3.94250.03±10.48*232.72±3.85*Δ 210.79±2.97225.76±3.91*226.13±4.95*222.39±9.71222.82±1.83217.41±1.06*Δ?
3 讨论
RA是一种慢性系统性自身免疫疾病,在其发生、发展过程中存在多种细胞因子分泌的异常。CIA大鼠是RA最常用、最经典的动物模型,其特征除病变关节炎性细胞浸润、滑膜增生、关节软骨及骨组织破坏外,还兼有体液免疫及细胞免疫功能紊乱的特点,其发病机制与人类RA有很多相似之处[2]。本文采用P3代UC-MSC治疗CIA大鼠,以探讨其对CIA大鼠炎性因子的免疫调节作用。
UC-MSC是来源于脐带华通氏胶发育早期中胚层的多能干细胞,具有自我更新、高增殖分化潜能及免疫调节等功能的多能干细胞,无MHC的限制,效应呈剂量依赖性[3]。除能抑制促炎症细胞的增殖和促炎性细胞因子的分泌之外,还能在特定的微环境中直接分化为各种组织细胞进行损伤修复[4]。
本研究观察到,造模后CIA大鼠关节明显红肿、活动功能受限,AI评分亦逐渐增高,其血清IL-1、IL-17、IL-18水平明显高于正常空白对照组,而IL-10水平则显著降低,差异均有统计学意义(均P<0.05)。既往研究表明,IL-1是主要由单核细胞、巨噬细胞分泌的最具有多效性的细胞因子之一,可调节多种炎性细胞、免疫调节分子及前炎症介质的表达,能导致细胞外基质的破坏与重建,加快RA的关节破坏进程,在RA的骨侵蚀及软骨破坏中发挥重要作用[5]。IL-17主要由辅助性Th17细胞产生,可刺激成纤维细胞、上皮及内皮细胞释放多种促炎症细胞因子,并可诱导成纤维细胞表达细胞间黏附分子(ICAM-1)、促进T细胞增殖,以及与多种细胞因子协同放大炎症反应,加剧RA关节的破坏[6]。IL-18是天然性和适应性免疫应答的重要调节因子。研究亦表明RA患者的血清和滑液中的IL-18均明显升高,并且滑液中IL-18水平与RA活动呈相关性[7-8],此外,IL-18可诱导软骨细胞生成基质金属蛋白酶MMP-1等而促进软骨的降解[9]。IL-10是一种重要的炎症抑制因子,主要是由活化的Th2细胞、单核细胞及B细胞产生,可抑制有核细胞分泌多种细胞因子IL-1、肿瘤坏死因子-α等以发挥抗炎作用,亦可抑制单核细胞表面分子的表达,降低单核细胞的提呈抗原能力,阻断抗原特异性单核-巨噬细胞因子的产生。有研究认为,IL-10水平的降低可能会导致RA炎症的发展和组织破坏的加重[10]。本研究中,经UC-MSC治疗后IL-1、IL-17、IL-18水平逐渐降低、IL-10水平回升(P<0.05),至实验观察后期所有指标水平均接近空白对照组(P>0.05),实验结果表明CIA大鼠体内存在免疫系统紊乱,导致促炎性细胞因子IL-1、IL-17、IL-18分泌异常增高,而炎症抑制因子IL-10水平降低,机体处于促炎功能亢进、炎症抑制功能缺陷的状态,从而导致了疾病的发生与发展。UC-MSC可显著降低CIA大鼠血清炎症因子IL-1、IL-17、IL-18水平,而上调IL-10水平,通过其免疫调节功能恢复机体免疫系统平衡状态,减少炎性物质的渗出,减轻炎症反应,促进病变关节恢复。另外,有研究表明UC-MSC可靶向归巢至炎症病变部位,促进病变恢复。
总之,RA发病机制复杂,目前研究认为与机体免疫功能紊乱有关,其机体免疫功能处于紊乱状态,使促炎症细胞激活及功能亢进,而炎症抑制细胞下调及功能缺陷,从而引起细胞因子的释放及其他免疫细胞的活化、免疫球蛋白、趋化因子、氧自由基及白三烯等炎症介质产生增多,进而引起关节血管炎、滑膜增生、软骨及骨破坏。本研究中采用的UCMSC具有独特的生物学特性,既可在多环节上调节免疫,诱导免疫重建,恢复机体免疫系统平衡状态;又可通过炎性趋化作用直接参与损伤的修复,并能分泌多种基质分子,改善局部受损微环境加速损伤修复,促进病变恢复,为临床运用UC-MSC治疗RA提供实验依据。
[1]Goldring SR,Gravallese EM.Pathogenesis of bone erosions in rheumatoid arthritis[J].Curr Opin Rheumatol,2000,12(3):195-199.
[2]Brand DD,Kang AH,Rosloniec EF.Immunopathogenesis of collagen arthritis[J].Springer Semin Immunopathol,2003,25(1):3-18.
[3]Sun LY,Akiyama K,Zhang HY,et al.Mesenchymal stem cell transplantation reverses multiorgan dysfunction in systemic lupus erythematosus mice and humans[J].Stem Cells,2009,27(6):1421-1432.
[4]Kalwitz G,EndresM,Neumann K,et al.Gene expression profile of adult human bone marrow-derived mesenchymal stem cells stimulated by the chemokine CXCL7[J].Int J Biochem Cell Biol,2009,41(3):649-658.
[5]Jeong JG,Kim JM,Cho H,et al.Effects of IL-1 beta on gene expression in human rheumatoid synovial fibroblasts [J].Biochem Biophys Res Commun,2004,324(1):3-7.
[6]Lubberts E.IL-17/Th17 targeting:on the road to prevent chronic destructive arthritis?[J].Cytokine,2008,41(2):84-91.
[7]Pay S,Erdem H,Pekel A,et al.Synovial proinflammatory cytokines and their correlation with matrix metalloproteinase-3 expression in Behcets'disease.Does in terleukin-1beta play a mjor role in Behcets'synovitis?[J].Rheumatol Int,2006,26(7):608-613.
[8]Petrovic RL,Pejnovic N.Clinical significance of IL-18,IL-15,IL-12 and TNF-alpha measurement in rheumatoid arthritis[J].Clin Rheumatol,2006,25(4):448-452.
[9]Dai SM,Shan ZZ,Nishioka K,et al.Implication of interleukin 18 in production of matrix metalloproteinases in articular chondrocytes in arthritis:direct effect on chondrocytes may not be pivotal [J].Ann Rheum Dis,2005,64(5):735-742.
[10]Bozkurt FY,Yetkin Ay Z,Berker E,et al.Anti-inflammatory cytokines in gingival crevicular fluid in patients with periodontitis and rheumatoid arthritis:a preliminary report[J].Cytokine,2006,35(3-4):180-185.

