甘草次酸衍生物TY501对小鼠免疫系统的影响
靳如芳 郭 舜 张金晓 邸志权 田义红
1.天津中医药大学,天津 300193;2.天津市新药安全评价中心,天津 300301
甘草次酸是传统中药甘草发挥抗炎作用的主要药效成分。20 世纪50年代开始,中外许多学者研究证明甘草次酸具有抗炎作用,对多种急、慢性炎症均有明显的抑制作用[1-2]。甘草次酸类药物对机体免疫功能影响复杂。Yoshikama等[3]研究发现甘草甜素可选择性地增强辅助性T淋巴细胞的增殖能力和活性,使CD3+CD4+细胞增加,CD3+CD8+细胞减少。甘草酸类具有非特异性免疫调节作用,主要是增强细胞免疫作用,可增强巨噬细胞(Mφ)的吞噬功能,消除抑制性Mφ的抑制活性,还可选择性地增强辅助性T淋巴细胞的增殖能力和活性[4-5]。由天津药物研究院合成具有自主知识产权的TY501(11-脱氧甘草次酸-30-酰胺衍生物)为甘草次酸衍生物,具有甾体类似结构,经过前期一系列动物体内药效学实验,发现其具有类似甾体类药物(如泼尼松龙)的抗炎作用[6];长期毒性研究未发现其有甾体类药物(如泼尼松龙)的免疫抑制作用。现通过小鼠灌胃给药,研究TY501 对小鼠体重和中枢免疫器官胸腺、脾脏的影响,采用ADVIA 2120 血液分析仪测定小鼠外周血白细胞数及淋巴细胞、嗜中性粒细胞数量及比例,采用BD FACSAriaTMⅡ流式细胞仪测定药物对小鼠外周血中淋巴细胞亚型的影响,探究并比较TY501 与泼尼松龙对免疫系统影响的差异。
1 仪器与试药
1.1 试验药物
TY501:白色粉末,含量为97.8%,批号为20100512,天津药物研究院化学制药研究部提供。试验前用精制玉米油配制成适当浓度,供动物灌胃给药。
泼尼松龙:白色结晶粉末,含量98.2%,批号为PL100107,天津天药药业股份有限公司生产。试验前用0.5%羧甲基纤维素钠配制成适当浓度,供动物灌胃给药。
1.2 动物
ICR小鼠,雌雄各半,实验开始时小鼠体重均为18~22 g。北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2006-0009。饲料为鼠专用全价营养块料(天津市华荣实验动物科技有限公司生产)。动物均饲养在有中央空调的观察室,饮用动物饮用水。
1.3 主要试剂及仪器
精制玉米油(华北制药康欣有限公司生产,规格5 L/桶,批号:081203),羧甲基纤维素钠300~800 M[国药集团化学试剂有限公司生产,规格化学纯(CP)500 g,批号:20081015],染色检测试剂 (PerCP Hamster Anti-Mouse CD3e;FITC Rat Anti-Mouse CD4;PE Rat Anti-Mouse CD8a;PerCP Hamster IgG1,k Isotype;FITC Rat IgG2,k Isotype Control;PE Rat IgG2a,k Isotype Control;PE Mouse Anti-Mouse NK1.1;FITC Rat Anti-Mouse CD19;PE Mouse IgG2a,k Isotype Control。所有染色试剂均为BD Pharmingen公司提供流式专用试剂),流式细胞仪专用鞘液 (BD FACSFlow鞘液,规格:20 L,批号:1015300043)。
电子天平[梅特勒-托利多仪器(上海)有限公司,PL203],电子天平[(美国双杰兄弟(集团)有限公司常熟双杰测试仪器厂,T 2000)],血液分析仪(Siemens Healthcare Diagnostics Inc,ADVIA 2120),流式细胞仪(bdbiosciences.com,BD FACSAriaTMⅡ)
2 方法与结果
2.1 实验方法
实验设5组,每组10只动物,雌雄各半。分别为正常对照组、泼尼松龙组(15.0 mg/kg)、TY501 低剂量组(6.7 mg/kg)、T501 中剂量组(20.0 mg/kg)、TY501 高剂量组(60.0 mg/kg)。正常对照组给予动物饮用水;泼尼松龙组灌胃给予0.5%羧甲基纤维素钠配制的浓度为0.75 mg/ml的混悬液;TY501低、中、高剂量组分别灌胃给予精制玉米油配制的浓度为0.33、1.00、3.00 mg/mL的混悬液。各组分别连续灌服相应的药物23 d, 给药体积均为20 mL/kg。 于给药后第 0、7、14、21天分别称量动物体重;末次给药24 h后,用毛细管从眼眶静脉丛采血,0.25%乙二胺四乙酸(EDTA)抗凝,采用ADVIA 2120 血液分析仪测定小鼠外周血白细胞数及淋巴细胞、嗜中性粒细胞数量及比例,采用流式细胞仪测定外周血中淋巴细胞亚型 CD3+、CD3+CD4+、CD3+CD8+、CD3-CD19+、NK1.1 的比例;通过白细胞分类中淋巴细胞数量和淋巴细胞亚型的比例计算外周血中各淋巴细胞亚型的数量;称量动物体重,剖杀并称取脾脏、胸腺,计算脏器指数。
2.2 统计学方法
采用统计软件SPSS 11.5 对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,采用方差分析,多组间两两比较采用LSD-t检验。以P<0.05 为差异具有统计学意义。
2.3 结果
2.3.1 对小鼠体重、胸腺、脾脏的影响 结果显示,与正常对照组比较,给药第7 天至实验结束时,泼尼松龙组动物体重明显降低(P<0.01 或P<0.001);TY501 各剂量对动物体重未见明显的变化。与正常对照组比较,泼尼松龙组小鼠脾脏、胸腺湿重及相应系数明显降低(P<0.001),说明泼尼松龙对小鼠中枢免疫器官具有明显的抑制作用;TY501 各剂量组小鼠脾脏、胸腺湿重及相应系数未见明显的变化,提示TY501 各剂量组未对小鼠中枢免疫器官起到明显的抑制作用。见表1、2。
表1 不同给药组对小鼠体重的影响(±s,g)
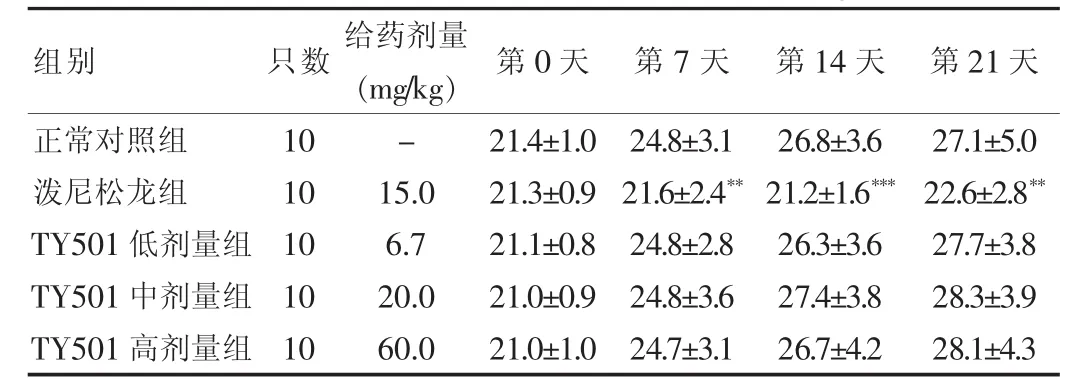
表1 不同给药组对小鼠体重的影响(±s,g)
注:与正常对照组比较,**P < 0.01,***P < 0.001;“-”表示无数据
组别只数 给药剂量(mg/kg) 第0 天 第7 天 第14 天 第21 天正常对照组泼尼松龙组TY501 低剂量组TY501 中剂量组TY501 高剂量组10 10 10 10 10-15.0 6.7 20.0 60.0 21.4 ±1.0 21.3 ±0.9 21.1 ±0.8 21.0 ±0.9 21.0 ±1.0 24.8 ±3.1 21.6 ±2.4**24.8 ±2.8 24.8 ±3.6 24.7 ±3.1 26.8 ±3.6 21.2 ±1.6***26.3 ±3.6 27.4 ±3.8 26.7 ±4.2 27.1 ±5.0 22.6 ±2.8**27.7 ±3.8 28.3 ±3.9 28.1 ±4.3
2.3.2 对小鼠外周血白细胞数及淋巴细胞、嗜中性粒细胞数的影响 与正常对照组比较,泼尼松龙组白细胞总数未见明显变化,淋巴细胞数明显降低(P<0.01),仅比正常对照组的50%略高,这与表2 得到的脾脏、胸腺重量及系数降低相一致;嗜中性粒细胞数明显升高(P<0.001),可能原因为动物由于免疫力下降存在隐性感染所致。TY501 低、中剂量组对小鼠白细胞总数、淋巴细胞数、嗜中性粒细胞数均未见明显变化,未出现与泼尼松龙组相类似的使小鼠淋巴细胞数显著下降的影响;TY501 高剂量组白细胞数及嗜中性粒细胞数明显升高(P<0.05 或P<0.01),可能是TY501 毒性反应的结果。结果见表3。
表2 不同给药组对小鼠脾脏、胸腺重量及系数的影响(±s)
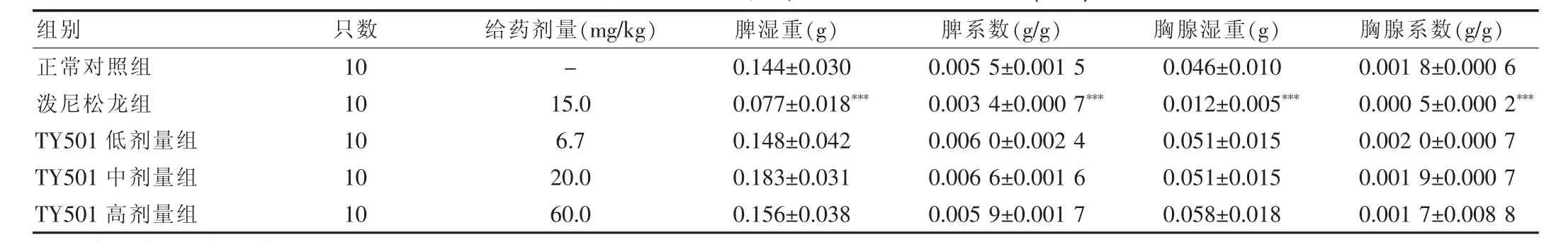
表2 不同给药组对小鼠脾脏、胸腺重量及系数的影响(±s)
注:与正常对照组比较,***P<0.001
组别只数 给药剂量(mg/kg) 脾湿重(g) 脾系数(g/g) 胸腺湿重(g) 胸腺系数(g/g)正常对照组泼尼松龙组TY501 低剂量组TY501 中剂量组TY501 高剂量组10 10 10 10 10-15.0 6.7 20.0 60.0 0.144 ±0.030 0.077 ±0.018***0.148 ±0.042 0.183 ±0.031 0.156 ±0.038 0.005 5 ±0.001 5 0.003 4 ±0.000 7***0.006 0 ±0.002 4 0.006 6 ±0.001 6 0.005 9 ±0.001 7 0.046 ±0.010 0.012 ±0.005***0.051 ±0.015 0.051 ±0.015 0.058 ±0.018 0.001 8 ±0.000 6 0.000 5 ±0.000 2***0.002 0 ±0.000 7 0.001 9 ±0.000 7 0.001 7 ±0.008 8
2.3.3 对小鼠外周血淋巴细胞亚型的影响 与正常对照组比较,泼尼松龙组给药后CD3+T总淋巴细胞和CD3+CD8+T淋巴细胞比例明显升高(P<0.01 或P<0.001),CD4+/CD8+比值显著降低(P<0.001),但结合给药后淋巴细胞绝对数量计算T淋巴细胞及其各亚型的数量发现,外周血中T总淋巴细胞绝对数量不仅没有升高,反而降低,各亚型T淋巴细胞中又以CD3+CD4+数量减少为主,CD3+CD8+数量没有明显变化,CD3-CD19+淋巴细胞比例与数量均显著降低(P<0.001)(表5),说明泼尼松龙对小鼠细胞免疫和体液免疫均有明显的抑制作用。与正常对照组比较,TY501 中、高剂量组给药后CD3-CD19+亚型淋巴细胞比例显著升高(P<0.05 或P<0.01),结合给药后淋巴细胞绝对数量计算发现各组B淋巴细胞、NK细胞数量增多,说明TY501 有增强体液免疫和非特异性免疫功能的趋势;由于CD3-CD19+亚型淋巴细胞比例显著升高致使CD3+、CD3+CD4+、CD3+CD8+T 淋巴细胞比例均有所降低(P < 0.05或P<0.01),CD4+/CD8+比值基本未有变化,结合给药后淋巴细胞绝对数量计算T淋巴细胞的数量发现,与对照组比较,TY501 各剂量组给药后T淋巴细胞数均没有降低,反而有所升高, 但仅TY501 低剂量组和TY501 高剂量组的NK1.1 值差异有统计学意义(P<0.05)。 结果见表4、5。
表3 不同给药组对小鼠外周血白细胞、淋巴细胞、嗜中性粒细胞数量的影响(±s,×109/L)
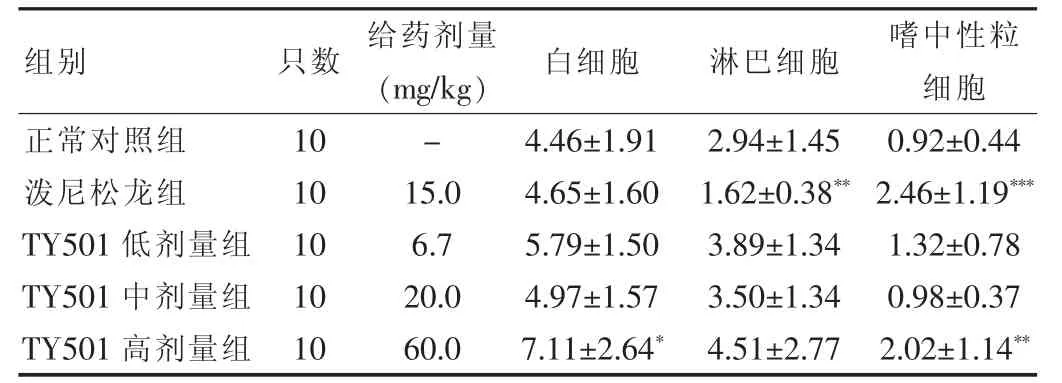
表3 不同给药组对小鼠外周血白细胞、淋巴细胞、嗜中性粒细胞数量的影响(±s,×109/L)
注:与正常对照组比较,*P<0.05,**P<0.01,***P<0.001
组别只数 给药剂量(mg/kg) 白细胞 淋巴细胞 嗜中性粒细胞正常对照组泼尼松龙组TY501 低剂量组TY501 中剂量组TY501 高剂量组10 10 10 10 10-15.0 6.7 20.0 60.0 4.46 ±1.91 4.65 ±1.60 5.79 ±1.50 4.97 ±1.57 7.11 ±2.64*2.94 ±1.45 1.62 ±0.38**3.89 ±1.34 3.50 ±1.34 4.51 ±2.77 0.92 ±0.44 2.46 ±1.19***1.32 ±0.78 0.98 ±0.37 2.02 ±1.14**
3 讨论
本研究结果表明,泼尼松龙持续灌胃给药21 d,对动物中枢免疫器官的发育生长产生了明显的抑制作用,胸腺、脾萎缩,重量及指数显著降低,外周血中淋巴细胞数量减少,CD4+/CD8+比例显著降低(P<0.001);CD3+CD8+亚型 T 细胞按其生物学功能又可分为抑制性细胞Ts或细胞毒性T细胞(CTL),其中Ts细胞可通过自身及分泌抑制因子在免疫反应中起负向调节作用,抑制B细胞和CD3+CD4+细胞的功能,从而抑制抗体形成及细胞免疫反应[7]。结合血液学测定仪和流式细胞仪测得的各亚型淋巴细胞的比例及计算各亚型淋巴细胞的数量结果显示,CD3+CD4+亚型淋巴细胞数量明显降低(P<0.05),B 淋巴细胞数量显著降低(P<0.001),说明泼尼松龙对动物机体免疫系统产生了明显的抑制作用,尤其对体液免疫功能抑制作用更为显著,这与有关文献的报道相一致[8]。糖皮质激素是强效的抗炎药物,临床上广泛应用,但由于其免疫抑制作用限制了它的临床应用。开发新型糖皮质激素类药物,在保留其抗炎活性的同时减少副作用尤为迫切,是近几年来国内外药物学家一直致力于研究的热点领域[9]。
表4 不同给药组对小鼠外周血中各淋巴细胞亚型比例的影响(±s,%)

表4 不同给药组对小鼠外周血中各淋巴细胞亚型比例的影响(±s,%)
注:与正常对照组比较,*P<0.05,**P<0.01,***P<0.001
组别只数 给药剂量(mg/kg) CD3+ CD3+CD4+ CD3+CD8+ CD4+/CD8+ CD3-CD19+ NK1.1正常对照组泼尼松龙组TY501 低剂量组TY501 中剂量组TY501 高剂量组10 10 10 10 10-15.0 6.7 20.0 60.0 52.3 ±5.9 61.9 ±8.6**47.3 ±11.1 44.9 ±7.5**45.9 ±6.9*40.5 ±4.9 39.4 ±6.9 35.4 ±8.0 33.8 ±5.4**31.3 ±10.3*9.1 ±1.9 18.3 ±4.9***7.9 ±2.4 7.7 ±2.3 7.2 ±1.4**4.6 ±1.0 2.3 ±0.6***4.3 ±1.5 4.7 ±1.2 4.7 ±1.0 29.2 ±5.7 8.3 ±3.8***32.3 ±13.1 38.3 ±7.7**35.3 ±6.1*3.9 ±1.1 7.7 ±3.3**4.5 ±2.3 4.1 ±1.4 5.3 ±1.9*
表5 不同给药组对小鼠外周血中各淋巴细胞亚型数量的影响(±s,×109/L)
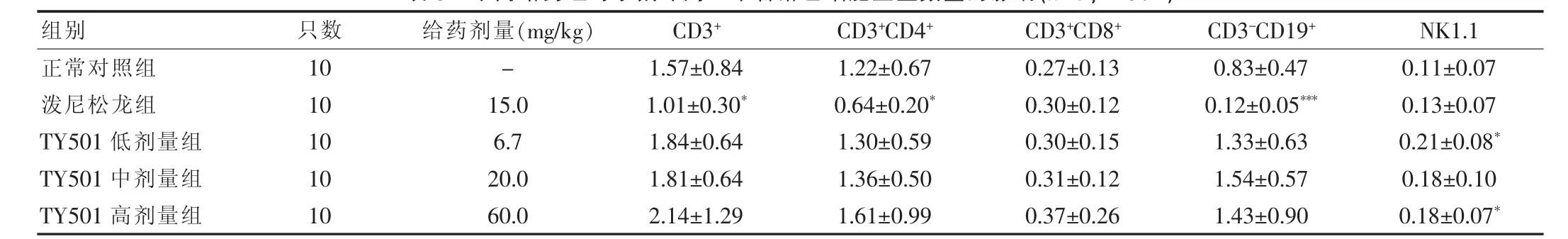
表5 不同给药组对小鼠外周血中各淋巴细胞亚型数量的影响(±s,×109/L)
注:与正常对照组比较:*P<0.05,***P<0.001
组别只数 给药剂量(mg/kg) CD3+ CD3+CD4+ CD3+CD8+ CD3-CD19+ NK1.1正常对照组泼尼松龙组TY501 低剂量组TY501 中剂量组TY501 高剂量组10 10 10 10 10-15.0 6.7 20.0 60.0 1.57 ±0.84 1.01 ±0.30*1.84 ±0.64 1.81 ±0.64 2.14 ±1.29 1.22 ±0.67 0.64 ±0.20*1.30 ±0.59 1.36 ±0.50 1.61 ±0.99 0.27 ±0.13 0.30 ±0.12 0.30 ±0.15 0.31 ±0.12 0.37 ±0.26 0.83 ±0.47 0.12 ±0.05***1.33 ±0.63 1.54 ±0.57 1.43 ±0.90 0.11 ±0.07 0.13 ±0.07 0.21 ±0.08*0.18 ±0.10 0.18 ±0.07*
TY501 持续灌胃给药21 d,对小鼠中枢免疫器官、外周血中淋巴细胞数量及比例、淋巴细胞亚型等均未产生抑制作用。甘草酸和甘草次酸是甘草中含量最高的苷类化合物,也是甘草的主要甜味成分[10]。TY501 为甘草次酸衍生物,具有甾体类似结构,动物实验表明剂量为6.0 mg/kg时TY501 对冰醋酸致炎性渗出、角叉菜胶性足肿等小鼠急性炎症具有最佳抗炎作用;在0.33 mg/kg时多次给药对慢性炎症模型大鼠棉球肉芽肿即有显著的抑制作用,其抗炎作用与泼尼松龙相当(本课题组药效学实验尚未发表资料)。与甾体类药物(泼尼松龙)相比,TY501 在保留了相当强的抗炎活性的同时,对小鼠免疫系统未发现明显的抑制作用,使其有望进一步被开发成为有鲜明特色的抗炎药物。
[1] 朱任之.甘草次酸钠口服给药的抗炎及免疫调节作用[J].中国药理学通报,1996,12(6):121-123.
[2] Takagi.Study of glycyrrhiza uralensis [J].Int J Oriental Med,1989,14(5):135-137.
[3] Yoshikama M,Matsui Y,Kawamoto H,et al.Effects of glycyrrhizin on immune-mediated cytotoxicity [J].Gastroenterol Hepatol,1997,12(3):243-248.
[4] 高章图,张建新,徐铎,等.甘草酸抗炎抗病毒及免疫调节作用研究进展[J].解放军药学学报,1999,15(5):27-29.
[5] 史桂兰,胡志浩.甘草酸药理作用及临床应用研究进展[J].天津药学,2001,13(1):10-12.
[6] 汤立达,王建武,雍建平,等.新型11-脱氧甘草次酸-30-酰胺衍生物的研究[J].中草药,2006,37(1):20-25.
[7] 王润洁,胡红,黄芳,等.胃癌患者外周血淋巴细胞免疫功能的变化及临床意义[J].临床医学工程,2009,16(9)26-28.
[8] 康晓萍,黄志.糖皮质激素对重症肌无力患儿T细胞亚群、体液免疫的调控及其干预作用[J].实用儿科临床杂志,2010,18(25):1419-1421.
[9] 李群益,颜建华,王明伟.糖皮质激素受体及其选择性调节剂研究进展[J].生命科学,2008,20(5):800-806.
[10] Hou Y Y, Yang Y,Neuroprotection of glycyrrhizin against ischemic vascular dementia in vivo and glutamate-induced damage in vitro[J].Clin Herb Med,2010,2(2):125-131.

