进水COD浓度对A2/O工艺EPS的影响
史长东,徐恒铎,赵瑞芳
(1.吉林市能源测试检验所,吉林 吉林 132013;2.东北电力大学化学工程学院,吉林 吉林 132012)
A2/O工艺是厌氧-缺氧-好氧生物脱氮除磷工艺(Anaerobic-Anoxic-Oxic process)的简称,因其特有的技术经济优势和环境效益,越来越受到人们的高度重视,现已成为具有脱氮除磷要求的城市污水处理厂所广泛采用的工艺。该工艺运行过程中进水负荷的变化对微生物产生的EPS有显著影响。EPS的主要成分是一些不同类型的高分子物质,如多糖,蛋白质,核酸等聚合物,EPS填充并且形成了细菌之间的空间,形成了絮凝体的结构;EPS是生物絮体的主要组成部分,EPS占活性污泥中总有机物的比例大致在50% ~90%之间,絮体中总的EPS质量占活性污泥质量的80%左右,EPS被认为是决定絮凝体物理化学性质和生物性质的关键物质。微生物被EPS包埋在里面。因此,EPS为固着的细胞创造了一个由其本质所决定的微生物环境。研究显示在传统活性污泥法中随着污泥负荷的减少,溶解氧的增多,EPS的量有所增加。本文主要从进水负荷对EPS合成的影响进行探讨。检测中以LB、TB的量来衡量EPS的含量。LB(Loosely Bound EPS)为松散附着层,TB(Tightly Bound EPS)为紧密粘附层。LB位于外层,它的结构较松散,是可向周围扩展且没有明显边缘的粘液层;TB位于LB的内层,它与细胞的表面结合比较紧密,具有一定外形,并且稳定地附着于细胞壁外。
国内外关于EPS的研究大多用于膜污染的防治[7]。Morgan J W等[8]研究了EPS与细胞的相互作用对微生物絮凝性的影响,证明多价离子(如钙离子、镁离子)与EPS架桥能够提高微生物聚集体的絮凝性,促进絮体形成。Mayer等[9]发现EPS和离子共存是维持微生物聚体结构的主要作用之一,离子(尤其是二价离子)可以平衡与掩蔽部分电荷,削弱静电斥力,与周围发生架桥作用。Sobeck等[10]研究表明,多价离子和EPS带负电荷的官能团发生架桥作用,有助于絮体聚集,并能加固高聚物和微生物所形成凝聚体的结构,促进生物絮凝。国内主要集中在EPS组成成分的确定[11-13],关于EPS对絮体的影响以及EPS对污泥特性的影响研究较少。
本研究考察进水负荷对EPS浓度的影响,以达到提高活性污泥系统的可控性和处理效率,稳定运行效果的目的。
1 试验材料与方法
1.1 实验装置
实验装置如图1所示,A2/O反应器采用有机玻璃制成,装置内部由隔板分为8个隔室,折流方式运行。其中第一、二隔室为厌氧区,第三、四隔室为缺氧区,后四个隔室为好氧区,反应器有效容积为60 L,其中厌氧区缺氧区好氧区体积比 =112。二沉池采用竖流式,容积为5 L。实验进水、污泥回流及硝化混合液回流均采用蠕动泵控制。厌氧区与缺氧区内安装有搅拌器将污泥搅拌均匀呈悬浮态。好氧区氧气由气泵提供,气体通过曝气砂头鼓出均匀且微小的气泡以满足微生物的生长,供气量由供气管路上阀门控制。
工艺具体反应流程为:模拟生活污水经蠕动泵进入厌氧区第一隔室,在厌氧区内进行部分微生物自身合成去除氨氮及少量的反硝化作用脱氮,随后污水依次进入缺氧区和好氧区,在好氧区进行硝化作用的混合液再由蠕动泵回流至缺氧区进行反硝化,最后从好氧区排出的污水进入二沉池沉淀,二沉池下部沉积的污泥部分经蠕动泵回流至厌氧区进行再利用。
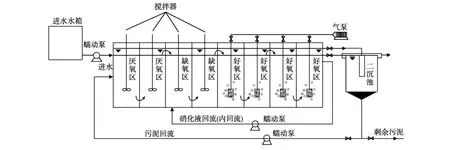
图1 实验装置图
1.2 原水水质
本实验采用模拟生活污水,进水pH为6.3-8.5,水温为常温(25-32℃),COD为60-500 mg/L,氨氮为0.8-25 mg/L,TN 为10-50 mg/L。
模拟生活污水由无水乙酸钠、氯化铵、磷酸二氢钠、硫酸镁、氯化钙等配制而成,见表1所示。根据实验研究的要求不同,通过调节无水乙酸钠投加量改变进水COD浓度。

表1 反应器中模拟生活废水成分
1.3 分析项目及检测方法
COD、LB、TB采用国家标准方法测定[14],采用物理法提取EPS[15]。每日取样一次,每次三个平行样品。EPS的量采用LB、TB含量衡量,利用胞外聚合物的结构(LB为松散附着层,TB为紧密粘附层)来表征其组成[3]。
1.3.1 EPS 提取
将污泥样品采用TGL-16B台式离心机离心5 min(5000 G)后弃去上清液。加入0.9%的NaCl溶液至原体积后,采用HS-120D超声波清洗机进行超声波振荡2 min,再采用TGL-16B台式离心机离心10 min(5000 G)。所得上清液用于测定LB。
弃去多余的的上清液,加入0.9%的NaCl溶液至原体积后,采用HHS型电热恒温水浴锅在70℃条件下水解30 min后,再利用TGL-16B台式离心机离心15 min(5000 G)。所得上清液用于测定TB。
1.3.2 EPS 含量分析
分别取1.3.1中用于测定 LB和TB上清液10 mL,加入10 mL除盐水混合后,分别依次加入0.4 g HgSO4、10 mL重铬酸钾标准溶液、0.3 g Ag2SO4和30 mL浓硫酸后,加入适量沸石,加热至沸腾后继续加热回流2小时。冷却后,用已标定的硫酸亚铁铵溶液进行滴定,计算所得分别为LB和TB。
2 试验结果与分析
2.1 进水负荷对EPS组分的影响
进水COD浓度对EPS中LB的影响,如图2所示。当进水COD浓度为360-420 mg/L时,LB值大致为200 mg/L;当进水COD浓度低于360 mg/L时,LB值呈明显的上升趋势;当进水COD浓度高于420 mg/L时,LB值大幅下降。这说明EPS中LB的量随着进水COD浓度的降低而增加。当进水COD浓度增加时,微生物具有较慢的生长速率和较高的内源代谢水平,大量的细胞发生自溶,使得LB的含量增加。
图3表明进水COD浓度对EPS中TB的影响,当进水COD浓度为360~420 mg/L时,TB值大致为250 mg/L;当进水COD浓度小于360 mg/L或大于420 mg/L时,TB值在200~300 mg/L范围内变化。这说明EPS中TB含量随进水COD浓度的变化较小。
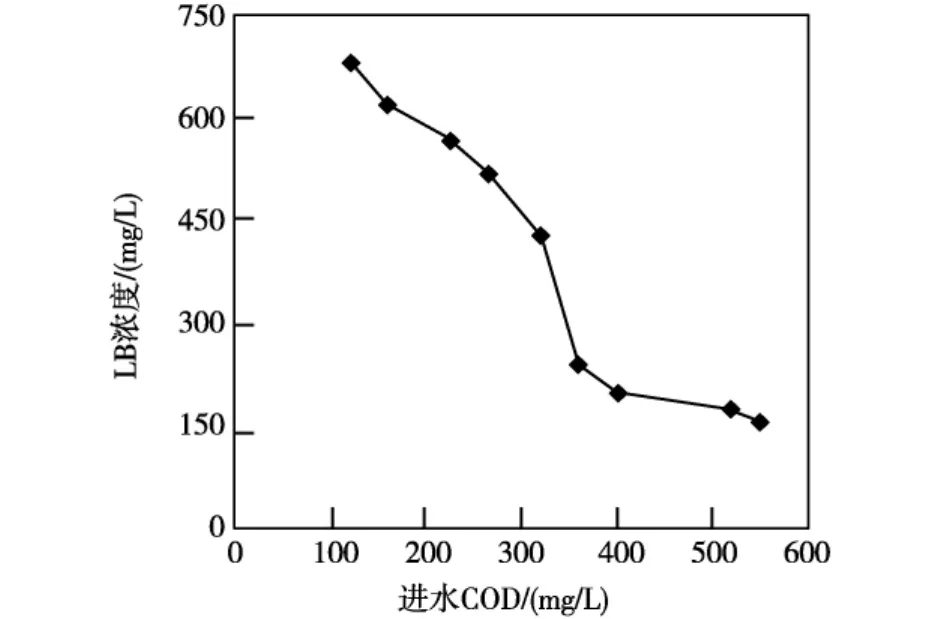
图2 不同进水COD浓度下LB值的变化

图3 不同进水COD浓度下TB值的变化
2.2 进水负荷对EPS含量的影响
如图4所示,随着进水COD浓度的降低,微生物细胞发生自溶现象,EPS的含量增加。当进水COD浓度较高时,细菌增殖速率高,细菌数量多,细菌占优势;此时细菌分泌的EPS较少,多糖含量较低,丝状菌可利用的基质少;此外,高负荷污泥的泥龄短,丝状菌世代周期长,故丝状菌无法成为优势菌种;因此,高负荷污泥的生态环境不利于丝状菌增殖。
随着进水COD的降低,细菌可利用的基质减少,增殖速率降低,细菌数量逐渐减少,活性降低。但是,在低基质浓度条件下,一方面由于丝状菌的Ks比细菌小,丝状菌增殖速率高,细菌的分泌和自溶使低负荷污泥中EPS含量较高,其中细菌自溶释放出部分胞内EPS;另一方面,低负荷时污泥EPS中多糖、DNA及蛋白质的含量较高,EPS中的大分子物质可以通过胞外酶的水解转化成为葡萄糖、氨基酸等可生物降解的小分子物质,而被丝状菌利用。因此,在低负荷污泥中,作为骨架的丝状菌优先利用了部分可生物降解的EPS作基质而增殖,这可能是低负荷时易发生污泥膨胀的重要原因。
2.3 EPS对污泥沉降性能的影响
图5表明EPS总量对活性污泥沉降性能的影响。图5表明,随着EPS总量的增大,SVI升高,污泥沉降性能逐渐变差。EPS总量与SVI呈正相关性,相关系数R2分别为0.9652。SVI反映了污泥不同的性质,描述了污泥的区域沉降与压缩沉降过程,与活性污泥的沉降性能密切相关。因此,EPS总量的增加可以导致污泥容积指数SVI的增大,使泥水分离难度加大,沉降性能变差。
从EPS的结构组分可知,LB与细胞体结合不紧密,是一种开放的疏松结构,含水分多,密度小,体积大,具有流变性,导致污泥絮体体积增大,并易引发污泥膨胀,这削弱了污泥絮体的压缩性,导致SVI增大。另外,LB含量的增加使污泥絮体界面的粗糙度相对增大,同时也可能会使絮体Zeta电位升高,造成絮体与水分离的难度增大,导致污泥的沉降性能变差。这与Forster[16]研究的结论相一致。
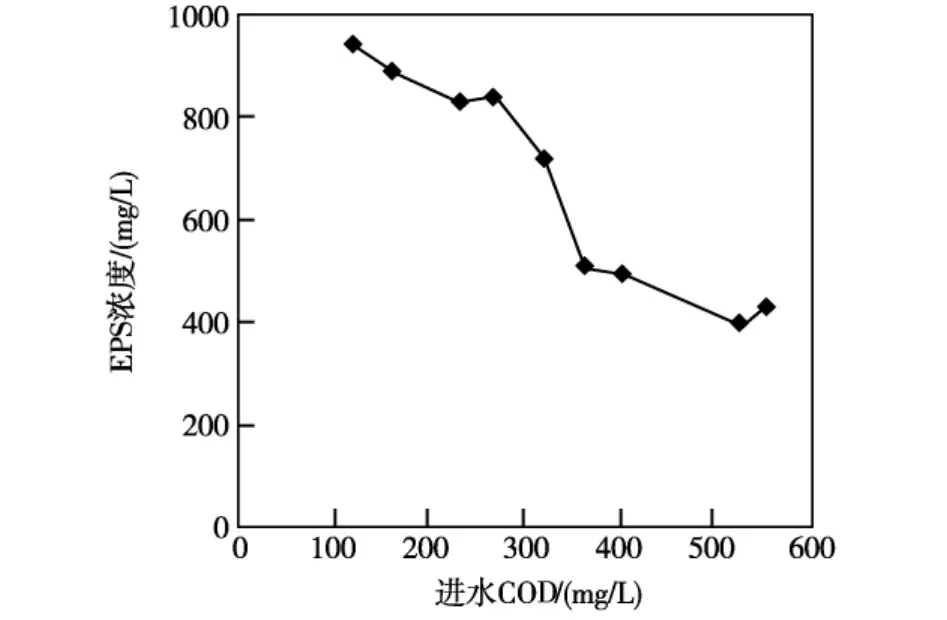
图4 不同进水COD浓度下EPS含量的变化

图5 EPS对污泥沉降性能的影响
4 结 论
(1)进水COD浓度对EPS中LB的量影响比较大,进水COD浓度的降低有利于LB的合成,微生物具有较慢的生长速率和较高的内源代谢水平,大量的细胞发生自溶,使LB的含量增加;进水COD浓度的变化对EPS中TB的量影响较小。
(2)进水COD浓度对EPS的合成影响较大。随着进水COD浓度的降低,微生物细胞发生自溶现象,EPS的含量增加。
(3)EPS的增加导致污泥容积指数SVI的增大,泥水分离难度加大,污泥沉降性能变差。EPS与SVI、呈线性正相关。
[1]章艳辉,唐英.A2/O工艺的固有缺陷及改进措施[J].山西建筑,2011,37(20):133-134.
[2]曾薇,李磊,杨莹莹等.A2/O工艺处理生活污水短程硝化反硝化的研究[J].中国环境科学,2010,30(5):625-632.
[3]高廷耀,顾国维,周琪.水污染控制工程.下册[J].3版.北京:高等教育出版社,2007.
[4]T Kuba.Phosphorus and nitrogen with minimal COD requirement by integration of denitrifying dephosphatation and nitrification in a two sludge system[J].Wat Res,1996,30(7):1702 -1710.
[5]周健,栗静静,龙腾锐等.胞外聚合物EPS在废水生物除磷中的作用[J].环境科学学报,2008,28(9):1758-1762.
[6]高永青,彭永臻,王建龙等.剩余污泥水解酸化过程中胞外聚合物的影响因素研究[J].2010,30(1):58-63.
[7]Jia X S,Fang H P,Furumai H .Surface Charge and Extrancelluar Polymer of Sludge in the Anaerobic Degradation Process[J].Water Science Technology,1996.34(5):309 -316.
[8]陈永志,彭永臻,王建华等.A2/O曝气生物滤池工艺处理低C/N比生活污水脱氮除磷[J].环境科学学报,2010,30(10):1957-1963.
[9]吴昌永,彭永臻,彭轶.A2/O工艺的反硝化除磷特性研究[J].中国给水排水,2008,24(15):6-10.
[10]吴昌永,彭永臻,彭轶.A2/O工艺中的污泥膨胀问题及恢复研究[J].中国环境科学,2008,28(12):1074-1078.
[11]Carucci A,Kuhni M,Brun R,et al.Microbial competition for the organic substrates and its impact on Ebpr system under conditions of changing carbon feed[J].Wat.Sci.Tech,2004,36(12):19 -27.
[12]国家环境保护总局水和废水监测分析方法编委会水和废水监测分析方法[M].3版.北京:中国环境科学出版社,2002:252-266.
[13]李久义,左华,栾兆坤,等.不同基质条件对生物膜细胞外聚合物组成和含量的影响[J].环境化学,2002,6(11):546-551.
[14]李圭白,张杰,彭永臻,等.水质工程学[M].北京:中国建筑工业出版社,2005:516-518.
[15]张宝军,耿德强,张雁秋.A2/O工艺处理城市污水的应用研究[J].煤矿环境保护,2002,16(3):32-35.
[16]Foster C F.Factors involved in the settlement of activated sludge nutrients and surface polymers[J].Water Res,1985,19(10):1259 -1264.

