豆浆中抗营养因子的去除方法
邓慧慧,王世忠,周志江,吴梦佳,韩 烨,肖华志
(天津大学化工学院,天津 300072)
豆浆中抗营养因子的去除方法
邓慧慧,王世忠,周志江,吴梦佳,韩 烨,肖华志*
(天津大学化工学院,天津 300072)
采用碱液浸泡、微波处理、加热处理、去皮等方法,对去除豆浆中抗营养因子的效果进行比较。其中,88℃恒温热处理10min可将豆浆中脂肪氧化酶活性降至常温下的14.20%,100℃恒温热处理20min可将豆浆中的胰蛋白酶抑制剂降低到9.96%。微波处理(2450MHz,800W)2min可以将脂肪氧化酶活性降至8.86%,处理8min可以将胰蛋白酶抑制剂活性降低到11.24%,处理4min即可将尿素酶活性降低至1%。相比于常规的热处理,微波处理可以更快速地破坏豆浆中的抗营养因子,缩短处理时间。此外,采用0.5%NaHCO3溶液浸泡、去皮等措施也可去除豆浆中的抗营养因子,可结合常规热处理、微波处理应用,以缩短加工时间。
豆浆,脂肪氧化酶,尿素酶,胰蛋白酶抑制剂,去除
Abstract:To compare the inactivation effect of different treatments on anti-nutritional factors,thermal treatment,microwave treatment,lye soaking,dehulling and other processing measures were applied.The result indicated that a thermal treatment at 88℃ for 10min reduced the lipoxygenase activity to 14.20%,while a thermal treatment at 100℃for 20min reduced the trypsin inhibitors activity to 9.96%.Treated by microwave cooking(2450MHz,800W) for 2min,lipoxygenase activity was reduced to 8.86%,and a microwave cooking(2450MHz,800W)for 8min and 4min reduced the trypsin inhibitor activity and urease actirity to 11.24%and 1%respectively.Compared to conventional thermal treatment,microwave cooking inactivated anti-nutritional factors more quickly,shortening the processing time.In addition,processing steps like soaking in 0.5%NaHCO3solution and dehulling contributed to the inactivation of anti-nutritional factors,and could be utilized combining with heat treatment and microwave treatment to reduce soymilk processing time.
Key words:soymilk;lipoxygenase;urease;trypsin inhibitors;inactivation
豆浆(Soymilk)含有大量的优质蛋白、多种矿物质和维生素,营养丰富,深受我国及许多其他亚洲国家人们的喜爱。但大豆原料中含有脂肪氧化酶、尿素酶、胰蛋白酶抑制剂、凝血素等多种抗营养因子,若不充分去除这些抗营养因子,不仅会影响豆浆的感官品质和营养价值,还会危害食用者的身体健康。脂肪氧化酶(Lipoxygenase)可催化大豆中的多不饱和脂肪酸的氧化,还可作用于大豆蛋白的末端氨基和羟基,不仅影响豆浆的营养价值还会产生具有豆腥味的物质;尿素酶(Urease)能将含氮化合物分解成氨,不利于人体健康;胰蛋白酶抑制剂(Trypsin inhibitors)可以抑制胰蛋白酶和胰凝乳蛋白酶的活性,从而影响人体对大豆蛋白质的消化和吸收[1-2]。因此去除抗营养因子的在豆浆加工中有重要意义。目前,有关传统处理方法(如去皮、浸泡、蒸煮等)对豆类中抗营养因子去除的研究虽有报道,却不够深入,尽管微波处理已被用于食品加工的灭酶处理中,将微波处理应用于的豆浆加工的研究却罕见报道[3-5]。本实验对传统热加工、碳酸氢钠溶液浸泡以及微波处理等处理方式对豆浆中抗营养因子的去除效果进行了较深入的研究,旨在为豆浆类食品生产工艺的开发提供科学依据。
1 材料与方法
1.1 材料与仪器
黄豆 自天津市正弘食品有限公司;BAPNA(Na-苯甲酰-DL-精氨酸-对硝基酰胺盐酸盐) 优级纯,Acros Organics公司;胰蛋白酶 活力为250NFU/mg,Solarbio公司;亚油酸、吐温20、石油醚、二甲基亚砜、尿素 分析纯,天津市江天化工技术有限公司。
UV1102型紫外-可见分光光度计 上海天美科学仪器有限公司;PB-10型精密pH计 SARTORIUS公司;HH型数显恒温水浴锅 金坛市金城国胜实验仪器厂;KJ23B-DE型微波炉(微波频率2450MHz,功率800W) 广东美的微波炉制造有限公司;KDC-160HR型高速冷冻离心机 科大创新股份有限公司中佳分公司。
1.2 样品制备
每份样品均称取干大豆20g,用蒸馏水清洗3次除去表面的尘土;破碎制浆后用40目筛过滤除渣;所有样品均保持大豆干重与蒸馏水的比例为1∶22,并做3组平行重复。
1.3 灭活处理
1.3.1 脂肪氧化酶的去除方法
1.3.1.1 热处理法 大豆分别在25、50、70、80、90、100℃蒸馏水中浸泡10min,打浆过滤。
1.3.1.2 微波处理法 大豆用常温蒸馏水浸泡16h后过滤除去水分,将大豆样品在玻璃板上单层展开,微波处理(2450MHz,800W)0、0.5、1、1.5、2、2.5、3min,冷却后打浆过滤。
1.3.1.3 碱液浸泡处理法 常温下大豆在0.5%NaHCO3溶液中浸泡16h,用蒸馏水冲洗去除表面碱液,打浆过滤。
1.3.1.4 去皮处理法 a.先浸泡后去皮:大豆在常温蒸馏水中浸泡16h后去皮,打浆过滤;b.先去皮后浸泡:干大豆去皮后在常温蒸馏水中浸泡16h,打浆过滤。
1.3.2 尿素酶的去除方法
1.3.2.1 微波处理法 大豆常温蒸馏水浸泡16h,破碎过滤得到豆浆。每份样品取100mL豆浆于烧杯中,微波处理(2450MHz,800W)0、2、4、6、8、10、15min,用蒸馏水补足体积至100mL。
1.3.2.2 碱液浸泡结合微波处理法 大豆在常温0.5%NaHCO3溶液中浸泡16h,蒸馏水冲洗去除表面碱液,打浆过滤得豆浆样品,微波处理(2450MHz,800W)0、2、4、6、8、10、15min,用蒸馏水补足体积。
1.3.3 胰蛋白酶抑制剂的去除方法
1.3.3.1 热处理法 大豆在常温蒸馏水中浸泡,破碎除渣得到豆浆样品,100℃恒温热处理0、5、10、15、20、25、30、35min。
1.3.3.2 碱液浸泡结合热处理法 大豆在常温0.5%NaHCO3溶液中浸泡16h,冲洗去除表面碱液,破碎除渣得豆浆样品,100℃恒温热处理0、5、10、15、20、25、30、35min。
1.3.3.3 微波处理法 见1.3.2.1。
1.3.3.4 碱液浸泡结合微波处理法 见1.3.2.2。
1.4 抗营养因子的测定
1.4.1 脂肪氧化酶活性的测定 根据文献[6]方法,改进后操作如下:
a.底物的配制:取10mL pH9.0硼酸缓冲液,加入0.25mL吐温20、0.27mL亚油酸,混匀后用1mol/L NaOH调pH至9.0,振荡至清澈透明,用pH9.0硼酸缓冲液定容至500mL。使用时将上述液体稀释20倍。
b.酶的提取:样品与石油醚按1∶1(体积比)脱脂,分液去油相,加入pH7.0磷酸缓冲液,搅拌并过滤即得酶提取液。
c.酶活的测定:取5.6mL底物溶液,加入0.4mL酶提取液,混匀反应,在243nm下扫描10min。空白采用已配制的底物溶液。
记录反应体系在234nm处吸光度值,绘制OD234值随时间变化曲线,取曲线初始线性部分,计算每分钟吸光度变化值ΔOD234。
则U=ΔOD234/0.01
酶活(U/mL)=活性单位数(U)×稀释倍数/0.4/样品体积(mL)
式中:ΔOD234为每分钟反应体系的吸光度的变化值;0.01为常数,定义每分钟吸光度值增加0.01为1个脂肪氧化酶的活性单位(U);0.4为反应体系中脂肪氧化酶提取液的添加量。
1.4.2 尿素酶活性的测定 取pH7.0尿素磷酸缓冲液10mL,加入3mL样品,摇匀并置于30℃恒温水浴中反应30min,测反应体系的pH;空白采用10mL pH7.0磷酸缓冲液与3mL样品反应,操作同上。样品反应体系的pH减去空白反应体系的pH即可表征尿素酶的活性[7]。
1.4.3 胰蛋白酶抑制剂活性的测定 根据文献[8-9]方法,改进后操作如下:
a.酶液的配制:40mg胰蛋白酶用0.001mol/L的盐酸定容至100mL,4℃保存备用。
b.底物溶液的配制:40mg BAPNA溶于1mL二甲基亚砜中,用37℃、pH8.2 Tris缓冲液稀释至100mL。
c.胰蛋白酶抑制剂的提取:取1mL样品加入40mL 0.01mol/L NaOH溶液,37℃恒温振荡3h,4℃恒温静置12h,取出后6000r/min离心10min,过滤即得提取液。
d.胰蛋白酶抑制剂活性的测定:样品组取5mL底物溶液加入1mL蒸馏水、1mL胰蛋白酶抑制剂提取液,摇匀,37℃水浴保温10min达到反应温度,加入2mL胰蛋白酶液,摇匀,37℃水浴中反应10min,加入30%乙酸溶液1mL终止反应,以空白溶液作参比,在410nm处测吸光度。将上述方法中的1mL胰蛋白酶抑制剂提取液换成1mL蒸馏水,重复其余操作,即得标准溶液的吸光度。
空白溶液的测定操作如下。取5mL底物溶液加入蒸馏水2mL、30%乙酸溶液1mL,摇匀,37℃水浴保温10min达到反应温度,加入2mL胰蛋白酶液,摇匀,37℃水浴中反应10min,取出冷却至室温。
活性的表示:定义每10mL反应体系在波长410nm处所减少的0.01吸光度值为1个胰蛋白酶抑制剂活性单位(TIU),则胰蛋白酶抑制剂的活性TIU=(Ar-As)/0.01。
2 结果与分析
2.1 脂肪氧化酶的活性分析
2.1.1 热处理对脂肪氧化酶活性的影响 加热灭酶是食品加工中最简单可行的方法之一。热处理灭酶的原理就是通过热变性使酶失活,因此热处理温度对灭酶的效果有重要影响。热处理温度对豆浆中脂肪氧化酶活性的影响见图1和图2所示。
从图1中可以看出,70℃以下的处理温度对脂肪氧化酶活性的去除作用不明显,热处理温度升高到70℃以上时,脂肪氧化酶活性开始迅速下降,80℃时的脂肪氧化酶活性为常温下的50.57%,90℃时脂肪氧化酶只残余11.35%,当温度上升至100℃时,脂肪氧化酶完全失活,表明脂肪氧化酶对热不稳定。
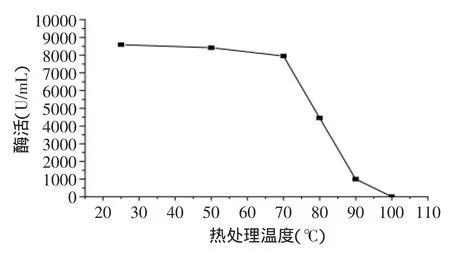
图1 热处理温度对脂肪氧化酶活性的影响Fig.1 Effect of heat reatment temperature on lipoxygenase residual activity
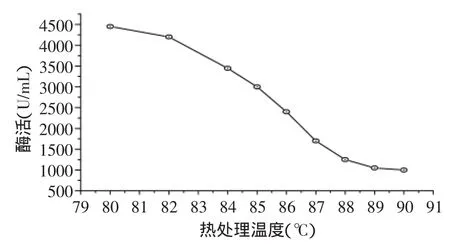
图2 温度在80~90℃之间时脂肪氧化酶的残留活性Fig.2 Residual activity of lipoxygenase while temperature ranging from 80 to 90℃
从图1可知,热处理温度在80~90℃之间时,脂肪氧化酶的活性急剧下降,对处理温度在80~90℃之间的酶活进行更详细的研究,其结果见图2所示。从图2中可以看出,热处理温度在80~87℃之间时,酶活随温度升高迅速降低;88~90℃之间时,酶活的随温度的变化较不明显,88℃恰为曲线的拐点,因此可作为豆浆加工中脂肪氧化酶去除的推荐热处理温度。
2.1.2 微波处理对脂肪氧化酶活性的影响 微波灭酶的机理是通过电磁波的作用使样品内部水、蛋白质、碳水化合物等极性分子受到变化电场的作用而剧烈振动,引起摩擦而产生热效应,使蛋白质等分子变性,从而达到灭酶的作用[10]。
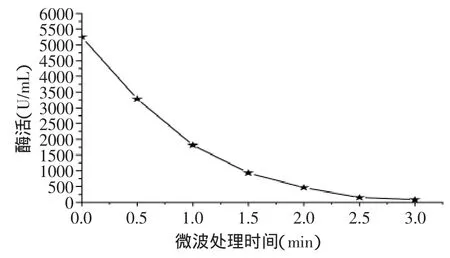
图3 微波处理时间对脂肪氧化酶活性的影响Fig.3 Effect of microwave cooking time on lipoxygenase residual activity
从图3中可以看出,随着微波处理时间的延长,脂肪氧化酶活性残余逐渐减少,处理1min可以灭活67.29%的脂肪氧化酶,处理2min可以灭活91.14%的脂肪氧化酶,处理3min可以使98.48%的脂肪氧化酶失活。微波处理2min即可使脂肪氧化酶活性控制在10%以内,可见微波灭酶迅速,有可能作为灭活脂肪氧化酶的有效方法而应用于豆浆加工中。
2.1.3 不同浸泡方式对脂肪氧化酶活性的影响 不同浸泡液体对脂肪氧化酶活性的影响见图4。从图4中可看出,采用0.5%NaHCO3溶液浸泡大豆对脂肪氧化酶有钝化作用,与用清水浸泡的对照组比较,采用0.5%NaHCO3溶液浸泡16h仅能使8.00%的脂肪氧化酶失活,灭酶效果不明显,这可能与选用溶液的浓度有关,为提高灭酶效果,可以考虑增大溶液的浓度,或者将碱液浸泡与热处理、微波处理等其他灭酶方式结合使用。
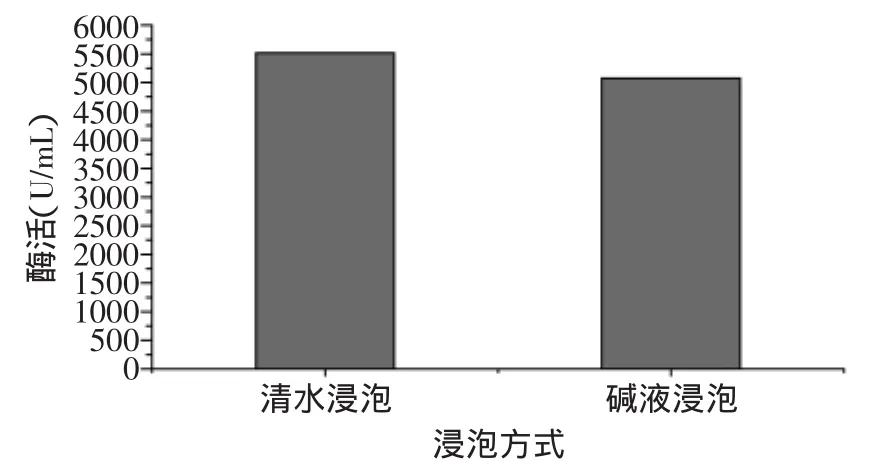
图4 不同浸泡液体对脂肪氧化酶活性的影响Fig.4 Effect of different soaking liquids on lipoxygenase residual activity
2.1.4 去皮处理对脂肪氧化酶活性的影响 去皮处理对脂肪氧化酶活性的影响见图5。从图5中可看出,去皮处理可以使豆浆中的脂肪氧化酶得到一定程度的去除,其中先浸泡后去皮的处理方式可以去除6.85%的脂肪氧化酶,而先去皮后浸泡的处理方式可以使豆浆中30.71%的脂肪氧化酶得到去除。去皮可以减少豆浆中脂肪氧化酶残留,这与大豆中的脂肪氧化酶在种皮中的大量分布有关。大豆经过浸泡之后,水溶性的脂肪氧化酶可能会随水分从种皮转移到大豆种子的其他部位,因此先去皮再浸泡的处理方式对降低豆浆中脂肪氧化酶的含量有帮助。
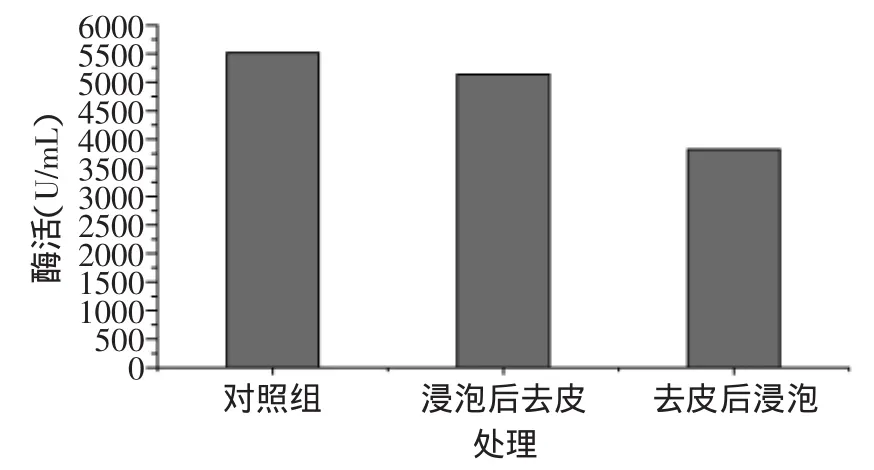
图5 去皮处理对脂肪氧化酶活性的影响Fig.5 Effect of dehulling on lipoxygenase residual activity
2.2 尿素酶的活性分析
在大豆所含的酶类中尿素酶的活性较强,且其在热处理中失活的速率与凝血素、胰蛋白酶抑制剂等其他抗营养因子基本一致,因此常被视为表征抗营养因子破坏程度的指示酶。本实验研究了微波处理对豆浆中尿素酶活性的影响,结果见图6。
从图6中可以看出,采用微波处理4min即可将豆浆中尿素酶基本灭活。当微波处理时间小于4min时,0.5%NaHCO3溶液浸泡处理对尿素酶的灭活有促进作用,但是与采用蒸馏水浸泡相比,其结果并无很大差异,产生这种结果可能因为0.5%NaHCO3为弱碱性溶液而尿素酶对碱较稳定。因此,豆浆加工中尿素酶的去除推荐采用4min的微波处理。
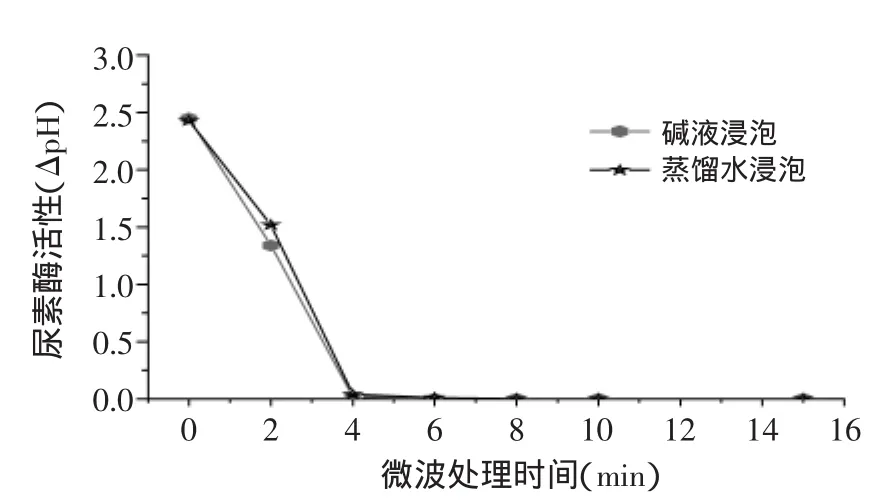
图6 微波处理对尿素酶活性的影响Fig.6 Effect of microwave cooking on urease residual activity
2.3 胰蛋白酶抑制剂的活性分析
胰蛋白酶抑制剂是豆制品加工中最重要的抗营养因子之一,其热稳定性高于脂肪氧化酶、凝血素等抗营养因子,因此是衡量豆制品热处理是否充分的重要标准。据文献报道,豆制品中胰蛋白酶抑制剂破坏90%以上时才能达到最佳的营养水平[11]。
2.3.1 热处理对胰蛋白酶抑制剂活性的影响 100℃下不同处理时间对胰蛋白酶抑制剂活性的影响见图7。从图7中可以看出,随着热处理时间的延长豆浆中的胰蛋白酶抑制剂活性逐渐降低,且采用0.5%NaHCO3溶液浸泡大豆对胰蛋白酶抑制剂的去除有促进作用,这与前人的研究结果基本一致[12];用蒸馏水浸泡大豆时,100℃恒温热处理10min可将豆浆中的胰蛋白酶抑制剂活性降低到21.38%,处理20min可以降低到9.96%,30min基本失活;采用0.5%NaHCO3溶液浸泡时,处理5min即可将豆浆中的胰蛋白酶抑制剂活性降低到21.71%,处理10min可以将其降低到9.32%,25min基本失活;可见采用0.5%NaHCO3溶液浸泡处理可以缩短灭酶时间,因此在豆浆的加工中,推荐采用0.5%NaHCO3溶液对大豆原料进行浸泡处理,然后在100℃热处理10min即可将胰蛋白酶抑制剂控制在安全水平。

图7 热处理对胰蛋白酶抑制剂活性的影响Fig.7 Effectofheatreatmentontrypsininhibitorsresidualactivity
2.3.2 微波处理对胰蛋白酶抑制剂活性的影响 微波处理对胰蛋白酶抑制剂活性的影响见图8。从图8中可以看出,微波处理时间越长则胰蛋白酶抑制剂残余越少,与用蒸馏水浸泡对比,采用0.5%NaHCO3溶液浸泡对胰蛋白酶抑制剂的去除有促进作用;用蒸馏水浸泡时,微波处理15min可将胰蛋白酶抑制剂完全破坏,处理8min可以将其降低到11.24%;而用0.5%NaHCO3溶液浸泡时,微波处理6min即可将胰蛋白酶抑制剂活性降低到6.09%,处理8min完全去除。因此,与常规的热处理相比,微波可以较快的去除豆浆中胰蛋白酶抑制剂,缩短加工时间[13-14],作为一种新型的加工方法可能应用于豆浆加工中;同时采用碱性或酸性溶液浸泡后再微波处理可以提高灭酶速度,进一步缩短加工时间[15]。
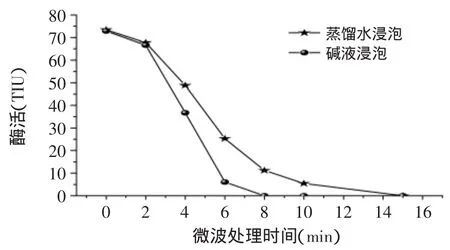
图8 微波处理对胰蛋白酶抑制剂活性的影响Fig.8 Effect of microwave cooking on trypsin inhibitors residual activity
3 结论与讨论
初步探讨了热处理、微波处理、0.5%NaHCO3溶液浸泡处理、以及去皮处理等措施对豆浆中脂肪氧化酶、尿素酶、胰蛋白酶抑制剂三种抗营养因子的去除效果。其中,常规热处理可去除豆浆中抗营养因子,热处理的温度和时间都是重要的控制参数,88℃恒温处理10min可将豆浆中脂肪氧化酶活性降至常温下的14.20%,100℃恒温热处理20min可将豆浆中的胰蛋白酶抑制剂降低到9.96%。微波处理(2450MHz,800W)2min可以将脂肪氧化酶活性降至8.86%,处理8min可以将胰蛋白酶抑制剂活性降低到11.24%,处理4min即可将尿素酶活性降低至1%。相比于常规的热处理,微波处理可以快速地去除豆浆中的抗营养因子,缩短处理时间,这在胰蛋白酶抑制剂的去除上表现得尤为明显。此外,采用0.5%NaHCO3溶液浸泡、去皮等措施也可以去除豆浆中的抗营养因子,可以用作辅助措施结合常规热处理、微波处理等措施,以达到更好的灭酶效果、缩短加工时间。
抗营养因子的去除是大豆制品加工中的一个重要任务,除了上述几种措施外,脉冲电场、超声波、流体静压(HHP)、超高温、高压蒸汽等处理措施也被应用于豆类抗营养因子的去除中[16-18],新型加工处理措施的开发、这些处理措施的参数控制以及各种处理对大豆制品营养品质影响的综合评价,是今后大豆抗营养因子研究的一个重点。
[1]李里特.大豆加工与利用[M].北京:化学工业出版社,2003:39-42.
[2]左进华,董海洲.大豆脂肪氧化酶研究现状[J].粮食与油脂,2007(9):1-3.
[3]Khattab R Y,Arntfield S D.Nutritional quality of legume seeds as affected by some physical treatments 2.Antinutritional factors[J].LWT-Food Science and Technology,2009,42(6):1113-1118.
[4]Mubarak A E.Nutritional composition and antinutritional factors of mung bean seeds(Phaseolus aureus) as affected by some home traditional processes[J].Food Chemistry,2005,89(4):489-495.
[5]Egounlety M,Aworh O C.Effect of soaking,dehulling,cooking and fermentation with Rhizopus oligosporus on the oligosaccharides,trypsin inhibitor,phytic acid and tannins of soybean (Glycine max Merr.),cowpea (Vigna unguiculata L.Walp) and groundbean (MacrotylomageocarpaHarms)[J].Journal of Food Engineering,2003,56(2):249-254.
[6]石彦国.大豆制品工艺学[M].北京:中国轻工业出版社,2005:310-311.
[7]卢晓凌,王忠艳.大豆脲酶活性的两种不同测定方法的研究[J].饲料工业,2008,29(2):54-56.
[8]鞠兴容,袁建,汪海封,等.GB/T 21498-2008大豆制品中胰蛋白酶抑制剂活性的测定[S].北京:中国标准出版社,2008.
[9]燕方龙,华蕾.大豆制品中胰蛋白酶抑制剂的抑制活性测定[J].理化检验-化学分册,2007,43(3):226-228.
[10]周红蕾,李春玲,王贵平,等.大豆中抗营养因子及其去除方法概述[J].饲料工业,2006,27(3):23-26.
[11]Guerrero-Beltran J A,Estrada-Giron Y,Swanson B G,et al.Pressure and temperature combination for inactivation of soymilk trypsin inhibitors[J].Food Chemistry,2009,116(3):676-679.
[12]DiPietro C M,Liener I E.Heat inactivation of the kunitz and bowman-birk soybean protease inhibitors[J].Journal of Agriculture and Food Chemistry,1989,37(1):39-44.
[13]Saleh A,Alajaji,Tarek A,et al.Nutritional composition of chickpea(Cicer arietinum L.) as affected by microwave cooking and othertraditionalcooking methods[J].JournalofFood Composition and Analysis,2006,19(8):806-812.
[14]Habiba R A.Changes in anti-nutrients,protein solubility,digestibility,and HCl-extractability of ash and phosphorus in vegetable peas as affected by cooking methods[J].Food Chemistry,2002,77(2):187-192.
[15]Osman M A,Reid P M,Weber C W.Thermal inactivation of tepary bean(Phaseolus acutifolius),soybean and lima bean protease inhibitors:effect of acidic and basic pH[J].Food Chemistry,2002,78:419-423.
[16]Li Yingqiu,Chen Qun,Liu Xiuhe,et al.Inactivation of soybean lipoxygenase in soymilk by pulsed electric fields[J].Food Chemistry,2008,109(2):408-414.
[17]Huang Huihua,Kwok Kin-Chor,Liang Han-Hua.Inhibitory activity and conformation changes of soybean trypsin inhibitors induced by ultrasound[J].Ultrasonics Sonochemistry,2008,15(5):724-730.
[18]Shah W H,Rehman Ziaur.Thermal heat processing effects on antinutrients,protein and starch digestibility of food legumes[J].Food Chemistry,2005,91(2):327-331.
Inactivation method of anti-nutritional factors in soymilk
DENG Hui-hui,WANG Shi-zhong,ZHOU Zhi-jiang,WU Meng-jia,HAN Ye,XIAO Hua-zhi*
(School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
TS214.9
B
1002-0306(2012)16-0268-05
2012-02-20 *通讯联系人
邓慧慧(1987-),女,硕士研究生,研究方向:食品加工工艺与食品安全。

