响应面法优化红花籽粕5-羟色胺衍生物提取工艺
李文聪,杨仁明,强 伟,索有瑞,丁晨旭*
1中国科学院西北高原生物研究所,西宁 810001;2中国科学院研究生院,北京 100049
红花(Carthamus tinctorius L)菊科属植物,是一种药、染料、油、饲料兼用的经济作物[1]。红花籽,中药习称“白平子”,是红花(Carthamus tinctorius L)的种子[1]。红花籽粕是红花籽提取油后的废弃物,国内多用作廉价的肥料和饲料,对其中的化学成分研究较少。近年来,国外对红花籽粕中的一些微量成分进行了研究,发现红花籽粕中的5-羟色胺衍生物具有极强的抗氧化性和清除自由基活性[2],可以调节人体内免疫反应,抑制肿瘤[3]、保护人体中的NK细胞免受程序性死亡[4]、强烈抑制黑色素生成等活性[5]。红花籽粕中的N-阿魏酰5-羟色胺和N-(p-香豆酰)5-羟色胺具有保护心脏的功能,可以促进心肌运动,预防心肌机能发生障碍[6]。有的研究还表明,N-(p-香豆酰)5-羟色胺可以促进成纤维细胞增殖[7],并且将会是一种很好的抗炎药物[8],对促进人类的健康有重要的意义。
1 材料与方法
1.1 材料与试剂
红花籽粕购自新疆;5-羟色胺硫酸肌酐标准品(纯度99%);甲醇、乙醇和正己烷(均为分析纯)。
1.2 仪器与设备
优普UPT系列超纯水器,成都超纯科技有限公司;ALC-110.4型电子天平,德国Acculab公司;HH-4数显恒温水浴锅,国华电器有限公司;EYELA N-1100型旋蒸蒸发仪,上海爱朗仪器有限公司;UV-759紫外-可见分光光度计,上海精密科学仪器有限公司。
1.3 5-羟色胺衍生物的提取方法
准确称取过筛后的红花籽粕5.00 g,加入不同的有机溶剂回流提取,提取液减压抽滤,用旋转蒸发仪蒸干,再用体积分数80%甲醇溶解,用正己烷萃取,取80%甲醇相,用旋转蒸发仪蒸发,用甲醇溶解测定5-羟色胺衍生物含量。
具体的操作流程:红花籽粕(原料)→过筛→红花籽粕粉末→回流提取→减压抽滤→滤液→蒸干→80%甲醇溶解→正己烷萃取→分液(80%甲醇相)→蒸干→甲醇溶解→5-羟色胺衍生物含量测定。
1.4 标准曲线的制作和5-羟色胺衍生物含量测定[8]
精确称取5-羟色胺硫酸肌酐标准品0.1 g,0.1 mol/L盐酸定容至100 mL。精密吸取1 g/L的5-羟色胺硫酸肌酐溶液 0.5、1.0、1.5、2.0、2.5 mL,分别置于10 mL容量瓶中,用0.1 mol/L盐酸定容。用0.1 mol/L盐酸做空白,310 nm波长处测5个样品的吸光度(A),以5-羟色胺衍生物浓度(C,g/L)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线。用最小二乘法计算得到回归方程 A=3.1802C+0.0222(R2=0.999)。
5-羟色胺衍生物提取得率/%=(红花籽粕5-羟色胺衍生物质量/红花籽粕质量)×100%
1.5 单因素实验设计
1.5.1 提取溶剂对提取得率的影响
准确称取5.00 g粉碎度为32目的红花籽粕粉末5份,分别置于250 mL圆底烧瓶中,液料比20∶1(mL/g),分别以70%乙醇、80%乙醇、90%乙醇、无水乙醇、甲醇和乙酸乙酯作为提取溶剂,80℃条件下回流提取2 h。
1.5.2 原料粒度对提取得率的影响
选取12、20、32、40和60目的红花籽粕进行研究。其他的回流提取条件:无水乙醇为提取溶剂、回流温度为80℃、回流提取时间为2 h、液料比为20∶1,测定提取得率。
1.5.3 提取时间对提取得率的影响
控制回流条件:提取溶剂为无水乙醇、原料粒度32目、液料比为20∶1、提取温度为80℃。提取时间选取0.5、1、1.5、2、2.5、3,考察其对提取得率的影响。
1.5.4 提取温度对提取得率的影响
控制回流条件:提取溶剂为无水乙醇、原料粒度32目、液料比为20∶1、提取时间为2 h。提取温度选取50、60、70、80和90℃,考察其对提取得率的影响。
1.5.5 液料比对提取得率的影响
控制回流条件:提取溶剂为无水乙醇、原料粒度32目、回流温度80℃、提取时间2h。液料比选取5∶1、10∶1、15∶1、20∶1、25∶1,考察其对提取得率的影响。
1.6 响应面法优化设计
本试验采用Design expert8.0软件中的Box-Behnken中心组合试验设计响应面试验。根据单因素试验结果,选取提取时间、提取温度和液料比3个因素作为试验因素,以5-羟色胺衍生物提取得率为响应值设计试验,试验因素及水平见表1。

表1 红花籽粕5-羟色胺衍生物提取响应面试验因素与水平Table 1 Factors and levels of experimental response surface methodology
2 结果与分析
2.1 单因素实验结果
2.1.1 提取溶剂对5-羟色胺衍生物提取得率的影响
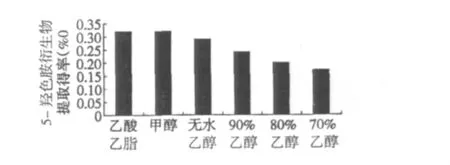
图1 不同提取溶剂对5-羟色胺衍生物提取得率的影响Fig.1 Effects of extraction solvent type on 5-hydroxytryptamine derivatives
从图1可以看出,不同提取溶剂对红花籽粕中5-羟色胺衍生物提取得率影响较大。乙酸乙酯和甲醇的提取效果最好,无水乙醇的提取效果差一些。但无水乙醇安全、无毒,而且价格便宜、来源广泛,适合工业化操作。因此,选取无水乙醇作为提取溶剂。
2.1.2 原料粒度对5-羟色胺衍生物提取得率的影响

图2 原料粒度对5-羟色胺衍生物提取得率的影响Fig.2 Effects of size of material on 5-hydroxytryptamine derivatives

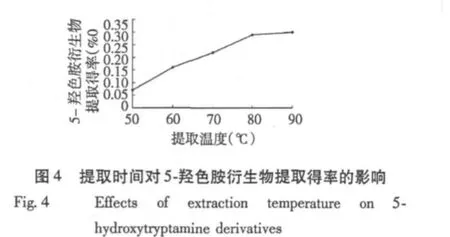

图5 液料比对5-羟色胺衍生物提取得率的影响Fig.5 Effects of liquid-to-solid ratio on 5-hydroxytryptamine derivatives
从图2可以看出,原料粒度小于32目时,原料粒度对提取效果的影响非常大。原料的粒度大于32目时,原料粒度的升高对提取得率没有影响。考虑到原料进行长时间的粉碎会增加了操作成本,而且从图1看,高于32目的粒度是没必要的,确定32目为最佳原料粒度。
2.1.3 提取时间对5-羟色胺衍生物提取得率的影响
由图3可知,提取时间对提取率有较大影响,随着提取时间的增加,5-羟色胺衍生物提取得率呈增长的趋势,在2.0 h之后增长趋势减缓,考虑到提取周期,选取1.5、2、2.5 h 进行中心组合试验。
2.1.4 提取温度对5-羟色胺衍生物提取得率的影响
由图4可知,5-羟色胺衍生物提取得率随温度升高而增加,在80℃之后,增长趋势减缓,故选取提取70、80、90℃进行中心组合试验。
2.1.5 液料比对5-羟色胺衍生物提取得率的影响
由图5可知,随着液料比增加,5-羟色胺衍生物提取得率有所增加,在料液比15∶1之后,得率随着用液量增加趋势明显减缓,考虑节约成本,选取液料比10∶1、15∶1、20∶1 进行中心组合试验。
2.2 响应面法优化红花籽粕5-羟色胺衍生物提取工艺
2.2.1 模型方差分析
对红花籽粕5-羟色胺衍生物提取工艺进行响应面分析,其具体试验方案及结果见表2。

表2 5-羟色胺衍生物提取工艺条件的优化试验设计及结果Table 2 Optimization of extraction conditions and results of experimental design
采用Design-Expert8.0软件对各因素回归拟合,得回归方程:5-羟色胺衍生物提取得率=0.53+0.04X1+0.035X2+0.031X3-0.7344 × 10-3X1X2-4.403 ×10-3X1X3-0.013X2X3-9.187 ×10-3♂ -0. 015♂
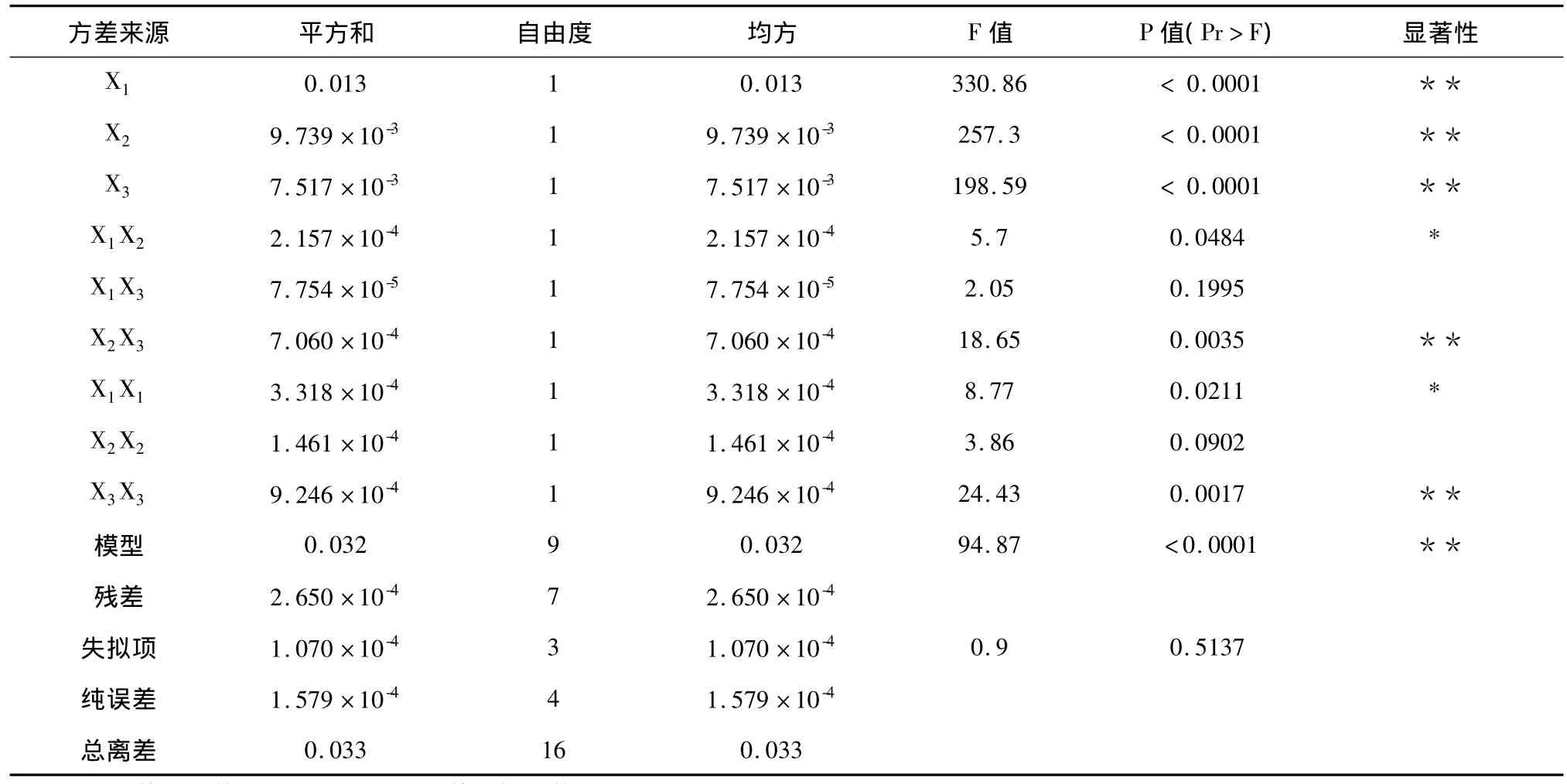
表3 方差分析结果Table 3 ANOVA of regression analysis
由表3可知,回归模型(P<0.0001)极显著,相关系数 R2=0.9874,失拟项(P=0.5137 >0.05)影响不显著,表明该模型拟合度很好,因此,可以用该回归模型对实验参数进行分析。回归模型方差分析的结果表明:X1、X2、X3、X2X3、X3X3(P <0.01)为极显著项;X1X2、X1X1(P <0.05)为显著项;其余项不显著。通过F值得出:提取时间(X1)对5-羟色胺衍生物提取得率影响最显著,其次是提取温度(X2),液料比(X3)的影响相对较少。
2.2.2 响应面分析
提取时间(X1)、提取温度(X2)、液料比(X3)3个因素之间的交互作用对5-羟色胺衍生物提取得率的影响如图6所示。其中,提取温度与液料比(X2X3)之间的交互作用极显著,随着温度和液料比的增加,5-羟色胺衍生物提取得率达到最大;提取时间与提取温度(X1X2)之间的交互作用显著;提取时间与液料比(X1X3)之间的交互作用不显著。
依据所得模型,可预测稳定状态下红花籽粕5-羟色胺衍生物的提取最优工艺:提取溶剂为无水乙醇、原料粒度为32目、提取时间为2.4 h、提取温度为89℃、液料比为19∶1。红花籽粕5-羟色胺衍生物的提取得率可达0.34%。
2.3 工艺验证
为了验证该响应面分析法结果的可靠性,按上述最佳工艺(提取时间为2.4 h、提取温度89℃、液料比19∶1)进行3次平行实验,实际测得5-羟色胺衍生物提取得率的平均值为0.33%。表明预测值(0.34%)与实际值(0.33%)之间具有很好的拟合性,从而进一步证明优化结果的可靠性。
3 结论
本文在单因素试验的基础上,采用Box-Behnken试验设计和响应面分析法对红花籽粕5-羟色胺衍生物提取工艺进行了优化,得出最佳提取工艺:提取溶剂为无水乙醇、原料粒度为32目、提取时间为2.4 h、提取温度为89℃、液料比为19∶1。回归分析和验证试验结果表明,采用响应面法优化红花籽粕5-羟色胺衍生物的提取工艺条件,得到的提取工艺流程具有实际应用价值。

图4 因素间交互作用的响应曲面和等高线图Fig.4 Response surface and contour plots between factors
1 Guo ML(郭美丽),Zhang HM(张汉明),Zhang MY(张美玉).Herbological Study of"Honghua.J Chin Med Mater(中药材),1996,19:202-203.
2 Kumarasamy Y,et al.Biological activity of serotonin conjugates from the seeds of Centaurea nigra.Fitoterapia,2003,74:609-612.
3 Arze E,et al.Serotonin inhibition of tumor necrosis factor-alpha synthesis by human monocytes.Life Sci,1991,48:2557-2562.
4 Betten A,et al.Serotonin protects NK cells against oxidatively induced functional inhibition and apoptosi.Leukoc Biol,2001,70:65-72.
5 Jung SR,et al.Inhibitory effects of active compounds isolated from safflower(Carthamus tinctorius L.)seeds for melanogenesis.Biol Pharm Bull,2004,27:1976-1978.
6 Hotta Y,et al.Protective effects of antioxidative serotonin derivatives isolated from safflower against post ischemic myocardial dysfunction.Molecular and Cellular Biochemistry,2002,238:151-162.
7 Takii T,et al.Multiple mechanisms involved in the inhibition of proinflammatory cytokine production from human monocytes by N-(p-coumaroyl)serotonin and its derivatives.Intl.ImrMunophar macol,2003,(3):273-277.
8 Kang GH,Chang EJ,Choi SW.Antioxidative activity of phenolic conrpounds in roasted safflower(Carthamus tinctorius L)seeds.Food Sci Nutr,1999,4:221-225.

