猪肺炎支原体斑点杂交检测方法的建立及应用
李桂兰,张映,邵国青
(1.山西农业大学 动物科技学院,山西 太谷030801;2.江苏省农业科学院 兽医研究所,江苏 南京210014)
猪支原体肺炎(Mycoplasma Pneumoniae of Swine,MPS,又名猪地方流行性肺炎和猪气喘病)是由猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)引起的慢性呼吸道病,主要症状为咳嗽和气喘,该病发病率高、死亡率低,主要引起猪的饲料转化率下降和生长受阻。MPS流行范围广,常与其他肺部病原如猪繁殖与呼吸综合征病毒(PRRSV)、猪流感病毒(SIV)及圆环病毒Ⅱ型(PCV-2)等协同作用,形成猪呼吸道病综合征(Porcine Respiratory Disease Complex,PRDC),导致死亡率升高,损失加剧,已成为现代养猪业的主要危害之一[1,2]。
猪肺炎支原体培养条件要求苛刻,易被其他支原体的生长而掩盖,因此病原的分离培养在临床诊断中的应用受到很大限制。血清学检测法与其他支原体存在严重的交叉反应,也给Mhp的诊断带来很大困难[3,4]。随着分子生物学的快速发展,核酸探针法已应用于多种病原微生物的检测,其中斑点杂交检测法具有快速、准确和易操作的优点。P36蛋白是Mhp的一种免疫优势蛋白,具有种特异性[5,6]。
本试验针对Mhp P36基因序列设计并合成一条地高辛标记的DNA寡核苷酸探针,通过条件优化建立了Mhp斑点杂交检测方法,并对猪肺样品进行检测,为Mhp的临床检测提供了快速准确的方法。
1 材料与方法
1.1 菌株和主要试剂
Mhp 168株冻干菌种:由江苏省农业科学院兽医研究所家畜重大疫病组保存。
猪鼻支原体(M.hyorhinis,Mh)、猪絮状支原体(M.flocculane,Mf)、猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)、副猪嗜血杆菌(Haemophilus parasuis,HPs)、猪圆环病毒Ⅱ(Porcine circovirus-2,PCV-2)、猪流感病毒(Swine influenza virus,SIV)和猪繁殖与呼吸障碍综合征病毒 (Porcine Reproductive and Respiratory Syndrome,PRRSV)的DNA或cDNA:均由江苏省农科院兽医所提供。
1.2 材料与仪器
预杂交液、寡核苷酸探针杂交液、封闭液、生物素化鼠抗地高辛抗体SABC-AP、BCIP/NBT显色剂购自武汉博士德公司;蛋白酶K、硝酸纤维素膜(Nitrocellulose Blotting Membranes,NC)和带正电的尼龙膜均购自南京生兴生物技术有限公司。德国3K15型Sigma离心机;DNP-9052型电热恒温培养箱,苏州江东精密仪器有限公司;德国Eppendorf微量核酸检测仪。
1.3 猪肺组织样品
人工发病猪(阳性对照)5头:将 Mhp Jss组织强毒用生理盐水稀释按每头猪一头份,气管注射接种于Mhp阴性的60日龄猪,于攻毒后25天剖杀各猪并采集肺组织,-20℃保存备用。健康猪(阴性对照)5头:60日龄健康猪,ELISA检测血清抗体为Mhp阴性,剖杀后采集肺组织,-20℃保存备用。可疑病猪38头:陆续收集的具有Mhp症状的可疑猪,剖杀后采集其肺组织,-20℃保存备用。
1.4 寡核苷酸探针的设计与合成
根据GenBank登录的 Mhp P36全基因(Gene ID:49109)序 列,设 计 一 条 探 针 (25bp):5′DIGAATCGCAAAAAGAGCAAAAGTATCG-3′由南京皓嘉生物科技有限公司(TAKARA公司)合成。
1.5 Mhp DNA的提取
取 Mhp培养物于4℃12 000r·min-1离心10min,取沉淀用PBS洗3次后,按照文献[7]采用酚-氯仿抽提法提取Mhp基因组DNA,作为模板,-20℃保存备用。
1.6 斑点杂交最佳反应体系及反应条件的建立
1.6.1 探针工作浓度的确定
先将带正电的尼龙膜和NC膜剪成适当大小,标记点样位置,用灭菌双蒸水将膜浸透,再浸到20×SSC中30min,取出,晾干;将DNA样品溶于TE,煮沸10min,冰中速冷;将变性后的DNA点样于膜上,每孔点1μL(100ng DNA),80℃烘烤2h备用。用杂交液稀释地高辛标记的寡核苷酸探针,参照文献[8]进行预杂交、杂交、洗涤、封闭、加抗体、显色等步骤。
1.6.2 探针的敏感性试验
将初浓度为100mg·L-1的 Mhp DNA经一系列稀释,变性后取1μL分别点样于尼龙膜和NC膜上,进行杂交(操作步骤同1.6.1),显色后进行结果判定。
1.6.3 探针的特异性试验
将猪鼻支原体(Mh)、猪絮状支原体(Mf)、猪胸膜肺炎放线杆菌(APP)、副猪嗜血杆菌(HPs)、猪圆环病毒Ⅱ(PCV-2)、猪流感病毒(SIV)和猪繁殖与呼吸障碍综合征病毒(PRRSV)的核酸变性后,分别点于尼龙膜和NC膜上,操作步骤同1.6.1,确定探针的特异性。
1.7 猪肺组织样品的检测
将采集的48份猪肺样品剪碎,用组织匀浆机制备匀浆。反复冻融病料,4000r·min-1离心3 min,取上清。每500μL上清中加入:50μL 10%SDS,12.5μL蛋白酶 K(20g·L-1),混匀后55℃水浴保温2~4h,直到组织匀浆变为清亮。参照文献[9]处理样品并制取样品模板。按照已经建立的斑点杂交反应体系和反应条件在尼龙膜上对样品进行检测,记录检测结果并分析。
2 结果与分析
2.1 探针工作浓度的确定
探针以6个不同的稀释度进行杂交,结果见图1。尼龙膜和NC膜上探针的最佳工作浓度均为25μg·L-1。

图1 斑点杂交探针最适工作浓度的确定Fig.1 The optimal concentration of Mhp DIG probe
2.2 探针的敏感性试验
将初浓度为100mg·L-1的 Mhp DNA经系列稀释,斑点杂交结果见图2,随着DNA浓度下降,显色逐渐变淡,经过计算可以得到Mhp Dig探针在尼龙膜上最低检出量为31.3pg,NC膜上最低检出量为250pg。

图2 斑点杂交探针敏感性试验Fig.2 Sensitivity test of Mhp DIG probe
2.3 探针的特异性试验
由图3可见,该探针仅与Mhp DNA反应,与其他7种病毒或细菌的模板不发生杂交反应,表明该探针具有良好的特异性。

图3 斑点杂交探针特异性试验Fig.3 Specificity test of Mhp DIG probe
2.4 猪肺组织样品的检测结果
将所建立的Mhp斑点杂交检测方法应用于猪肺样品的检测,结果见表1。人工发病猪的猪肺样品(阳性对照)的检出率为100%;健康猪肺样品(阴性对照)中未检出Mhp;38份可疑病料的猪肺样品中,15份中检出Mhp,检出率为39.5%。
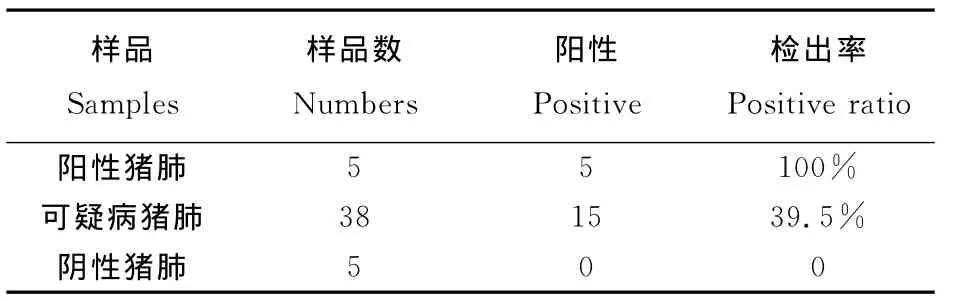
表1 猪肺组织样品中Mhp斑点杂交检测结果Table 1 The Mhp dot blot hybridization results of swine lung samples
3 讨论
Mhp通过引起猪支原体肺炎及与其他肺部病原体混合感染而引起猪呼吸道病综合征,给养猪业造成了严重经济损失。由于Mhp生长条件苛刻,难以培养,与猪鼻腔常在菌(如猪鼻支原体、猪絮状支原体及猪滑液支原体等)存在广泛的交叉反应,这些都给MPS的防治研究带来很大困难。Mhp病原的特异性检测方法对于MPS的诊断有很重要的意义。
Futo[10]等用与 Mhp 16SrRNA 互补的寡聚脱氧核苷酸作探针,用32P标记后检测支气管肺泡洗出液和病肺组织。放射性探针敏感性好、特异性强、分辨率高,但其半衰期短,价格昂贵,并且易对人体造成危害,所以已逐渐被非放射性标记物所取代。地高辛是从毛地黄植物分离出来的类固醇物质,具有分子量小和渗透性好的特点。利用地高辛标记的杂交方法具有敏感性高、特异性强、安全等优点,因此该标记方法深受研究者的青睐[11,12]。本试验根据Mhp P36基因设计、合成了一条25bp的DNA寡核苷酸探针,并采用地高辛来标记。试验 过 程 采 用 的 SABC(Strept Actividin-Biotin Complex)法,由于链霉亲和素的等电点接近中性(pH6.0~6.5),吸附性特别低,因而具有较低的背景,检测的灵敏度较高。该探针对Mhp具有特异性,与常见的猪病原菌和病毒无交叉反应。试验中分别在尼龙膜和NC膜上进行斑点杂交检测,结果发现Mhp地高辛探针在尼龙膜上的敏感性较NC膜高,因此在检测猪肺样品时,我们选用了尼龙膜。
试验结果显示:人工发病猪的猪肺样品(阳性对照)检出率为100%,健康猪肺样品(阴性对照)中未检出Mhp,38份可疑病料的猪肺样品中检出率为39.5%,即所建立的Mhp斑点杂交检测法特异性好、灵敏度高,可以用于MPS的快速诊断。
[1]Straw B E,D'Allaire S,Mengeling WL,et al.Diseases of swine[M].Ames:Iowa State University Press,1999:511-526.
[2]邵国青,还红华.猪气喘病综合防治技术[C].厦门:第五届全国支原体学术会议论文集,2001:44-49.
[3]Haesebrouck F,Pasmans F,Chiers K,et al.Efficacy of vaccines against bacterial diseases in swine:what can we espect?[J].Vet Microbiol,2004,100(3~4):255-268.
[4]吴移谋,叶元康.支原体学(第2版)[M].北京:人民卫生出版社,2008:203-208.
[5]M Strasser,J Frey,G Bestetti,et al.Cloning and expression of a species-specific early immunogenic 36-kilodalton protein of Mycoplasma hyopneumoniae in Escherichia coli[J].Infect Immun,1991,59(4):1217-1222.
[6]Caron J,Ouardani M ,Dea S.Diagnosis and differentiation of Mycoplasma hyopneumoniae and Mycoplasma hyorhinis infections in pigs by PCR amplification of t he P36and P46genes[J].J Clin Microbiol,2000,38:1390-1396.
[7]刘茂军.猪肺炎支原体P97基因抗原决定簇R1区重组表达质粒的构建、表达及活性鉴定[D].太谷:山西农业大学,2003.
[8]李广明,姜平,李玉峰,等.地高辛标记cDNA探针检测猪繁殖与呼吸综合征病毒[J].畜牧与兽医,2007,39(5):43-45.
[9]Hugh Y Cai,Tony van Dreumel,Beverly McEwen,et al.Application and field validation of a PCR assay for the detection of Mycoplasma hyopneumoniae from swine lung tissue samples[J].J Vet Diagn Invest,2007(19):91-95.
[10]Futo S,Seto Y,Mitsuse K,et al.Detection of Mycoplasma hyopneumoniae by using rRNA oligodeoxy nucleotide hybridization[J].J Clin Microbiol,1992,30(6):1509-1513.
[11]马文丽,郑文岭.核酸分子杂交技术[M].北京:化学工业出版社,2007:47-49.
[12]Ghadam P,Gharavi S,Yarian F,et al.Non-radioactive labeled probe preparation for hbs gene detection[J].Pak J Biol Sci,2009,12(12):914-918.

