独脚当归阿魏酸和多糖含量的测定
任晓云,尹春英,陈建中,陈晓珍,李 娜
中国科学院成都生物研究所,成都 610041
独脚当归是伞形科属植物西藏凹乳芹(Vicatia thibetica de Boiss)的根,也叫野当归,产于四川、云南及西藏,生于海拔2700~4000 m的山坡、草地、林下、河滩及灌丛内[1]。其味辛、甘、微苦,性温。具有祛风除湿、散寒止痛等功效,主要用于风寒湿痹、中寒胃痛、腰部冷痛等症[2]。
四川省阿坝州马尔康一带有以独脚当归充当当归使用[1]。当归是伞形科植物当归Angelica sinensis(Oliv.)Diels的干燥根,主产我国甘肃省岷山山区,具有补血活血、调经止痛、润肠通便等功效[3],其主要成份是阿魏酸、挥发油、多糖以及微量元素等[4],其中阿魏酸和多糖常作为当归药材质量控制的指标成分[5]。阿魏酸具有抗血小板凝集和血栓;清除亚硝酸盐、氧自由基、过氧化亚硝基;抗菌消炎、抗肿瘤、抗突变、增加免疫功能;增强人体精子活力和运动性等功能[6]。多糖是构成生命的四大基本物质之一,多糖在增强免疫力、降血糖、抗肿瘤、抗炎、抗病毒、抗衰老、抗凝血等方面发挥着生物活性作用[7]。
目前为止,对四川阿坝州一带所产独脚当归的阿魏酸以及多糖含量的测定尚未见报道,更无从比较其与当归的有效成份含量。本实验以阿坝州红原县所产的两年生独脚当归为材料,探索其主要成份阿魏酸和多糖含量的测定方法,比较了与当归的药效差异,为进一步建立独脚当归药材的质量标准提供实验依据。
1 材料与方法
1.1 仪器、试剂与材料
仪器:Aglient 1200高效液相色谱仪(美国安捷伦科技公司);UV-2000紫外可见分光光度计(上海奥谱勒仪器有限公司);离心机(美国赛默飞世尔科技公司);电子分析天平(瑞士METTLER公司)等。
试剂:葡萄糖标准品(成都曼思特生物科技有限公司,批号MUST-11020603);阿魏酸标准品(成都曼思特生物科技有限公司,批号 MUST-11112204);浓硫酸(西陇化工有限公司);苯酚(重蒸馏,天津科密欧化学试剂有限公司);甲醇为色谱纯,其它试剂均为分析纯。
材料:四川红原产两年生独脚当归药材。
1.2 方法
1.2.1 独脚当归阿魏酸含量测定
紫外光谱扫描检测确定HPLC检测波长:将独脚当归用70%甲醇回流提取后,经稀释到适当的浓度,在紫外-分光光度计200~400 nm的波长范围内进行扫描,检测其最大吸收波长为239.0 nm和320.0 nm,结合参考文献[8]和紫外扫描结果确定选择320 nm作为检测波长。
采用液相色谱条件:色谱柱为Agilent ZORBAX SB-C18(250 mm × 4.6 mm,5 μm)柱,流动相为0.5%冰醋酸(A)和甲醇(B),梯度洗脱程序为:0~30 min(30%B ~50%B),30~32 min(50%B ~95%B),32~40 min(95%B~30%B);测定波长:320 nm;柱温:35 ℃;流速:0.8 mL/min;进样量:10 μL。
标准曲线绘制:精密称取阿魏酸10.20 mg于100 mL容量瓶中,用70%甲醇溶解并定容至100 mL,得到 0.102 mg/mL储备液。分别精密吸取0.1、0.2、0.4、0.8、1.0 mL 分别置于 10 mL 容量瓶中,用70%甲醇溶解并定容至10 mL,进样前用0.45 μm 滤膜过滤,10 μL 进样,测定阿魏酸峰面积,用峰面积积分值与对照品质量浓度进行线性拟合,得到阿魏酸线性回归方程。标准品的HPLC谱图见图1,保留时间为15.928 min。
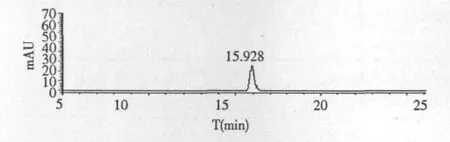
图1 阿魏酸标准品HPLC谱图Fig.1 HPLC chromatogram of the ferulic acidstandard
样品供试液制备:取独脚当归粉末(过60目筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇20 mL,密塞,称定重量,加热回流30 min,放冷,再称定重量。用70%甲醇补足减失的重量,摇匀,0.45 μm 滤膜滤过,供阿魏酸测定。
方法学考察:对阿魏酸标准品的精密度以及供试液中阿魏酸的重现性、稳定性、回收率进行考察。
样品测定:精密称取独脚当归粉1.0 g,平行制备供试液5份,在与标准品相同的HPLC条件下,进样10 μL,记录色谱图,测定色谱峰的峰面积,按外表法计算样品中阿魏酸的平均含量。样品的HPLC谱图见图2,保留时间为15.904 min。
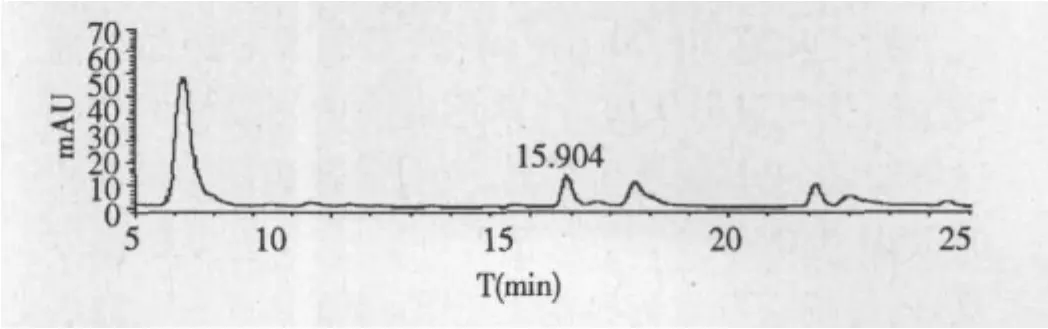
图2 独脚当归70%甲醇提取物的HPLC谱图Fig.2 HPLC chromatogram of 70%methanol extract of V.thibetica
1.2.2 独脚当归多糖含量测定
标准曲线绘制:精密称取葡萄糖对照品5.40 mg,于50 mL容量瓶中,以蒸馏水溶解并定容,配制成质量浓度为108 μg/mL的葡萄糖对照品溶液。精密量取 0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL,分别置于干燥、具塞试管中,加蒸馏水至1.0 mL,再加入5%苯酚溶液2.0 mL,混匀,加浓硫酸 7.0 mL,充分混匀,置沸水浴加热20 min,取出,放置至室温。另取1.0 mL蒸馏水平行操作,作空白对照。于最大吸收波长490 nm处测定其吸光度,用吸光度与葡萄糖对照品的质量浓度进行线性拟合,绘制标准曲线。
样品供试液制备[8]:取独脚当归样品粉末(过40目筛)约2.0 g,精密称定,加80%乙醇100 mL回流1 h,滤过,滤渣加水100 mL回流2 h,趁热抽滤,滤液适当浓缩,用80%乙醇沉淀,静置过夜,离心,弃上清液,沉淀用温水溶解,转移并定容至100 mL容量瓶中,再精密量取上述溶液1.0 mL,转移并定容至10 mL量瓶中,供多糖测定[8]。
方法学考察:对葡萄糖标准品的精密度以及供试液中多糖的重现性、稳定性、回收率进行考察。
样品测定:精密称取独脚当归2.0 g,平行制备供试液5份,显色并测定吸光度,按外标法计算样品中多糖的含量。
2 结果与分析
2.1 阿魏酸和葡萄糖标准品的线性范围
以HPLC记录的峰面积(Y)对阿魏酸的质量浓度(X)进行直线回归,回归方程为 Y=58.2255X-5.0100,相关系数 r=0.9998,表明当阿魏酸在 1.02~10.20 μg/mL与峰面积呈良好的线性关系;以吸光度(Y)对葡糖糖的质量浓度(X)进行直线回归,回归方程为 Y=0.0075X-0.0548,相关系数为 r=0.9998,表明当葡萄糖在 21.6 ~86.4 μg/mL 与吸光度呈良好的线性关系。
2.2 阿魏酸和葡萄糖标准品的精密度考察
精密吸取10.20 μg/mL的阿魏酸对照品溶液10 μL,重复进样5次,计算色谱图中阿魏酸的相对保留时间的RSD为0.43%,并计算阿魏酸的峰面积的RSD为0.40%,均小于2.0%,表明进样精密度良好;另精密量取葡萄糖对照品溶液0.5 mL,加水至1.0 mL,显色后分别测定吸光度,重复测定5次,计算RSD为0.21%。
2.3 供试液中阿魏酸和多糖的重现性考察
精密称取独脚当归1.0 g,平行制备供试液5份,进样10 μL,记录各色谱图,测定其峰面积,供试液中阿魏酸的重现RSD为1.62%;另精密称取独脚当归2.0 g,平行制备供试液5份,精密量取供试品溶液1.0 mL,依法测定吸光度,并计算样品多糖含量的重现RSD为1.33%。
2.4 供试液中阿魏酸和多糖的稳定性考察
精密称取独脚当归1.0 g制备供试液,分别于0、2、4、6、8、10、12 h 进样 10μL。记录各色谱图,测定其峰面积,对照品在不同时间点峰面积的RSD为0.92%,结果表明供试品溶液中阿魏酸在12 h内稳定;另精密称取独脚当归2.0 g,制备供试液,精密量取供试品溶液 1.0 mL,于显色后 0、10、20、30、40、60 min,测定吸光度,多糖RSD为0.16%,结果表明供试液在显色后1 h内稳定。
2.5 供试液中阿魏酸和多糖的回收率考察
精密称取独脚当归样品0.5 g共5份,分别加入0.102 mg/mL阿魏酸对照品溶液0.4 mL,待溶剂挥干后,按样品测定方法提取并测定。取5次测定的平均值计算回收率99.56%(n=5),阿魏酸回收率的RSD为1.57%,回收率实验结果见表1;另精密称取独脚当归样品1.0 g,平行制备供试液5份,在提取液中加入一定量的葡萄糖对照液,测定吸光度,取5次测定的平均值计算回收率为100.39%(n=5),供试液中多糖回收率的RSD为1.24%,回收率实验结果见表2。
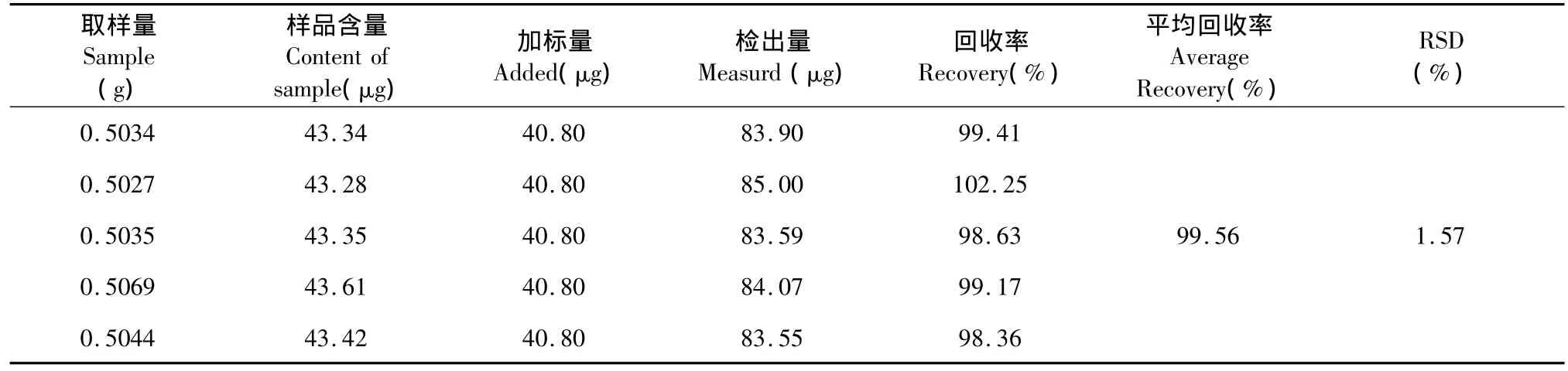
表1 标准品阿魏酸的回收率Table 1 Recovery rate of ferulic acid
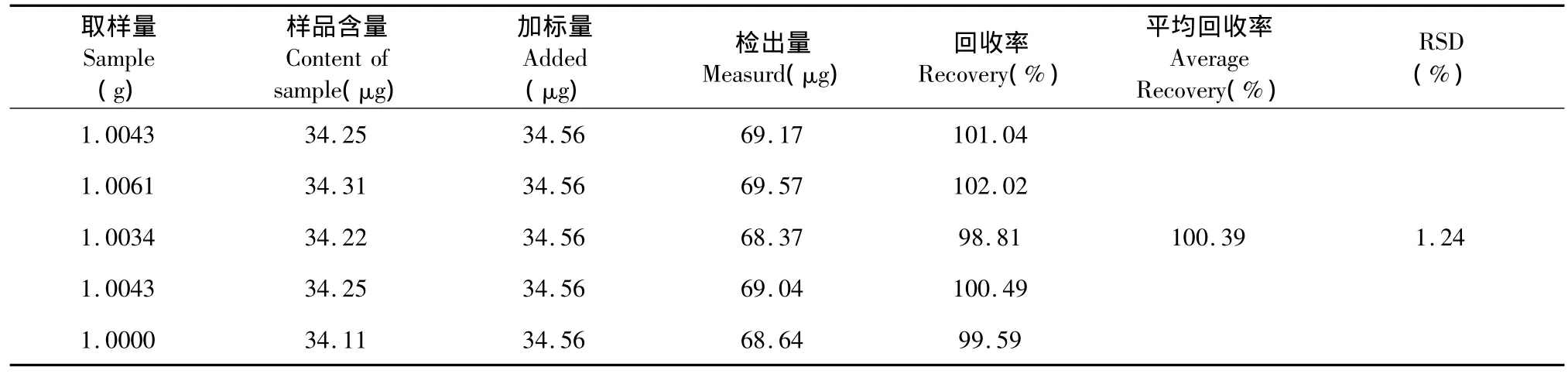
表2 标准品葡萄糖的回收率Table 2 Recovery rate of glucose
2.6 独脚当归中阿魏酸和多糖的含量分析
按照药典中阿魏酸的提取方法,用70%甲醇回流提取独脚当归中的阿魏酸,利用高效液相色谱法测定了独脚当归中阿魏酸的含量为86.10 μg/g。采用水提醇沉的方法提取独脚当归中所含多糖,并通过苯酚-硫酸法测定了多糖的含量为34.60mg/g。
3 讨论
本实验采用高效液相色谱法测定了独脚当归中阿魏酸的含量,实验结果表明,该方法具有操作简便、灵敏、准确等特点,可以用于独角当归药材中阿魏酸的含量检测和质量标准的控制。但是与已报道的当归阿魏酸含量相比[8],独脚当归阿魏酸含量偏低。阿魏酸作为当归药材质量控制的指标成分之一,如果将独脚当归充当当归使用,其药效会明显弱于当归。
本实验利用多糖不溶于乙醇的性质,于80%乙醇中回流提取独脚当归,以除去脂溶性杂质,然后利用多糖溶于热水的性质,在热水中回流提取多糖,并通过改变水提液极性用乙醇沉淀出多糖,最终得到粗多糖。利用具有显色稳定,准确可靠,重现性好,回收率高等优点的苯酚-硫酸法[9],测定了独角当归中多糖的含量。实验结果表明,该方法准确度较高,可以用于独脚当归药材多糖含量检测和质量标准的控制。该实验同时说明了独脚当归中含有较丰富的多糖,为独脚当归进一步开发及其多糖生物学活性研究奠定了基础。
1 Editorial Committee for Flora of the Chinese Academy of Sci-ences(中国科学院中国植物志编辑委员会).Flora of China(中国植物 志).Beijing:China Science Press,1979.Vol55,185.
2 State administration of traditional Chinese medicine of the People's Republic of China(国家中医药管理局).Zhonghua Bencao(中华本草).Shanghai:Shanghai Science and Technology Press,1999,15:1037-1038.
3 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2005,1:89.
4 Chen F(陈飞),Yao C(姚成).Advances in study on the components inAngelica sinensis.Res Tradit Chin Med(中医药研究),2002,18:51-54.
5 Zhao KJ(赵奎君),Zhong M(钟萌),Xie JD(谢俊大).Contents comparison of ferulic acid,ligustilide and total polysaccharide in radix Angelicae sinensis from different regions.Chin J Inform Tradit Chin Med(中国中医药信息杂志),2007,14(12):37-38.
6 Hu YY(胡益勇),Xu XY(徐晓玉).Research on chemical constituents of ferulic acid and its pharmacological effects.Chin Tradi Pat Med(中成药),2006,28:253-255.
7 Jiang MH(姜曼花),Qiu XM(邱细敏),Liu SZ(刘胜姿),et al.The extraction,purification and determination of polysaccharide inGynuradivaricata(L.)DC.Shizhen Med Mat Med Res(时珍国医国药),2008,19:7412-7414.
8 Yan H(严辉),Duan JA(段金廒),Qian DW(钱大玮),et al.Evaluation and analysis of the quality of Angelica sinensis from different source in China.Chin Tradit Herb Drugs(中草药),2009,40:1988-1992.
9 Zhong FX(钟方晓).Ren HH(任海华),Li Y(李岩).Comparison of methods in determination of polysaccharide content.Shizhen Med Mat Med Res(时珍国医国药),2007,18:1916-1917.

