复合菌系对玉米秸秆的降解特性
郭夏丽,杨小丽,王 岩
(郑州大学化工与能源学院,河南郑州450001)
0 引言
在秸秆的资源化和能源化利用中生物法被广泛应用[1-3],而在玉米秸秆的微生物降解中,大多采用的是单菌株法[4-5].由于玉米秸秆含有纤维素、半纤维素及木质素等多种组分,因此玉米秸秆的完全降解,需要多种微生物共同参与[6].目前有一些研究者开始利用复合菌进行秸秆降解,但只注重菌种种类,缺乏考虑菌种间的协同性和分泌酶系的全面性[7].
笔者将诱变得到的高效纤维素降解菌Y11-4与筛选得到的纤维素降解菌X2、木质素降解菌L3及酵母菌J6进行组配,然后将由单菌株组合的菌系与驯化得到的降解菌系再次组合,形成秸秆降解的复合菌剂.通过考察玉米秸秆降解体系的pH值变化、微生物组成、酶组成、秸秆降解率等,以检验秸秆降解复合菌剂的稳定性、酶系组成的全面性及其对秸秆的降解效果.
1 材料与方法
1.1 秸秆处理
将风干的玉米秸秆剪成长约1 cm的小块,于105℃烘1 h,冷却后称取4 g添加到150 mL三角瓶中,再加入12 mL营养液,混合均匀,于121℃灭菌40 min作秸秆降解率测定培养基.
无机盐溶液:MgSO4.7H2O 5 g,CaCl20.1 g,KH2PO41 g,NaCl 0.1 g,FeSO4.7H2O 0.05 g,Zn-SO4.7H2O 0.014 g,MnSO4.7H2O 0.016 g,CoCl20.01 g,水1 000 mL,pH值自然.
营养液:(NH4)2SO46 g,尿素 3 g,蛋白胨3 g,无机盐溶液1 000 mL,pH值自然.
1.2 菌剂降解性能测定
将复合菌剂接种于秸秆培养基,于30℃静止培养14 d,每天定时振荡一次,在一定时间间隔内分别测定pH值、酶活性、微生物数量及秸秆降解率[8-9].
酶活测定.外切型葡聚糖酶(C1)活测定:取两支25 mL试管,各加0.2 mL酶液,再加pH为4.8的醋酸缓冲液1.8 mL,测定管加入50 mg脱脂棉,充分浸泡,与不加脱脂棉的空白管同时置50℃恒温水浴60 min.然后分别加入DNS显色液2 mL,空白管同时加50 mg脱脂棉,沸水浴10 min,冷却后加水至15 mL,混匀,在550 nm处比色.羧甲基纤维素酶(Cx)活测定:取两支25 mL试管,各加0.2 mL酶液,测定管加1.8 mL羧甲基纤维素钠CMC(1 g/100 mL),空白管加pH为4.8醋酸缓冲液1.8 mL,置50℃恒温水浴60 min,取出,加入2 mL DNS溶液,沸水浴中保持10 min,冷却后加水至15 mL,混匀,在550 nm处比色.β-葡萄糖苷酶(Cb)酶活测定:把CMC酶活测定中的 CMC(1 g/100 mL)换成水杨素(1 g/100 mL).
纤维素酶活定义:1 mL酶液于50℃,pH4.8条件下,每分钟水解底物产生1 μg还原糖(以葡萄糖计)的酶量即为1个酶活单位。
2 结果与讨论
2.1 秸秆降解体系pH的变化
秸秆降解菌系的pH调控能力是其稳定性的重要表现之一,通过对秸秆降解过程中pH变化的检测,来探明复合菌系的稳定性.不同培养时间pH的变化如图1所示.
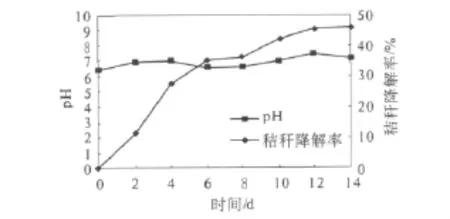
图1 不同培养时间pH的变化Fig.1 The pH changes at different culture time
由图1可知,在秸秆降解的14 d内,体系的pH值始终处于6.5~7.5之间.在整个降解过程中体系的pH值始终变化不大,处于中性范围内,而且秸秆降解率逐渐增加,表明稳定的pH提供了微生物生长及代谢活动旺盛进行所需要的适宜环境,从而使微生物能高效降解秸秆.pH的稳定说明该复合菌系具有一定的pH调节能力.
2.2 秸秆降解过程中纤维素降解酶活性的变化
纤维素的降解是秸秆降解的关键.纤维素的降解是内切 β-1,4-葡聚糖酶(Cx酶),外切 β-1,4-葡聚糖酶(C1酶)和β-葡萄糖苷酶(Cb酶)协同作用的结果[10],本研究通过考察秸秆降解过程中各种纤维素降解酶的活性变化,以探明复合菌剂产生的纤维素降解酶的种类及其在玉米秸秆降解中的作用.
秸秆降解过程中纤维素酶活力的变化如图2所示.由图2可以看出,复合菌剂能够分泌纤维素降解所需的3种酶类,在秸秆降解的整个过程中,各纤维素酶活性变化呈现了一个由低到高、再回落的趋势.纤维素降解酶为纤维素底物诱导产生的诱导酶.在培养前期,复合菌系中各种纤维素降解菌开始被诱导产生纤维素降解酶,因而酶活逐渐增大,随着底物秸秆的不断降解,纤维素浓度逐渐降低,导致纤维素降解酶活有所降低.C1酶和Cx酶的水解产物纤维二糖对C1酶和Cx酶具有很强的反馈抑制作用[11],而Cb酶可水解纤维二糖,从而解除该抑制作用.由图2可知,Cb酶在C1酶和Cx酶之前进入高活性阶段,对C1酶和Cx酶的活性增加起到了促进作用.Cx酶的作用可以形成C1酶所需要的游离末端,Cx酶在C1酶之前进入高活性阶段,对C1酶的活性具有一定促进作用.C1酶、Cx酶和Cb酶表现了良好的协同性.C1酶、Cx酶和Cb酶是由混合菌系产生分泌的,可以来自不同的菌源,这3种酶间的协同性在一定程度上反映了复合菌系在秸秆降解功能上的稳定性.
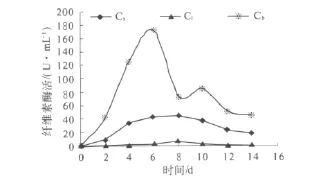
图2 秸秆降解过程中纤维素酶活力的变化Fig.2 The cellulase activity at different culture time
2.3 秸秆降解率及微生物种群的变化
复合菌系中不同微生物种群之间的协同作用是复合菌系稳定的关键.通过分析秸秆降解过程中不同微生物种群的数量变化,以探明复合菌系稳定的根本机制.秸秆降解率及微生物种群变化如图3所示.
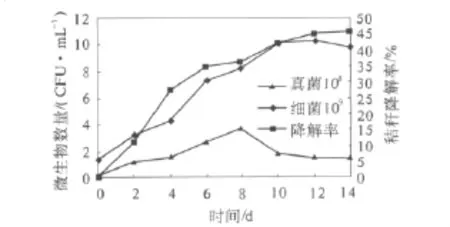
图3 秸秆降解过程中微生物组成的变化Fig.3 The changes of microbial populations during corn stalk decomposing
由图3可知,秸秆降解率在前6 d增加较快,随后变得缓慢.细菌数量随着秸秆的降解一直增加,到第10 d趋于稳定.真菌数量在前8 d逐渐增加,随后有一定的下降,并在第10 d保持稳定.本研究的前期工作即纤维素分解菌的筛选表明真菌分泌的胞外纤维素酶活比细菌的活性高[12],而且真菌具有发达的菌丝,菌丝能很快覆盖秸秆表面,有利于秸秆降解,加之,真菌数量与C1酶和Cx酶活均在第8 d达到最高,说明C1酶和Cx酶大多来自真菌,表明真菌直接参与了秸秆降解过程.细菌虽然纤维素酶活不高,但能利用纤维素水解产物葡萄糖和纤维二糖,凭借其快速生长繁殖优势,消耗大量的葡萄糖和纤维二糖,在一定程度上缓解纤维素分解产物对真菌纤维素分解酶的反馈抑制,间接促进秸秆降解.再者,细菌适宜pH为中性,而秸秆降解体系的pH值始终处于6.5~7.5之间,推测细菌在pH的调控上起主导作用.
3 结论
(1)在秸秆的整个降解过程中,pH值一直处于中性范围,表明秸秆降解菌剂对pH具有较强的调节能力,在性质上具有稳定性.
(2)复合菌剂能够产生纤维素降解所需的三种酶类,即C1酶、Cx酶和Cb酶.在秸秆降解过程中,Cb酶对C1酶和Cx酶的活性有促进作用,Cx酶对C1酶的活性有促进作用.C1酶、Cx酶和Cb酶之间具有一定协同性.
(3)复合菌剂主要由细菌和真菌组成.在秸秆降解过程中,真菌通过产生纤维素酶降解秸秆,同时为细菌提供了大量营养物质;而细菌通过利用纤维素降解产物——葡萄糖和纤维二糖进行生长繁殖,解除真菌的产物反馈抑制作用,间接促进了秸秆的降解.细菌群落与真菌群落的协同作用是复合菌系稳定性的基础.
[1]孙健,陈砺,王红林.纤维素原料生产燃料酒精的技术现状[J].可再生解源,2003,112(6):5-9.
[2]曹国良,张小曳,郑方成,等.中国大陆秸杆露天焚烧的量的估算[J].资源科学,2006,28(1):9-12.
[3]MALHERBE S,CLOETE T E.Lignocellulose biodegradation:Fundaments and applications[J].Reviews in Environmental Science and Biotechnology,2002(1):105-114.
[4]刘清锋,支晓鹏,徐惠娟,等.纤维素降解菌青霉T24-2的分离及产酶特性[J].工业微生物,2007,37(3):15-19.
[5]曲小爽,顿宝庆,郭明鸣,等.一株嗜热纤维素分解菌的分离及其酶学性质的初探[J].中国农业科技导报,2009(1):124-128.
[6]SANCHEZ C.Lignocellulosic residues:Biodegradation and bioconversion by fungi[J].Biotechnology Advances,2009(27):185-194.
[7]GUO Peng,WANG Xiaofen,ZHU Wanbin,et al.Degradation of corn stalk by the composite microbial system of MC1[J].Journal of Environmental Sciences,2008,20(1):109-114.
[8]姚占芳,吴云汉.微生物学实验技术[M].北京:气象出版社,1998:50-54.
[9]刘德海,杨玉华,安明理,等.纤维素酶酶活的测定方法[J].中国饲料,2002(17):27-28.
[10]刘树立,王华,王春艳,等.纤维素酶分子结构及作用机理的研究进展[J].食品科技,2007(7):12-15.
[11]赵越,武彬,阎伯旭,等.纤维二糖抑制外切纤维素酶水解作用机理的分析[J].中国科学(C),2003,23(5):454-460.
[12]郭夏丽,杨小丽,李顺义,等.秸秆降解菌的筛选及菌种组合[J].郑州大学学报:工学版,2010,31(1):74-77.

