p53RFP表达载体的构建及其对HEK293A细胞增殖的抑制作用
裴静娴,王月刚,张艺军,赖文岩,吴平生
(1.南方医科大学南方医院心内科,广州 510515;2.广州军区广州总医院干部病房二科,广州 510010)
p53RFP是新发现的一个受p53转录调控的基因,其产物具有E3泛素连接酶活性,通过泛素化降解凋亡重要启动信号p21WAF1,参与细胞增殖和凋亡,从而参与细胞周期的调控[1~3]。本研究拟构建p53RFP的表达载体,通过观察其对细胞生长的影响,初步了解其生物学功能。
1 材料与方法
1.1 材料
HEK293A细胞(美国Invitrogen公司),SW620细胞(本研究室冻存);DMEM培养基、胰蛋白酶(美国Gibco公司);胎牛血清(德国PAA公司);pcDNA4/Myc-HisA、LipofectamineTM2000质粒中提试剂盒(美国Invitrogen公司),KOD-Plus-Neo(日本Toyobo公司);限制性内切酶HindⅢ、EcoRⅠ(加拿大Fermentas公司);T4 连接酶、DNA marker、RNAiso Plus、逆转录试剂盒(日本Takara公司);胶回收试剂盒、DNA纯化试剂盒、质粒小提试剂盒(美国Biomiga公司);荧光定量PCR试剂盒(美国Roche公司);大肠杆菌DH5α为本室冻存菌种;BCA蛋白质定量测定试剂盒(上海申能博彩公司);鼠抗人β-actin单克隆抗体(美国Santa Cruz公司),鼠抗人p53RFP单克隆抗体(台湾Abnova公司),山羊抗小鼠辣根过氧化物酶标记二抗(HRP-labeled goat anti-mouse IgG,北京中杉金桥公司);PVDF膜(美国Millipore公司);ECL发光试剂盒(美国Pierce公司),CCK-8试剂盒(日本Dojindo公司)。
1.2 方法
1.2.1 p53RFP表达载体的构建及鉴定:37℃、5%CO2、饱和湿度条件下培养SW620细胞48 h,用RNAiso Plus试剂提取细胞总RNA。逆转录合成cDNA。根据p53RFP基因CDS区序列设计引物,引入限制性内切酶HindⅢ和EcoRⅠ的识别位点,上游引物:5′CATCTGGACCCCTACCGAACA3′,下游引物:5′ACACGAGCAGAATTTCAGGTG3′。PCR 扩增p53RFP编码序列,反应体系为50 μL:10×PCR缓冲液 5 μL,dNTP 5 μL,Mg2+3 μL,上下游引物(10 μmol)各 1.5 μL,cDNA 模板 2 μL,KOD-Plus-Neo 1 μL。PCR 反应条件:94 ℃ 2 min;94 ℃ 10 s,55 ℃30 s,68℃1 min 20 s,共32个循环;68℃延伸 3 min。取PCR纯化产物和pcDNA4/Myc-HisA质粒分别行HindⅢ和EcoRⅠ双酶切,回收大片段,加T4连接酶16℃水浴过夜。连接产物转化感受态DH5a,将转化产物均匀涂布于含有100 mg/L氨苄青霉素的LB选择平板上倒置培养过夜。筛选2~3个菌落,摇菌后取1 μL进行PCR扩增鉴定;小量提取质粒DNA,进行HindⅢ和EcoRⅠ双酶切鉴定,将双酶切鉴定正确的质粒送英骏公司测序。
1.2.2 p53RFP表达载体转染HEK293A细胞:以含5%胎牛血清的DMEM培养基培养HEK 293A细胞,转染前1 d细胞传代。将5×105细胞接种于6 cm培养皿,使转染时细胞汇合率在80%以上。以Opti-MEM 250 μL分别稀释 pcDNA4-p53RFP质粒约 5 μg和 10 μL LipofectamineTM2000。转染 4 h 后更换新鲜培养基。
1.2.3 RT-qPCR检测转染后p53RFPmRNA表达水平:pcDNA4-p53RFP转染HEK293A细胞24 h,提取细胞总RNA,逆转录合成cDNA,以cDNA为模板行PCR,反应条件:95 °C 10 min;95 °C 10 s,60 °C,30 s,40个循环。引物序列如下:p53RFP:上游引物5′CATCTGGACCCCTACCGAACA3′,下游引物 5′ACA CGAGCAGAATTTCAGGTG3′;β-actin:上游引物 5′CAAATGCTTCTAGGCGGACTATG3′,下游引物 5′TGCGCAAGTTAGGTTTTGTCA3′。
1.2.4 Western blot检测转染后p53RFP蛋白表达水平:pcDNA4-p53RFP转染HEK293A细胞48 h,提取细胞总蛋白。将蛋白加入6×loading buffer,100°C煮沸5 min。取30 μg总蛋白上样,行12%SDS-PAGE电泳,200 mA 70 min转印至PVDF膜,依次5%脱脂牛奶封闭,一抗(p53RFP 1︰600稀释,β-actin 1︰1 000稀释)孵育过夜,TBST漂洗(10 min×3次),二抗(1︰10 000稀释)室温孵育1 h,TBST漂洗(10 min×3次),ECL发光。
1.2.5 细胞增殖活力检测(cell couning kit-8,CCK-8)p53RFP过表达对HEK293A细胞增殖的影响:接种 HEK293A 细胞于 6孔板(3×105~4×105/孔),24 h后转染pcDNA4-p53RFP,空载体转染组做阴性对照,空白组不做任何处理。转染4 h后更换为新鲜培养基。12 h后消化为单细胞悬液,以每孔2 000个细胞接种于96孔板,每组6个复孔。于转染后24 h、48 h、72 h 及 96 h,向培养孔加入 10 μL CCK-8 溶液,在培养箱中孵育3 h,用酶标仪检测450 nm的吸光度值。
1.3 统计学分析
应用SPSS 13.0统计软件,采用One-way ANOVA检验比较不同处理组p53RFPmRNA表达水平,及不同处理组对HEK293A细胞增殖水平是否具有统计学差异。当方差分析差异有统计学意义,且方差齐性时,采用LSD法行多重比较,方差不齐时采用Games-Howell检验。P<0.05为差异有统计学意义。
2 结果
2.1 p53RFP基因克隆
所要扩增的p53RFP基因的长度为912 bp,RTPCR的扩增产物经琼脂糖凝胶电泳显示,条带大小与理论值一致,表明成功扩增出p53RFP基因。见图1。
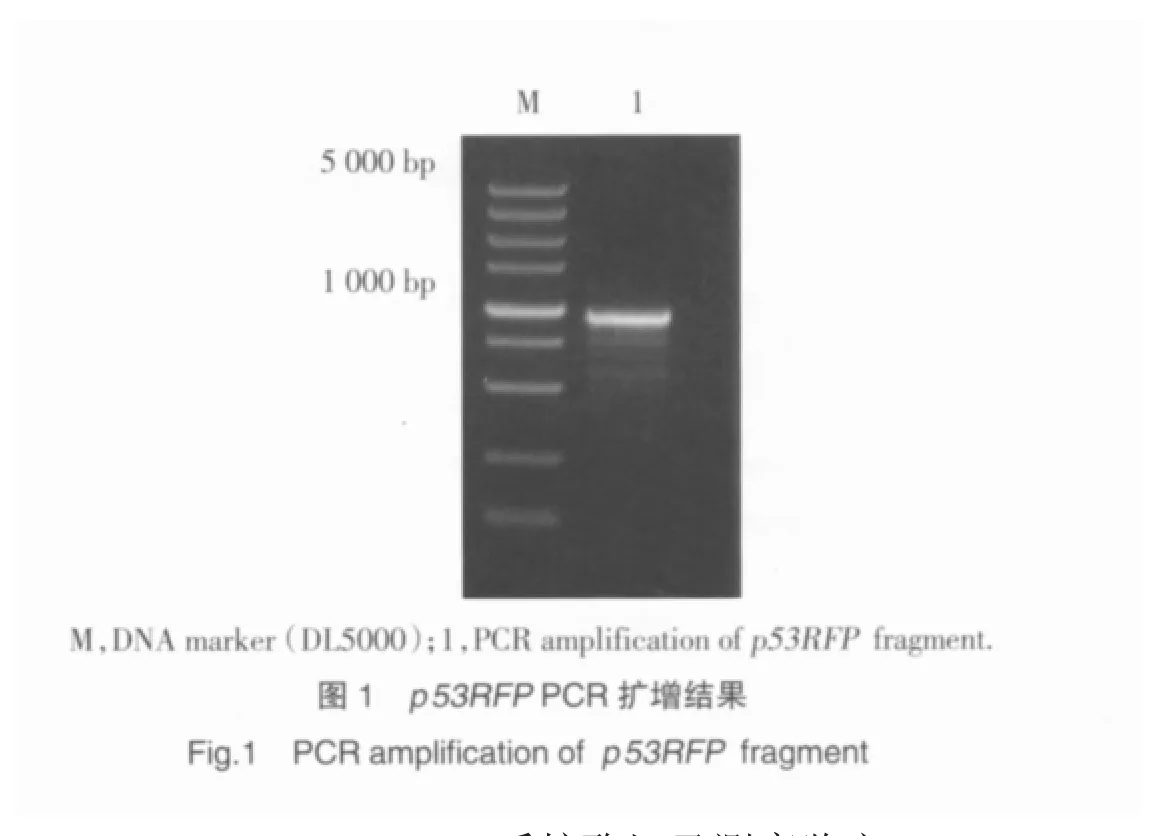
2.2 pcDNA4-p53RFP质粒酶切及测序鉴定
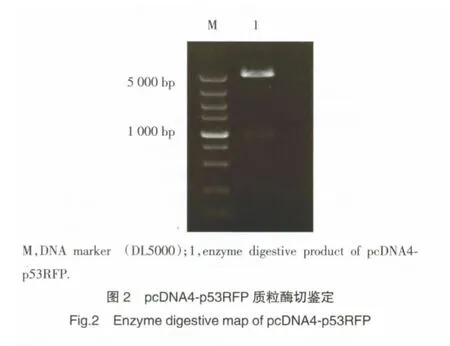
pcDNA4-p53RFP质粒经HindⅢ和EcoRⅠ双酶切后,取5 μL酶切产物行琼脂糖凝胶电泳,结果如图2所示:可见载体片段(5.1 kb)和目的片段(912 bp),表明载体连接成功。
2.3 RT-qPCR检测p53RFPmRNA表达
RT-qPCR检测结果显示:pcDNA4-p53RFP转染组p53RFPmRNA相对表达量(34739.440±1382.572)显著高于空白组(0.980±0.020)及空载体转染组(0.837±0.101)(P 均<0.01),表明 pcDNA4-p53RFP转染HEK293A后可在细胞内高表达。
2.4 Western blot检测p53RFP蛋白表达
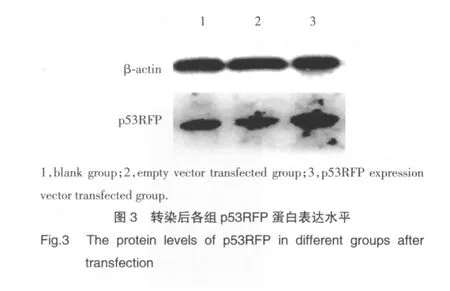
Western blot结果如图3所示:pcDNA4-p53RFP转染组p53RFP蛋白表达水平上调,提示pcDNA4-p53RFP转染HEK293A细胞可大量表达p53RFP蛋白。
2.5 转染后各组细胞增殖水平
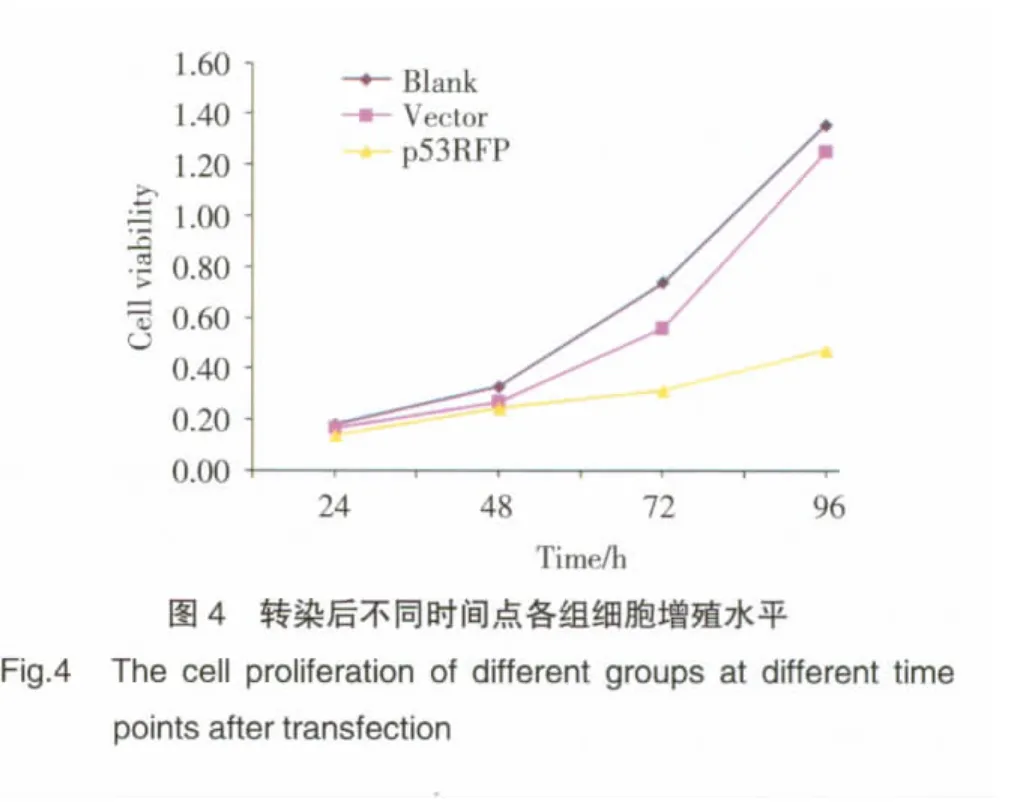
CCK-8检测结果如图4所示:与阴性对照组相比,pcDNA4-p53RFP转染组转染后72 h、96 h细胞增殖受到明显抑制(P均<0.01)。
3 讨论
p53RFP是新近发现的调控细胞增殖和细胞周期的重要基因[1],目前对该基因的研究较少。对其生物学活性的认识主要停留在它作为p53下游靶基因参与的细胞凋亡过程方面。为研究p53RFP的生物学功能,本研究成功构建了p53RFP的表达载体,并将其转染至HEK293A细胞。结果发现:转染后,p53RFP可在HEK293A细胞高效表达,并可抑制HEK293A细胞的增殖。据文献报道,p53RFP作为p53诱导的泛素连接酶,可能通过泛素化降解凋亡的重要启动信号p21WAF1参与细胞周期的调节[1]。而p53RFP是否可以直接调控细胞周期蛋白,从而影响细胞增殖,尚有待于进一步研究。
泛素—蛋白酶系统在生理及病理生理条件下可发挥多种重要作用。真核细胞内约80%的蛋白都是通过泛素—蛋白酶系统降解。E3泛素连接酶是泛素—蛋白酶系统特异性的重要成分,决定泛素介导的蛋白酶体降解途径底物的特异性[4]。大多数E3泛素连接酶属于RING结构域家族,其最典型的特点是具有环指结构域,该结构是此家族具有泛素连接酶作用的重要因素。具有环指结构域的E3泛素连接酶参与调节很多重要的细胞功能,如细胞周期、DNA修复、细胞信号转导及对低氧的反应[5~9]。p53RFP包含氮端的RING-IBR-RING结构域和碳端保守结构域,研究发现氮端的RING-IBR-RING结构域决定其产物具有E3泛素连接酶活性,碳端的保守结构域也可能具有重要的功能[3]。目前,对于p53RFP基因的功能研究较少,p53RFP的功能及其作用机制尚待进一步阐明。因此,本研究构建的p53RFP表达载体为进一步研究p53RFP的生物学功能奠定了基础。
[1]Ng CC,Arakawa H,Fukuda S,et al.p53RFP,a p53-inducible RING-finger protein,regulates the stability of p21WAF1 [J].Oncogene,2003,22(28):4449-4458.
[2]Nakamura Y.Isolation of p53-target genes and their functional analysis[J].Cancer Sci,2004,95(1):7-11.
[3]Huang J,Xu LG,Liu T,et al.The p53-inducible E3 ubiquitin ligase p53RFP induces p53-dependent apoptosis [J].FEBS Lett,2006,580(3):940-947.
[4]Lipkowitz S,Weissman AM.RINGs of good and evil:RING finger ubiquitin ligases at the crossroads of tumour suppression and oncogenesis[J].Nat Rev Cancer,2011,11(9):629-643.
[5]Nakayama KI,Nakayama K.Ubiquitin ligases:cell-cycle control and cancer[J].Nature Rev Cancer,2006,6(5):369-381.
[6]McCarthy NJ,Whyte MK,Gilbert CS,et al.Inhibition of Ced-3/ICE-related proteases does not prevent cell death induced by oncogenes,DNA damage,or the Bcl-2 homologue Bak[J].J Cell Biol,1997,136(1):215-227.
[7]Muro I,Hay BA,Clem RJ.The Drosophila DIAP1 protein is required to prevent accumulation of a continuously generated,processed form of the apical caspase DRONC [J].J Biol Chem,2002,277(51):49644-49650.
[8]Staudt LM.Oncogenic activation of NF-κB [J].Cold Spring Harb Perspect Biol,2010,2(6):a000109.
[9]Ohh M,Park CW,Ivan M,et al.Ubiquitination of hypoxia-inducible factor requires direct binding to the β-domain of the von Hippel-Lindau protein[J].Nat Cell Biol,2000,2(7):423-427.

