“化学反应中的热量”教学设计*
甘玉琴 严建波
(江苏省苏州中学 江苏 苏州 215000)
一、设计思路
能源是国民经济发展和人民生活所必需的重要物质基础,而化学反应中所释放的能量是当今世界上最重要的能源,因此在新课程中特别突出了化学反应与能量转化这部分内容。新课程标准强调:“从学生已有的经验和将要经历的社会生活实际出发,帮助学生认识化学与人类生活的密切关系”[1]。本课通过生活实例引入,激发学习热情,然后通过三个定性实验让学生亲身感受化学反应中的热量,在此过程中,产生认知冲突,接着教师利用传感器实验解惑,体现了定量实验的重要性。其后,通过一些具体反应实例归纳了常见的放热和吸热反应,从具体到一般,符合认知规律。接下来,不同于常规思路,并不讨论化学反应中热量变化的原因,而是讨论“在化学方程式中如何体现热量的变化”,即从定量的角度研究化学反应中的热量,自然引出热化学方程式,过渡自然。在此部分教学中,注重学生参与,利用“任务驱动”模式,变被动为主动,通过课本信息的阅读,促进学生阅读能力、知识迁移能力以及分析归纳、语言表达等能力的提高。基于“从生活到化学,化学回归生活”的教育理念,本课以自热饭盒引入,最后又以此结课,首尾呼应,真切的让学生体会到我们的化学是真实有用的化学。
二、教学设计与流程
【课的引入】视频短片——广告:自热饭盒。
【提出问题】已知自热饭盒的底部分别放置有CaO粉末和水,请问自热原理是什么?
【学生分析】CaO 和水反应生成 Ca(OH)2的同时,放出大量的热,加热米饭。
(设计意图:通过观看视频,了解化学反应中热量的应用,激发学习兴趣,同时从生活走进化学亲切自然。)
【总结】研究表明,在化学反应中,反应物转化为生成物的同时,必然伴随有能量的变化,而能量的变化又主要表现为热量的变化。
【学生实验】通过三个小实验来切实感受化学反应中的热量变化。
实验一:向试管中放入一段用砂纸打磨过的镁条,加入约5mL稀盐酸,用手感知试管外壁温度的变化。
实验二:将适量 Ba(OH)2·8H2O(s)和 NH4Cl(s)置于保鲜袋中混合,迅速扎紧袋口,用手感知保鲜袋外部温度的变化(友情提醒:实验过程中不要打开保鲜袋口)。
实验三: 各取 25mL 0.25mol/L盐酸和 0.25mol/L氢氧化钠溶液,在烧杯中进行中和反应,用手感知烧杯外壁温度的变化。
(设计意图:通过真实实验探究,亲身感受化学反应中的热量变化,调动学生学习的积极性)
【汇报结果】实验一:试管外壁发烫,温度升高,说明此反应放出热量。
实验二:保鲜袋外部温度降低,说明此反应吸收热量。
实验三:用手触摸烧杯外壁无法感知温度变化。
【质疑】实验三中烧杯中液体温度是否一定没有发生变化呢?如何准确判断?
【讨论】部分学生知道酸碱中和反应会放出热量,但此处并未感触到温度的升高,产生认知冲突。学生提出可以用温度计进行定量测量。
【教师实验】(指出用温度计是可行的)借助于高科技手段-手持技术来实时监测烧杯中液体温度的变化。
如图1安装实验仪器。点击传感器操作界面中“采集”按钮,传感器开始采集烧杯中温度数据,计算机屏幕适时记录烧杯中温度变化。如图2所示,图中曲线所示为向盐酸中加入氢氧化钠溶液后液体温度的变化。
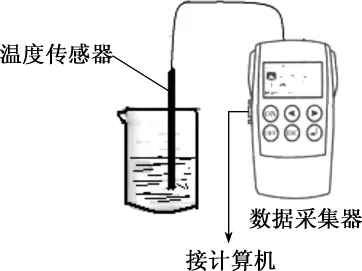
图1 反应装置示意图

图2 反应容器中适时温度变化情况
(设计意图:此处的实验揭示采用了完全不同寻常的传感器实验,将高科技实验手段应用于简单的实验,揭示了科学的真理,学生在此过程中深入感受到了科学探究的严密性,科学思维的广度得到拓展。且传感器实验新奇,大大提高了学习兴趣。)
【学生观察】根据图像,明显看到在倒入氢氧化钠溶液的瞬间,体系的温度突然升高。同时温度只升高1.3度左右,因此我们的触觉无法感知,以上实验说明酸碱中和反应也会放出热量。
(此处观察时,学生首先看到液体温度在升高,但不一定注意到温度升高的数值,教师适时提出图像的观察分析需定性定量相结合,使学生的图像分析能力得到提高。)
【总结】有的化学反应放出热量,有的吸收热量。据此可将化学反应分为放热反应和吸热反应,这是化学反应的又一种分类方法。
【提出问题】根据大家生活经验和已有化学知识,请指出下列反应是放热反应还是吸热反应?
1.CaO与H2O的反应
2.金属与酸反应
4.盐酸和氢氧化钠中和反应
5.高温锻烧石灰石
6.木炭的燃烧
7.炸药的爆炸
8.木炭与水蒸气高温得到水煤气的反应
9.高温下木炭与CO2反应生成CO的反应
10.铝热反应
【汇报结果】1、2、4、6、7、10 为放热反应
3、5、8、9 为吸热反应
【教师归纳】常见的放热反应有:
a.所有燃烧反应
b.酸碱中和反应
c.金属与酸生成气体的反应
d.大多数的化合反应
e.铝热反应
常见的吸热反应包括:
a.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH(g)+10H2O(l)

d.大多数的分解反应
(设计意图:利用生活经验和已有化学知识,学生已能判断一些具体反应的热量变化情况,在此基础上教师进行归纳,符合“从具体到一般,从感性到理性”的认知规律,避免将知识强加给学生,学生易于接受。)
【过渡】化学反应中既然有热量的变化,那么如何在化学方程式中体现出来呢?化学家提出用热化学方程式来表示。那么什么是热化学方程式?热化学方程式的意义又是什么?课本是最好的老师,请大家仔细阅读课本P35[2],并思考投影上的问题。
(设计意图:“授人以鱼,不如授人以渔”,阅读能力是一项重要的学习能力,教师应当在日常教学中适时培养。此处采用“阅读式教学”,让学生带着问题进行阅读,通过“任务驱动”可以提高阅读的质量和效果。)
【问题】什么是热化学方程式?
【学生汇报】热化学方程式是表明反应放出或吸收热量的化学方程式
【问题】方程式(1)(2)分别表示什么意义?
(1)CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.5kJ·mol-1
(2)C(s)+O2(g)=CO2(g) ΔH=-393.6kJ·mol-1
【学生汇报】通过教材的阅读,学生容易得出方程式(1)(2)的意义。
【追问】在方程式的右边出现了ΔH,它的涵义是什么?
【学生归纳】它表明了反应放热或吸热情况,称为反应热,它有正负之分,“-”表示放热,“+”表示吸热,单位一般采用kJ/mol。
【提出问题】以下2个热化学方程式,它们分别表示什么意义?
① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② 2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
(学生根据课本上两个热化学方程式的意义,可顺利得出其它热化学方程式的意义,此处培养了学生的知识迁移能力。)
【追问】两个反应放出的热量不相同。为什么?
【学生讨论】生成物水的状态不同。
【教师引导】那么从气态水转化为液态水,是需要吸收热量还是放出热量?
【学生】放出热量。
【归纳总结】所以在相同条件下,生成气态水放出的热量要少。由此看出,物质的状态不同,反应热也不相同。因此在热化学方程式中应注明物质的状态。
【提出问题】热化学方程式③,它表示的意义呢?
③ H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
【学生汇报】1mol H2与1/2mol O2完全反应,生成1mol液态 H2O,放出 285.8kJ的热量
【追问】其中的化学计量数:1、1/2、1含义是什么?是否表示物质的分子数?
【学生汇报】不表示,表示该物质的物质的量。
【追问】在普通的化学方程式中化学计量数是否可表示物质的分子数?是否可表示物质的物质的量?
【共同讨论】都可以,因此在普通的化学方程式中计量数一般取整数,但在热化学方程式中的计量数只表示物质的物质的量,故可以是整数,必要时也可以取分数。
【对比思考】观察方程式②③,相同的反应,化学计量数不同,ΔH的值不同,化学计量数与ΔH之间有何种关系?
【学生讨论】学生很容易看出②的化学计量数是③的两倍,ΔH的值也是③的两倍,故ΔH的数值与化学计量数成正比。
【问题】在热化学方程式中,ΔH的单位是kJ·mol-1,每mol的涵义什么?代表每摩尔物质吗?
【思考】学生能判断出它并不代表每摩尔物质,但对于具体的涵义几乎无法回答。
【教师评价】肯定学生回答,并对难点进行讲解:它的涵义是每mol反应。
①:每mol反应表示2mol H2与1mol O2完全反应,生成2mol气态H2O(②③反应略),即各物质的物质的量均按照化学计量数进行。对于相同的化学反应,化学计量数不同,每mol反应的意义不同,故反应热也不同。
(设计意图:热化学方程式涵义的理解是一个难点,常规的直接讲解法,学生只能被动接受。以上教学过程反复采用“提出问题-讨论-解决问题”这一教学模式,以三个热化学方程式为基础,提出一系列问题,层层递进,整个过程学生参与度高,思维处于活跃状态,知识的获取由被动变为主动。)
【问题】热化学方程式与普通的化学方程式意义有何不同?普通的化学方程式可以体现什么的变化?
【学生思考】第一个问题比较抽象,同学难以回答。设置的第二个问题较简单,学生可思考得到是物质的变化,它对第一个问题的回答可起到引导作用。
【追问】热化学方程式除了体现物质的变化,还可以体现什么的变化?
【共同讨论】热化学方程式不仅体现了物质的变化,还表明了能量的变化。
【知识运用】小计算:
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1
根据以上热化学方程式,计算1g H2完全燃烧生成液态水,将放出多少热量?
【计算结果】142.9kJ。
【分析讲解】1g燃料便放出如此多的热量,H2属于高能燃料,同时反应得到水,无污染,同时它又是最洁净的燃料。
(设计意图:“学以致用”,利用化学知识解决问题,回归生活,让学生感受到我们学习的化学是“有用”的化学)
【提出问题】热化学方程式与普通的化学方程式意义不同,那么书写又有何区别呢?
【学生讨论】此时学生通过以上一系列问题的解答已对热化学方程式有了清晰的理解,通过分组讨论,相互补充,不难得出以下结论:
书写热化学方程式的注意点:
①热化学方程式中反应物、生成物必须注明聚集状态(不标沉淀符号和气体放出符号)。
固-s 液-l 气-g 溶液-aq
②ΔH只能写在方程式的右边,注意正负号,注意单位。
③热化学方程式中的计量系数表示该物质的物质的量,可以是整数,必要时也可以取分数,并且同一反应,计量数不同,ΔH的数值不同。
【教师补充】此外ΔH的数值与反应的温度和压强有关,因此书写热化学方程式时应注明反应的温度和压强。但中学化学所用的ΔH的数据,一般都是在101kPa和298K时的数据,因此无需特别注明。
④应注明反应的温度和压强,如不注明则指298K、101kPa。
【学生练习】完成下列热化学方程式:
①1g焦炭与适量水蒸气反应生成一氧化碳和氢气,需吸收 10.94kJ的热量
②0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5kJ热量
【练习点评】根据学生书写中出现的问题进行讲解并强调(如ΔH的单位)。
【知识运用】56g氧化钙与适量水生成氢氧化钙固体,放出热量57.86kJ,此反应可应用于自热饭盒。已知50kJ的热量大约可使200g米饭温度升高80度左右,问此过程需要多少克氧化钙与水。
(设计意图:本课以“自热饭盒”引入,最后又回归到此,首尾呼应,体现了从生活到化学再从化学回归生活的思想。并且问题的切入从定性转向定量,科学思维的深度得到拓展,同时也让学生感受到了化学的魅力。)
三、教学反思
本节课的教学内容是基于苏教版化学必修2专题2第二单元的第一课时内容进行设计的。不同于常规思路,笔者在归纳完放热反应及吸热反应后,并未讨论化学反应中的能量观点,而是讨论热化学方程式的涵义,目的是让学生从定性和定量两个方面较全面理解“化学反应中的热量”。在教学活动中,注重知识与生活的联系,学生能够积极主动、真心实意的参与课堂,课堂效率得到了提高。
在学生实验中,对课本上实验2进行了改进,操作更简单,现象更明显。在学生感受完放热反应和吸热反应后,补充实验3(没有明显热效应),引发认知冲突,接着通过新奇的传感器实验解惑,在获取知识的同时,充分体验到科技的魅力。学生热情高涨,学习积极性被充分调动。
本课容量大,其中热化学方程式涵义的理解是一个难点,理论性强。在教学中采用问题引导式、阅读式教学,通过一系列问题引导阅读,层层递进,整个教学活动中学生的参与面宽,每个学生都被不同程度地调动起来,充分发挥了学生在学习活动中的主体作用。在教学活动中,不仅传授知识,更注重培养学生多种学习能力。
[1] 中华人民共国和教育部.普通高中化学课程标准[S].北京:人民教育出版社,2003:2
[2] 王祖浩.普通高中课程标准实验教科书化学 2[M].南京:江苏教育出版社,2011:35

