乙醇通过激活JNK和p38K引起成神经瘤细胞死亡
文 勇 Yongil KWON 于 顺
(1.南首尔大学公共卫生管理部,天安331-707;2.翰林大学江东圣心医院妇产科,首尔150-030;3.首都医科大学宣武医院神经生物学研究室,北京100053)
长期饮酒可以造成多种器官损害,包括肝脏[1]、胰腺[2]和大脑[3-4]。体外研究[5-7]也证明,乙醇可以引起多种细胞凋亡。然而,乙醇引起细胞凋亡的早期信号传导机制却不甚清楚。丝裂原活化的蛋白激酶(mitogen-activated protein kinases,MAPKs)在指导细胞对各种刺激产生反应中发挥重要作用,参与调节多种细胞活动,如增生、分化和凋亡[8]。MAPK信号通路包括3个重要通路[8-9]:①细胞外信号调节激酶,即ERK通路;② c-jun N-末端激酶,JNK通路;③ p38 MAPK(p38K)通路。ERK1和ERK2是增生信号的主要传感器,主要被丝裂原活化。而JNK和p38K则主要被引起细胞应激的各种刺激激活。研究[8-9]表明,JNK和p38K可以介导损害性刺激引起的细胞凋亡。然而,它们在乙醇诱导的细胞凋亡中的潜在作用还未见报道。
本研究将利用培养SK-N-SH成神经瘤细胞研究JNK和p38K通路在乙醇诱导的细胞凋亡中的作用。
1 材料和方法
1.1 实验材料
SK-N-SH细胞(American type culture collection,USA);DMEM培养基(fisher bioblock scientific,France);MTS溶液(Promega,USA);抗JNK和磷酸化JNK以及抗p38K和磷酸化p38K抗体(Santa Cruz,USA);辣根过氧化物酶标记山羊抗兔和山羊抗鼠IgG(Vector Laboratories,USA);ECL 显色 液(Promega,USA);caspase-3荧光底物Ac-DEVD-AMC(BD Pharmingen,USA);胎牛血清(Gibco,USA)。
1.2 细胞培养
SK-N-SH细胞在含10%胎牛血清、1%青霉素和1%链霉素的DMEM培养基中于37℃培养箱中培养。培养箱充以5%CO2和95%空气。
1.3 细胞死亡率测定
向乙醇处理后细胞培养基中加入20 μL MTS(5 g/L)溶液,孵育4 h,于490 nm波长处检测各孔的光吸收值。细胞死亡率=对照细胞吸收值-乙醇处理细胞吸收值/对照细胞吸收值×100%。
1.4 DAPI染色
细胞用4%多聚甲醛室温固定30 min,用PBS洗去固定液,然后加DAPI溶液(0.5 ng/L)染色3~5 min。封片,荧光共聚焦显微镜下观察染色的细胞核。
1.5 DNA片段分析
DNA片段分析采用半定量连接反应介导的DNA平端方法进行[10]。
1.6 Caspase-3活性测定
制备全细胞匀浆,将细胞匀浆(50 ng/L)与caspase-3荧光底物Ac-DEVD-AMC反应。用荧光读板机于360 nm激发光和450 nm发射光处测定荧光值。
1.7 免疫印迹分析
全细胞提取物或胞质组分 (50~100 μg)用PAGE分离并转印到PVDF膜,然后分别与针对不同蛋白的 1抗体(phospho-JNK,JNK,phospho-p38 kinase,and p38 kinase protein)及相应的辣根过氧化物酶标记山羊抗兔或山羊抗鼠IgG(1∶5 000)孵育。辣根过氧化物酶活性用ECL试剂盒检测。
1.8 统计学方法
采用SPSS 12.0软件进行统计分析。所有实验均重复5次。计量数据采用均数±标准差(±s)表示,多组间均数比较用单因素方差分析方法和均数多重比较方法,2组间均数比较用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 乙醇对细胞形态和存活率的影响
如图1A所示,未经乙醇处理的对照SK-N-SH细胞在显微镜下有较高的密度,细胞呈梭型。乙醇(100 mmol/L)处理24 h的细胞在显微镜下密度较低,呈梭型的活细胞数量明显减少,很多细胞收缩呈圆形,体积较小。MTS法测试结果表明,乙醇可以增加死亡细胞的数量,并且随着乙醇剂量的增加,死亡细胞的数量也随之增加,尤其是当乙醇的浓度由50 mmol/L增加到100 mmol/L时,细胞死亡的百分率增加显著(图1B)。

图1 乙醇对细胞形态和存活率的影响Fig.1 Effect of ethanol on cell morphology and viability
2.2 乙醇引起细胞凋亡样改变
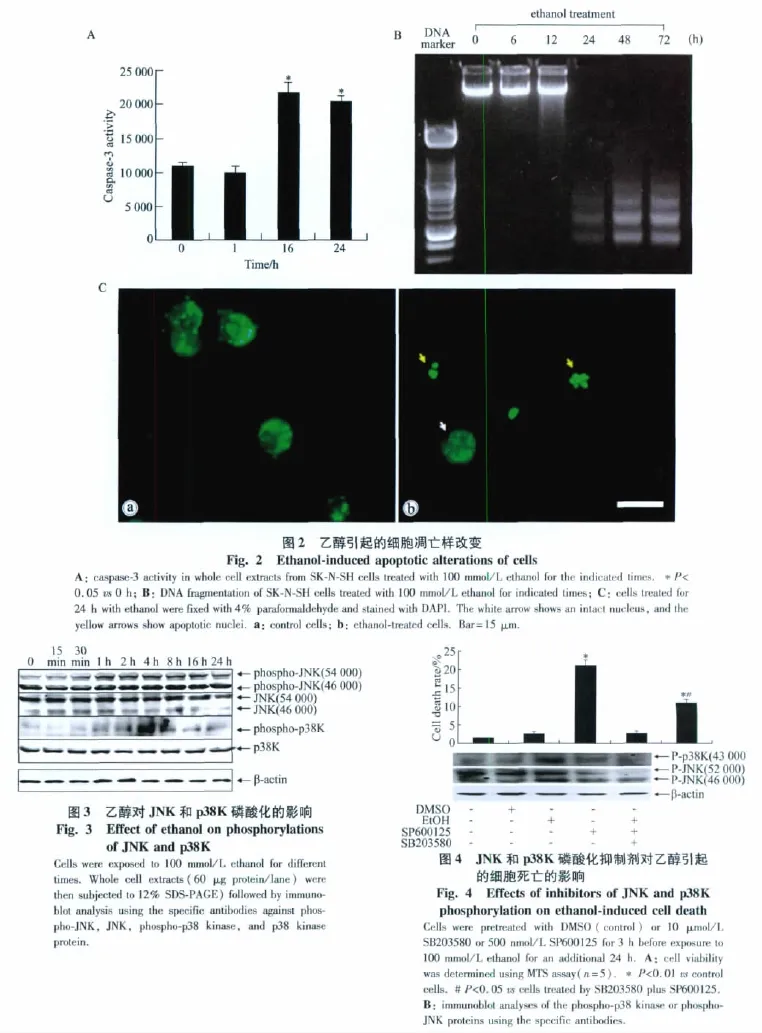
用100 mmol/L乙醇处理细胞后 12 h,引起caspase 3增高,并在所观察的24 h内一直保持高水平(图2A)。DNA片段分析表明,乙醇(100 mmol/L)处理24 h后,细胞核DNA出现断裂的梯度样改变,随着时间进一步延长而愈加明显(图2B)。DAPI细胞核染色显示,乙醇处理24 h的细胞,许多细胞的核呈碎裂现象(图2C)。
2.3 乙醇引起JNK和p38K磷酸化
乙醇可以引起46 000和54 000磷酸化JNK表达增加,这一变化最早发生于乙醇处理后的1 h,并在4~16 h达到较高水平,此后有所回落。乙醇也引起磷酸化p38K表达增加,其最早变化也发生于乙醇处理后的1 h,并在4 h后达到高峰,随后开始回落,详见图3。
2.4 JNK和p38K磷酸化抑制剂减轻乙醇引起的细胞死亡
乙醇引起的磷酸化JNK和p38K增高伴随细胞死亡率的增加,而用磷酸化抑制剂 SP600125和SB203580分别抑制JNK和p38K的磷酸化后,则细胞的死亡率明显降低(图4)。
3 讨论
本研究结果表明,乙醇可以引起SK-N-SH成神经细胞死亡,并表现为凋亡样改变,包括caspase-3激活,细胞核碎裂以及DNA断裂。这些结果提示,乙醇引起的细胞死亡形式主要是细胞凋亡。乙醇介导细胞凋亡的信号通路尚不十分清楚。JNK和p38K通路均属于MAPK家族的成员,主要介导损害性刺激引起的细胞凋亡[8-9]。其中,JNK是细胞增生和凋亡不可或缺的。JNK激活是引起细胞增生还是凋亡取决于刺激的强度和激活的细胞类型。一般认为,瞬间的JNK激活促进细胞的生存,而持续性的JNK激活引起细胞凋亡[11]。另有研究[12]表明,p38K 激活对凋亡的影响也具有两面性,其激活是促进细胞凋亡还是抑制凋亡取决于刺激的强度和细胞的类型。我们观察了乙醇处理细胞JNK和p38K的活化及其与乙醇引起的细胞凋亡之间的关系。本研究结果表明,乙醇处理细胞的磷酸化JNK和p38K表达增加,提示JNK和p38K通路被激活。然而,JNK的激活持续时间较长,而p38K的激活时间比较短暂。这一结果提示,JNK通路在乙醇引起的SK-N-SH成神经细胞的死亡中起主要作用。我们利用JNK和p38K磷酸化抑制剂SP600125和SB203580分别抑制JNK和p38K磷酸化后,乙醇诱导的细胞死亡明显受到抑制,进一步说明JNK和p38K通路在乙醇诱导的SK-N-SH成神经细胞的死亡中的作用。
本研究并不排除其他机制在乙醇引起的神经细胞死亡中的作用。例如,氧化应激、炎性反应和硫胺素缺乏等因素[13-14]。然而,本研究结果提示,乙醇引起的神经细胞退变的部分原因很可能与其直接激活JNK和p38K通路从而引起细胞损伤有关。
[1]Nanji A A,Tsukamoto H,French S W.Relationship between fatty liver and subsequent development of necrosis,inflammation and fibrosis in experimental alcoholic liver disease[J].Exp Mol Pathol,1989,51(2):141-148.
[2]Hamamoto T,Yamada S,Hirayama C.Non-oxidative metabolism of ethanol in the pancreas;implication in alcoholic pancreatic damage[J].Biochem Pharmacol,1990,39(2):241-245.
[3]Harper C,Matsumoto I.Ethanol and brain damage[J].Curr Opin Pharmacol,2005,5(1):73-78.
[4]Baker K G,Harding A J,Halliday G M,et al.Neuronal loss in functional zones of the cerebellum of chronic alcoholics with and without Wernicke's encephalopathy[J].Neuroscience,1999,91(2):429-438.
[5]McVicker B L,Buzas C J,Pacher P,et al.Alcohol and mitochondria in cardiac apoptosis:mechanisms and visualization[J].Alcohol Clin Exp Res,2005,29(5):693-701.
[6]McVicker B L,Tuma D J,Casey C A.Effect of ethanol on pro-apoptotic mechanisms in polarized hepatic cells[J].World J Gastroenterol,2007,13(37):4960-4966.
[7]Boyadjieva N I,Sarkar D K.Role of microglia in ethanol's apoptotic action on hypothalamic neuronal cells in primary cultures[J].Alcohol Clin Exp Res,2010,34(11):1835-1842.
[8]Pearson G,Robinson F,Beers Gibson T,et al.Mitogenactivated protein(MAP)kinase pathways:regulation and physiological functions[J].Endocr Rev,2001,22(2):153-183.
[9]Maroni P D,Koul S,Meacham R B,et al.Mitogen Activated Protein kinase signal transduction pathways in the prostate[J].Cell Commun Signal,2004,2(1):5.
[10]Staley K,Blaschke A J,Chun J.Apoptotic DNA fragmentation is detected by a semi-quantitative ligation-mediated PCR of blunt DNA ends[J].Cell Death Differ,1997,4(1):66-75.
[11]Davies C,Tournier C.Exploring the function of the JNK(c-Jun N-terminal kinase)signalling pathway in physiological and pathological processes to design novel therapeutic strategies[J].Biochem Soc Trans,2012,40(1):85-89.
[12]Wagner E F,Nebreda A R.Signal integration by JNK and p38 MAPK pathways in cancer development[J].Nat Rev Cancer,2009,9(8):537-549.
[13]Thomson A D,Guerrini I,Bell D,et al.Alcohol-related brain damage:report from a Medical Council on Alcohol Symposium,June 2010[J].Alcohol Alcohol,2012,47(2):84-91.
[14]Crews F T,Nixon K.Mechanisms of neurodegeneration and regeneration in alcoholism[J].Alcohol Alcohol,2009,44(2):115-127.

