乳腺癌组织中NHERF1、PTEN和ERα蛋白的表达及其临床意义
李 阳 李 洋 程 杉 葛志成 司 杨 贺俊崎*
(1.首都医科大学基础医学院生物化学与分子生物学系,北京100069;2.首都医科大学附属友谊医院普外科,北京100050)
乳腺癌是一种异质性很高的恶性肿瘤,近年来,肿瘤相关基因表达的变化在肿瘤的发生、发展及转移中的作用已引起广泛重视。钠氢交换子调节因子1(Na+/H+exchanger regulatory factor 1,NHERF1)是新发现的乳腺癌抑制基因[1]。PTEN(phosphatase and tensin homology deleted on chromosometen)是被发现的第1个具有磷酸酶活性的抑癌基因[2],可参与细胞周期的调控、促进凋亡和抑制肿瘤的发生。雌激素受体(estrogen receptor,ER)不仅存在于乳腺、子宫等雌激素靶组织,在肺癌等多种非雌激素靶器官组织中也广泛存在[3]。有文献[4]报道,NHERF1 介导雌激素受体调节PTEN蛋白的表达,影响了PTEN相关的信号转导通路,进而影响了乳腺癌的恶性表型。我们采用免疫组织化学方法研究了NHERF、PTEN和雌激素受体亚型ERα蛋白在乳腺癌和癌旁组织中的表达情况,以期在临床水平探讨NHERF1、PTEN和ERα蛋白在乳腺癌发生中的作用、相互关系及其临床意义,为揭示NHERF1通过调节PTEN表达而影响乳腺癌发展的机制提供临床依据。
1 材料与方法
1.1 标本
选取2008年1月至2009年12月首都医科大学宣武医院手术获取的乳腺癌标本4例,患者全部为女性,术前未进行化疗和放疗。采取4例患者癌旁正常组织为对照组。应用BloomRichardsen’s组织学分级,参照Elston和Ellis改良方法[5],对4例乳腺癌组织进行分级:Ⅰ级3例,Ⅱ级1例。病理学类型均为浸润性导管癌(非特殊型)。
1.2 方法
NHERF1鼠抗人单克隆抗体、PTEN鼠抗人单克隆抗体、ERα鼠抗人单克隆抗体(美国Santa Cruz公司产品),S-P免疫组化试剂盒、液体DAB酶底物显色试剂盒均购自北京中杉金桥公司。免疫组化染色SP法,微波抗原修复,按试剂盒说明操作,苏木素衬染。
1.3 结果判定
NHERF1阳性细胞为棕黄色或黄色颗粒位于导管上皮细胞,而只出现于脂肪组织内判定为非特异性染色;PTEN、ERα阳性细胞为棕黄色或黄色颗粒位于细胞质或膜。在癌组织以及癌旁组织随机选择5个高倍镜视野,计数100个细胞中染色阳性细胞的灰度值,并计算癌组织与癌旁组织的灰度值的平均值及标准差,应用双侧t检验,通过P值大小检验癌组织与癌旁组织表达量差异是否有统计学意义。
1.4 统计学方法
采用SPSS 10.0进行统计学分析,计量资料用均数±标准差(±s)表示,组间比较采用配对t检验,等级资料的相关性采用Spearman相关系数rs描写。以P<0.05为差异有统计学意义。
2 结果
2.1 NHERF1在乳腺癌组织和癌旁组织中的表达
4例乳腺癌组织中NHERF1表达量的平均灰度值为201.47;而对应癌旁组织中NHERF1表达量的平均灰度值为477.65,通过配对t检验,差异有统计学意义(P<0.01)(图1)。
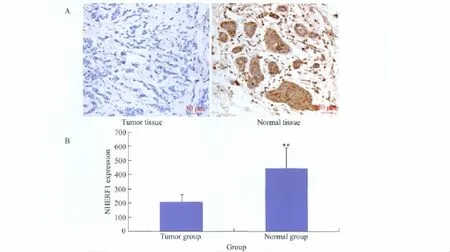
图1 NHERF1蛋白在乳腺癌及癌旁组织中表达量分析Fig.1 NHERF1 expression in breast cancer
2.2 PTEN在乳腺癌组织和癌旁组织中的表达
4例乳腺癌组织中PTEN表达量的平均灰度值为179.23;而对应癌旁组织中PTEN表达量的平均灰度值为373.34,通过配对t检验,差异有统计学意义(P<0.01)(图2)。
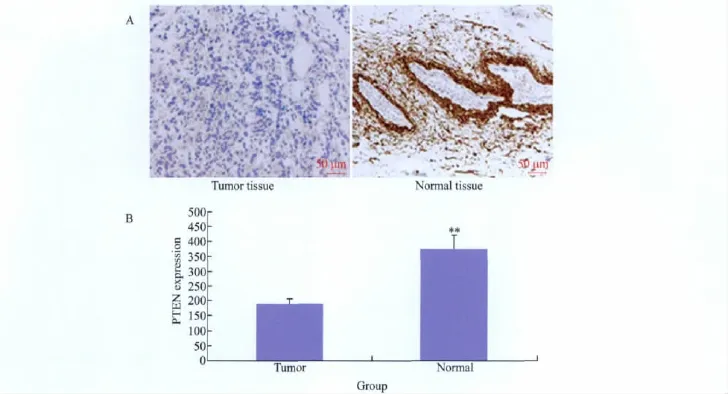
图2 PTEN蛋白在乳腺癌及癌旁组织中表达量分析Fig.2 PTEN expression in breast cancer
2.3 ERα在乳腺癌组织和癌旁组织中的表达
4例乳腺癌组织中ERα表达量的平均灰度值为389.47;而对应癌旁组织中ERα表达量的平均灰度值为177.12,通过配对t检验,差异有统计学意义(P<0.01)(图3)。
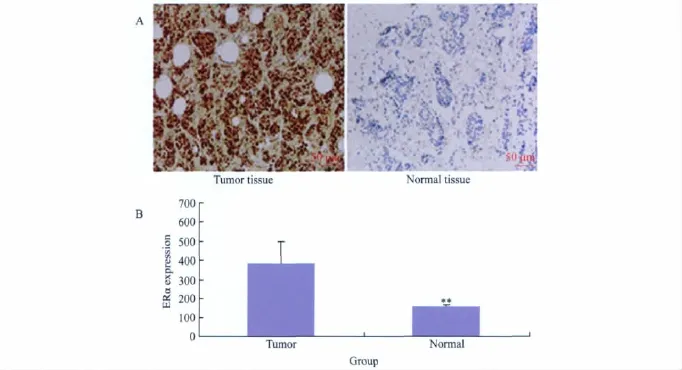
图3 ERα蛋白在乳腺癌及癌旁组织中表达量分析Fig.3 ERα expression in breast cancer
2.4 乳腺癌组织中NHERF1蛋白表达与PTEN表达的关系
通过Spearman等级相关检验NHERF1的表达与PTEN的表达呈正相关(rs=0.611,P<0.01)。
3 讨论
多数乳腺组织中ERα为激素调节转录子,介导细胞激素反应。雌激素与其受体结合,促进新的蛋白的合成,其中包括孕激素受体的合成,其调节乳腺细胞的生长、分化,是乳腺癌的生物学标志之一。本研究中结果显示,ERα在乳腺癌组织表达显著高于正常乳腺组织,提示ERα的高表达可能参与了乳腺癌的发生发展过程。
大量研究[6]结果显示,NHERF1有调节细胞增生的潜在功能。在30%的乳腺癌细胞中发现NHERF-1表达下调,肿瘤的发生可能是由于NHERF1蛋白表达水平较低或消失,使其抑癌作用减弱或消失而导致。抑制乳腺癌细胞T47D或MCF7中内源表达的NHERF-1后,细胞增生能力增强,对裸鼠的致瘤能力也增强。抑制NHERF-1表达后,细胞从G1到S期进展加快,伴随cyclin E表达增加和Rb磷酸化水平升高。由此推测,正常NHERF1在乳腺上皮细胞中的功能是阻止细胞周期进展。NHERF1对细胞周期的调节作用与它在乳腺中的肿瘤抑制活性相关[7]。本研究结果显示,NHERF1在乳腺癌组织表达显著低于正常乳腺组织,提示NHERF1可能参与了乳腺癌的发生发展过程。雌激素受体ERα作为NHERF1的转录调控因子能够调控NHERF1 mRNA的表达,雌激素能够通过ERα诱导细胞内NHERF1的表达[8],但是在本研究中发现,在 ERα高表达的乳腺癌组织中NHERF1低表达,可见,肿瘤组织中NHERF1表达异常,肿瘤组织中NHERF1的表达很可能受到多种因素的调节,并且与肿瘤的发生、发展相关。
PTEN(phosphatase and tensin homology deleted on chromosometen)是1997年发现的一个具有双磷酸酶活性的抑癌基因[9-10],它在细胞的生长、增生、分化、凋亡、黏附、迁移和血管生长等多种生命活动过程中起重要的调节作用。PTEN功能的异常可以引发多种肿瘤。PTEN基因的缺失以及体细胞性突变经常发生于胶质细胞瘤、子宫内膜癌、前列腺癌以及小细胞肺癌中[11]。有研究[4]表明,NHERF1 通过 PDZ-I结构域与抑癌蛋白PTEN有相互作用,并且可提高细胞内PTEN的蛋白表达量,而其mRNA表达水平没有增加;利用环己酮抑制新蛋白合成后,检测到NHERF-1的表达可以抑制PTEN蛋白的降解速度,说明NHERF1能够在蛋白水平促进PTEN蛋白的稳定性。本研究对10例乳腺癌组织标本及癌旁正常组织中PTEN蛋白检测结果显示,PTEN蛋白在乳腺癌组织中表达显著低于正常乳腺组织,并且NHERF1的表达与PTEN的表达呈显著正相关(r=0.611,P<0.01)。由此可见,乳腺癌组织中PTEN蛋白表达高低与NHERF1的表达情况有很大的关系。NHERF1很可能通过对PTEN蛋白稳定性的作用,影响了PTEN相关的信号转导通路,进而影响了乳腺癌的恶性表型。
许多学者[12-13]认为,在恶性肿瘤发生、发展和转移的各阶段,至少有2个或2个以上功能不同,异常激活的基因各自发生作用,促进了细胞的癌变[12]。本课题组研究了乳腺浸润性导管癌中 NHERF1、PTEN、ERα在乳腺癌的表达情况及其相互关系,研究结果显示NHERF1和PTEN的表达呈正相关,在肿瘤组织中NHERF1表达量降低,PTEN的表达也会下降,很可能是由于NHERF1的表达影响了PTEN蛋白的表达及稳定性,从而影响了PTEN在乳腺癌组织中的蛋白水平,进而调节了乳腺癌的发生发展,表明在肿瘤细胞的增生侵袭过程中,多种因子相互作用,参与肿瘤生成发展的多个环节。
综上所述,乳腺浸润性导管癌的发生和发展与其生物学特征的分布有一定规律可循,联合检测NHERF1、PTEN可作为制定综合治疗方案的依据,用来指导临床用药和判断预后。
[1]Dai J L,Wang L,Sahin A A,et.al.NHERF(Na+/H+exchanger regulatory factor)gene mutations in human breast cancer[J].Oncogene,2004,23(53):8681-8687.
[2]Steck P A,Pershouse M A,Jasser S A,et al.Identification of a candidate tumor suppressor gene MMAC1,at chromosome 10q23.3 that is mutated in multiple advanced cancers[J].Nat Genet,1997,15(4):356-362.
[3]Sica G,Wagner P L,Altorki N,et al.Immunohistochemical expression of estrogen and progesterone receptors in primary pulmonary neuroendocrine tumors[J].Arch Pathol Lab Med,2008,132(12):1889-1895.
[4]Yang L,Wang Y,Chen P,et al.Na(+)/H(+)exchanger regulatory factor 1(NHERF1)is required for the estradiol-dependent increase of phosphatase and tensin homolog(PTEN)protein expression[J].Endocrinology,2011,152(12):4537-4549.
[5]Elston C W,Ellis I O.Pathological prognostic factors in breast cancer.I.The value of histological grade in breast cancer:experience from a large study with long-term followup[J].Histopathology,2002,41(3A):154-161.
[6]Voltz J W,Weinman E J,Shenolikar S.Expanding the role of NHERF,a PDZ-domain containing protein adapter,to growth regulation[J].Oncogene,2001,20(44):6309-6314.
[7]Shao Z M,Nguyen M,Barsky S H.Human breast carcinoma desmoplasia is PDGF initiated[J].Oncogene,2000,19(38):4337-4345.
[8]Ediger T R,Kraus W L,Weinman E J,et al.Estrogen receptor regulation of the Na+/H+exchange regulatory factor[J].Endocrinology,1999,140(7):2976-2982.
[9]Li J,Yen C,Liaw D,et al.PTEN,a putative protein tyrosine phosphatase gene mutated in human brain,breast,and prostate cancer[J].Science,1997,275(5308):1943-1947.
[10]Steck P A,Pershouse M A,Jasser S A,et al.Identification of a candidate tumour suppressor gene,MMAC1,at chromosome 10q23.3 that is mutated in multiple advanced cancers[J].Nat Genet,1997,15(4):356-362.
[11]Schmitz M,Grignard G,Margue C,et al.Complete loss of PTEN expression as a possible early prognostic marker for prostate cancer metastasis[J].Int J Cancer,2007,120(6):1284-1292.
[12]陈刚,林色南,胡丹,等.COX-2和VEGF在鼻咽癌组织中的表达及临床意义[J].诊断病理学杂志,2007,14(6):453-455.
[13]张华东,熊正文,黄勇,等.血管内皮生长因子mRNA及其蛋白、上皮细胞钙黏蛋白在喉鳞状细胞癌中表达的研究[J].解放军医药杂志,2011,23(3):1-5,110.

