p16、β-catenin、CyclinD1在宫颈病变中的表达及其临床意义
陈海楠,杨祖菁
(上海交通大学医学院附属新华医院妇科,上海200092)
p16、β-catenin、CyclinD1在宫颈病变中的表达及其临床意义
陈海楠,杨祖菁*
(上海交通大学医学院附属新华医院妇科,上海200092)
目的检测p16、β-catenin和CyclinD1在正常宫颈、宫颈上皮内瘤样病变(CIN)以及宫颈癌(CC)中的表达,研究其在宫颈病变发生发展过程中的作用及可能机制。方法应用免疫组化Envision System二步法检测p16、β-catenin和CyclinD1蛋白在正常宫颈组织(非恶性肿瘤原因切除)、CIN和CC中的表达情况,比较三种蛋白在三组间的表达强度,并进行相关性分析。结果p16、β-catenin和CyclinD1蛋白阳性表达在正常宫颈组织、宫颈上皮CIN和CC组三组中差异具有统计学意义(P=0.00,P=0.00,P=0.00)。在正常宫颈组中三种蛋白互相之间有相关性,且呈正相关性(P=0.00,P=0.000,P=0.02);在CIN组中,p16和β-catenin、β-catenin和CyclinD1之间有相关性,且呈正相关性(P=0.03,P=0.00),p16和CyclinD1蛋白之间有一定的相关性,差异有统计学意义(P=0.42<0.05);在CC组中三种蛋白互相之间有相关性,且呈正相关性(P=0.01,P=0.01,P=0.01)。结论p16、β-catenin和CyclinD1蛋白在宫颈组织中异常表达可能与宫颈病变的发生和发展相关。
宫颈癌;宫颈上皮内瘤样病变;β-连接素;细胞周期蛋白D1;p16蛋白
宫颈癌是女性最常见的恶性肿瘤之一,每年其在全球的新发病例数约50万人,由于宫颈癌而导致死亡的人数达23万~29万[1]。目前宫颈癌确切的病因尚未完全明了,虽然高危型HPV感染被认为是它的主要病因[1],但并非所有感染高危型HPV的患者都会发展为宫颈癌,这是由于人自身免疫机制的作用可以清除部分的病毒,且高危型HPV感染宫颈并导致宫颈癌的发生还需要其他因素的协同作用[2-3]。研究表明,宫颈癌的发生发展是多因素多阶段演变的结果,有多种癌基因和抑癌基因的参与[2]。
随着分子生物学技术的发展和研究的深入,人们逐渐认识到细胞周期调节紊乱可能是肿瘤发生的重要环节。因此,有关细胞周期调控的相关蛋白、调控的机制与肿瘤的发生的关系、细胞信号的转导、相关的细胞周期检测点逐渐成为学界研究的热点问题。p16、β-catenin和CyclinD1蛋白作为细胞周期调节蛋白,主要作用于G1期,发挥调节作用。近年来三者在宫颈病变中的单独作用研究较多,本文主要通过检测p16、β-catenin和CyclinD1在正常宫颈、CIN以及宫颈癌中的表达,探讨其在宫颈肿瘤的发生发展过程中的作用及可能机制。
1 资料与方法
1.1 标本来源选取交通大学医学院附属新华医院2011年8月至2012年1月初诊、未治宫颈癌21例;CIN 24例;正常宫颈组织22例作为对照。CIN组和宫颈癌组的标本取自术后病变宫颈组织,正常宫颈组织则来源于因非恶性肿瘤原因(如子宫肌瘤、子宫肌腺症等)行全子宫切除的手术的宫颈组织,全部病例组织经病理科两位医师诊断确诊。诊断标准符合宫颈癌和宫颈上皮内瘤样病变的病理诊断标准[4]。
1.2 方法所有标本经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚度切片,常规HE染色和免疫组化染色(采用S-P法)鼠抗人单克隆抗体p16、鼠抗人单克隆抗体cyclinD1、鼠抗人单克隆抗体β-catenin购自上海长岛生物技术有限公司。严格按说明书操作,DAB显色。以已知蛋白表达阳性的组织作为阳性对照。用PBS缓冲液代替一抗作阴性对照。
1.3 结果判定标准p16阳性部位为细胞核/细胞浆,β-catenin阳性部位为细胞浆/细胞核,Cyclin D1阳性部位为细胞核。免疫组化染色阳性反应为黄-棕黄颗粒。按许良中等[5]的研究,对染色结果采用双评分法进行判定,根据阳性细胞的比例和显色强度两方面决定。记分标准:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;显色强度评分:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两者乘积≤1为阴性,1~3为弱阳性,>3为阳性。
1.4 统计学方法采用SPSS13.0统计软件进行数据处理。三种蛋白在各组的表达结果的比较采用两等级资料比较的Mann-Whitney U秩和检验;三种蛋白在各组中的两两相关性采用Spearman等级相关分析进行统计分析。以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 p16在正常宫颈组织、CIN和宫颈癌细胞中的表达三组中p16的阳性率分别为9.09%(2/22)、83.33%(20/24)、95.24%(20/21)。阳性表达主要集中于细胞浆(图1、图2)。各组间表达差异有统计学意义(P<0.01),见表1。
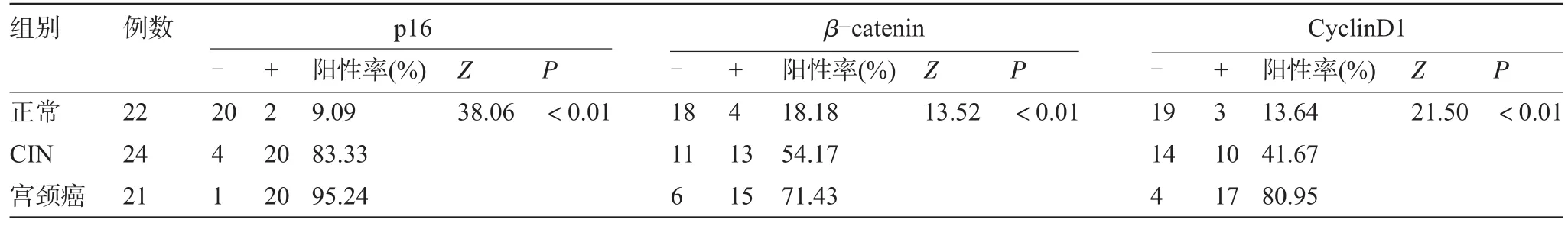
表1 p16、β-catenin和CyclinD1蛋白在正常宫颈组织、CIN、宫颈癌三组中的表达(例)
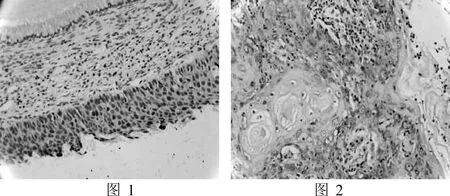
图1 CIN中p16的阳性表达(×200)图2宫颈癌中p16的阳性表达(×200)
2.2 β-catenin在正常宫颈组织、CIN和宫颈癌细胞中的表达三组中β-catenin的阳性率分别为18.18%(4/22)、54.17%(13/24)、71.43%(15/21)。CIN组阳性表达主要集中于细胞浆(图3),宫颈癌组阳性表达更多见于细胞核(图4)。各组间表达差异有统计学意义(P<0.01),见表1。
2.3 CyclinD1在正常宫颈组织、CIN和宫颈癌细胞中的表达三组中CyclinD1的阳性率分别为13.64%(3/22)、41.67%(10/24)、80.95%(17/21)。阳性表达主要集中于细胞核(图5、图6)。各组间表达差异有统计学意义(P<0.01),见表1。
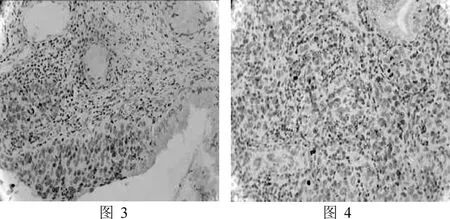
图3 CIN中β-catenin的阳性表达(×200)图4宫颈癌中β-catenin的阳性表达(×200)

图5 CIN中Cyclin D1的阳性表达(×200)图6宫颈癌中Cyclin D1的阳性表达(×200)
2.4 p16、β-catenin和CyclinD1蛋白在CIN、宫颈癌三组中表达的相关性使用Spearman等级相关分析法分析CIN组中p16和β-cetenin的表达有正相关性,差异有统计学意义(r=0.440,P<0.05)。CIN组中β-cetenin和Cyclin Dl的表达有正相关性,差异有统计学意义(r=0.625,P<0.01)。CIN组中Cyclin Dl和p16的表达无相关性(r=0.172,P>0.05);宫颈癌组中p16和β-cetenin的表达有正相关性,差异有统计学意义(r=0.568,P<0.01)。宫颈癌组中β-cetenin和Cyclin Dl的表达有正相关性,差异有统计学意义(r=0.580,P<0.01)。宫颈癌组中Cyclin Dl和p16的表达有正相关性,差异有统计学意义(r=0.685,P=0.01)。
3 讨论
细胞生长周期为G1期-S期-G2期-M期。在此细胞周期中,G1期到S期、G2期到M期被认为是关键点。由于G1期为控制细胞周期长短的限速期[6],且终末分化的细胞也停留于此期,所以G1期到S期对细胞的增殖更为重要。部分细胞周期调节蛋白正是通过促进或抑制细胞通过G1期来调控细胞的增殖和分化。
β-cetenin作为一种多功能的蛋白,广泛存在于各种类型的细胞。一方面通过与细胞膜上的钙黏蛋白相互作用,参与细胞的粘附;另一方面作为wnt信号通路中的关键调控因子,参与细胞的增殖、分化和凋亡等重要的调节作用[7]。在有wnt信号时,wnt配体与低密度脂蛋白受体相关蛋白(LRP受体)和卷曲蛋白(Fz受体)及胞质内的蓬乱蛋白(DV1)结合后,在轴蛋白Axin的协助下,使β-catenin多聚复合体糖原合酶激酶3β(GSK-3β)的活性受抑制,从而避免β-catenin的降解,使得β-catenin在细胞浆中积累,并进入细胞核,与转录因子(T cell factor/lymphoid enhancer factor,TCF/LEF)结合形成二聚体,激活下游靶基因Cyclin D1等的转录,引起细胞增殖和分化失控导致肿瘤发生[8]。Rodríguez-Sastre等[9]将正常组织与43例癌前病变组织,126例浸润型癌进行了免疫组化分析比较,62%癌前病变组织及70%以上的癌组织胞浆中有β-catenin的异常分布,同时在40%的癌变前组织中β-catenin胞膜表达均缺失,说明β-catenin蛋白异常表达与宫颈癌的发生具有密切关系。本研究同样显示β-catenin在CIN组和CC组存在较高的易位表达率,阳性率分别达到54.17%和71.43%,这可能与wnt信号转导相关,当wnt信号不存在时,β-catenin可与细胞膜上的钙黏蛋白结合,在胞浆内则被有效的降解,所以在正常宫颈组织中多为正常表达;当存在wnt信号时,β-catenin不易被降解,进一步向细胞浆和细胞核内聚集,表现为易位表达,说明其易位表达与宫颈病变的进展密切相关。
Cyclin D1作为G1期细胞周期素,以及wnt/ β-catenin信号通路调控的靶蛋白,在G1/S期转换中起重要作用。在生理状态下,细胞进入S期后CyclinD1迅速分解。如CyclinD1基因激活,则CyclinD1持续高表达,将导致G1期缩短,提前进人S期,继而导致遗传基因突变和染色体结构异常的细胞获得增殖,使细胞增殖失控,最终形成肿瘤[10-11]。古丽娜·库尔班等[12]检测了正常宫颈、CIN及宫颈癌组织中的CyclinD1的表达,显示随宫颈病变的进展,表达强度逐级提高,证实CyclinD1的过度表达与宫颈癌的发生发展有关。本研究也提示,CyclinD1在正常宫颈组织中呈低表达,在CIN组和宫颈癌组中表达逐渐上升,且和正常组织比较差异有统计学意义。推测其可使宫颈细胞调控发生紊乱,导致细胞增生异常,对宫颈病变的发生和发展起推动作用。
本研究对wnt/β-catenin信号通路及其下游受控靶蛋白之一的CyclinD1的相关性研究显示,两者存在显著的正相关性,提示wnt/β-catenin信号通路在宫颈病变的发展中起着重要作用。
编码p16蛋白的p16基因被视为抑癌基因,在肿瘤组织中发生缺失、突变及甲基化,抑癌基因的失活也被认为在宫颈癌的发生中起重要作用。p16基因启动子的甲基化是常见的失活形式[13]。由于p16蛋白在CyclinD-CDK4/6-pRb-E2F调节途径中和CyclinD1竞争CDK4/6,且具负反馈调节作用,故而高磷酸化的pRb增多可以导致p16蛋白的高表达。Benevolo等[14]报道,使用免疫组化检测了100例宫颈组织,提示随宫颈病变的加剧,p16蛋白阳性率逐渐升高。Nam等[15]的研究也证实,在从CIN到宫颈癌的病变过程中,p16阳性率呈上升趋势,差异有统计学意义。本研究也得到了同样的结论,即p16阳性率随宫颈病变的加重,呈上升趋势,且差异有统计学意义。而相关性研究显示,在CIN组中,p16和CyclinD1的相关性不明确,而在宫颈癌组中,两者的相关性有统计学意义,也提示,随着宫颈病变的加重,CyclinD1的阳性率进一步上升,使得高磷酸化的pRb增多,负反馈导致p16阳性率也发生明显增加。
综上所述,宫颈癌的发病机制复杂,绝不是单一因素导致的结局,而是一个多阶段、多基因、多因素共同参与的结果。正是由于宫颈病变是个多因的、渐进的过程,这也给早期诊断和早期治疗提供了更多的途径和机会。对宫颈组织进行p16、β-catenin和CyclinD1蛋白的检测,有助于对宫颈病变的早期诊断,同时也为宫颈癌的治疗提供一种新的方向。对研究对象进行系统的随访研究,可进一步探讨三种调节蛋白对宫颈病变预后的相关性。
[1]Abdelmutti N,Hoffman-Goetz L.Risk messages about HPV.cervi-cal cancer,and the HPV vaccine gardasil in North American News Magazines[J].J Cancer Educ,2010,25(3):451-456.
[2]Almonte M,Albero G,Molano M,et al.Risk factors for human papillomavirus exposure and co-factors for cervical cancer in Latin America and the Caribbean[J].Vaccine,2008,19(26):16-36.
[3]Einstein MH,Studentsov YY,Ho GY,et al.Combined human papillomavirus DNA and human papillomavirus-like particle serologic assay to identify women at risk for high-grade cervical intraepithelial neoplasia[J].Int J Cancer,2007,120(1):55-59.
[4]刘彤华.诊断病理学[M].2版.北京:人民卫生出版社,2006:408-414.
[5]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[6]Hichman KA,Roberts JM.Rules to Replicat by[J].Cell,1994,79:557-562.
[7]Ewan KB,Dale TC.The potential for targeting oncogenic WNT/beta-catenin signaling intherapy[J].Curr Drug Targets,2008,9(7):532-547.
[8]Loeppen S,Koehle C,Buchmann A,et al.A beta-catenin-dependent pathway regulates expression of cytochrome p450 isoforms in mouse liver tumors[J].Carcinogenesis,2005,26(1):239-248.
[9]Rodríguez-Sastre MA,González-Maya L,Delgado R,et al.Abnormal distribution of E-cadherin and beta-catenin in different histologic types of cancer of the uterine cervix[J].Gynecol Oncol,2005, 97(2):330-336.
[10]Udhayakumar G,Jayanthi V,Devaraj N,et a1.Interaction of MUC1 with beta-catenin modulates the Wnt target gene cyclinD1 in H.pylori-induced gastric cancer[J].Mol Carcinog,2007,46(9):807-817.
[11]Motokura T,Bloom T,Kim HG,et al.A novel Cyclin encoded by a bell-linked candidate oncogene[J].Nature,1991,350(6318):462-463.
[12]古丽娜·库尔班,李小文,赵峰,等.β-catenin、Cyclin D1和c-myc在CIN及宫颈鳞癌中的表达及意义[J].新疆医科大学学报, 2008,31(6):641-644.
[13]Redman R,Rufforny I,Liu C,et al.The utility of p16(Ink4a)in discriminating between cervical intraepithelial neoplasia 1 and nonneoplastic equivocal lesions of the cervix[J].Arch Pathol Lab Med, 2008,132(5):795-799.
[14]Benevolo M,Mottolese M,Marandino F,et a1.Immunohistochemical expression of p16(INK4a)is predictive of HR-HPV infection in cervical low-grade lesions[J].Mod Pathol,2006,19(3):384-391.
[15]Nam EJ,Kim JW,Kim SW,et a1.The expressions of the Rb pathway in cervical intraepithelial neoplasia;predictive and prognostic significance[J].Gynecol Oncol,2007,104(1):207-211.
Expression of p16,β-catenin,CyclinD1 in cervical lesions and their clinical significance.
CHEN Hai-nan,YANG Zu-jing*.Department of Gynecology,Xinhua Hospital Affiliated to School of Medicine of Shanghai Jiao Tong University, Shanghai 200092,CHINA
ObjectiveTo study the role of p16,β-catenin,CyclinD1 in the pathogenesis and development of cervical disease,by investigating their expression in normal cervical tissue,cervical intraepithelial neoplasia(CIN)and cervical carcinoma(CC).MethodsThe expression of p16,β-catenin and cyclinD1 was tested by SPimmunohistochemistry in normal cervical tissue,CIN and CC.ResultsThe positive expression rates of p16,β-catenin and CyclinD1 showed statistically significant difference between normal cervical tissue,CIN and CC(P=0.00,P=0.00,P=0.00<0.05). In normal cervical tissue,the expression of p16,β-catenin and CyclinD1 was positively correlated(P=0.00,P=0.00, P=0.02<0.05).In CIN,the expression between p16 and β-catenin as well as that between β-catenin and CyclinD1 was positively correlated(P=0.03<0.05,P=0.00<0.05),while no significant correlation was found between p16 and CyclinD1(P=0.42>0.05).In CC,the expression of p16,β-catenin and CyclinD1 was positively correlated(P=0.01, P=0.01,P=0.01<0.05).ConclusionThe abnormal expression of β-catenin,p16 and CyclinD1 may be associated with the occurrence and development of cervical lesions.
Cervical cancer;CIN;β-catenin;CyclinD1;p16 protein
R711.74
A
1003—6350(2012)22—014—04
10.3969/j.issn.1003-6350.2012.22.005
2012-04-18)
陈海楠(1978—),男,上海市人,主治医师,在读硕士,研究方向:宫颈恶性肿瘤及内分泌。
*通讯作者:杨祖菁。E-mail:yzujing@sohu.com

