眼镜蛇神经毒素大鼠不同脑区给药的镇痛作用研究
刘启萍,郝永龙
(山东中医药大学第二附属医院,山东 济南 250001)
眼镜蛇神经毒素肌肉注射给药能明显提高实验大、小鼠的痛阈,具有镇痛作用[1]。连续小剂量肌肉注射可使大鼠某些脑区的脑啡肽样物质含量明显升高,眼镜蛇神经毒素的镇痛作用不一定是直接作用于吗啡受体而产生。至于眼镜蛇神经毒素镇痛机理的研究,只局限在中脑导水管部位注射微量眼镜蛇神经毒素的研究,本文通过第三脑室、下丘脑和尾状核都是与镇痛有关的中枢部位,更进一步为研究眼镜蛇神经毒素的镇痛机理提供实验依据。
1 实验材料
1.1 试药 纯化的眼镜蛇神经毒素(α-Cobrotoxin)由广西医科大学蛇毒研究所提供。电泳呈单一区带,相对分子质量约7000 u(SDS法),等电聚焦电泳测定PI为9.5。套管、戊巴比妥钠、乙醚均由浙江中医药大学药理教研室提供。
1.2 动物 SD大鼠80只,雄、雌各半,体重(220±30)g,均由浙江中医药大学动物实验中心提供。
2 方法与结果
2.1 动物筛选 照药理实验方法学[2]大鼠热刺激甩尾法要求筛选大鼠。选用2~10 s内引起甩尾反应的大鼠,将反应过激和反应迟钝的大鼠剔除。
2.2 大鼠不同脑区内埋植套管 取经筛选的SD大鼠30只,随机分为5组,每组6只,即对照组、第三脑室组、中脑导水管组、下丘脑组、尾状核组。分别用质量浓度为3%戊巴比妥钠30 mg·kg-1腹腔注射麻醉,固定于大鼠立体定位仪(江湾Ⅰ型C)上,用碘酒、75%消毒医用酒精消毒皮肤,头顶正中切开暴露颅骨,按大鼠脑立体定位图谱[3]中脑导水管坐标A(前囟后1 mm),L(正中线旁开 1 mm),H(深度 5.5 mm);第三脑室坐标A(前囟后1.3 mm),L(正中线旁开0 mm),H(深度5 mm);下丘脑坐标A(前囟后1.8 mm),L(正中线旁开 0.8 mm),H(深度 6.4 mm);尾状核坐标 A(前囟前 1.2 mm),L(正中线旁开2 mm),H(深度5 mm)下一侧各脑区内埋管,将外径1.2 mm,长度7 mm的不锈钢套管埋植在靶位之上1 mm处,用庆大霉素注射液喷洒创面后,用牙托粉固定于颅骨表面。
2.3 各脑区内给药 埋植套管7 d后,分别将各组大鼠用乙醚轻度麻醉置于大鼠脑立体定位仪上,用1 μL和50 μL微量注射器针头插入套管,定位于各脑区。第三脑室为10 μL,其他不同脑区的每组大鼠分别注射1 mg·mL-1的α-Cobrotoxin生理盐水溶液各0.5 μL,于2 min内匀速注射完毕,避免药液外溢。对照组给药方式同其它组,注射等量生理盐水。
2.4 测定痛阈 参照药理实验方法学,在大鼠活动正常的情况下置大鼠于固定筒内,尾部暴露于外,将大鼠尾下部垂直浸入预热(55±0.5)℃的恒温水浴锅中,浸入长度4 cm左右,以大鼠甩尾的潜伏期作为痛反应指标。给药前间隔5 min测3次,取其平均值为基础痛阈。给药后每隔10 min测定一次,1 h后每30 min测定一次,共测3 h。所测值与基础痛阈相比较。结果显示:大鼠不同脑区定位注射神经毒素后10 min、20 min、30 min、40 min、50 min、60 min、90 min、120 min、150 min、180 min用热水浴甩尾法测定其痛阈,可以看出,下丘脑效果最好,10 min痛阈与生理盐水组相比,即有显著差异,30 min达高峰,并可持续180 min,痛阈最大提高213%;中脑导水管给药后20 min达峰,痛阈最大提高167%(P<0.01);第三脑室给药后20 min达峰,痛阈最大提高142%(P<0.01);尾状核给药后50 min达峰,痛阈最大提高135%(P<0.01)。结果见图1和表1。
表1 眼镜蛇神经毒素大鼠不同脑区注射前、后的痛阈变化(n=6SD)
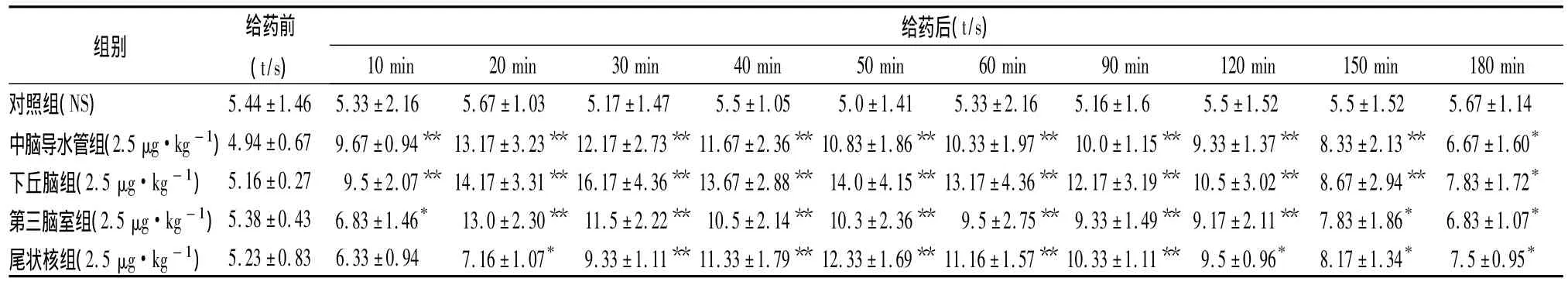
表1 眼镜蛇神经毒素大鼠不同脑区注射前、后的痛阈变化(n=6SD)
注:与 NS组痛阈值比较,*P <0.05,**P <0.01
给药后(t/s)in 150 min 180 min对照组(NS) 5.44±1.46 5.33±2.16 5.67±1.03 5.17±1.47 5.5±1.05 5.0±1.41 5.33±2.16 5.16±1.6组别给药前(t/s)10 min 20 min 30 min 40 min 50 min 60 min 90 min 120 m 5.5±1.52 5.5±1.52 5.67±1.14中脑导水管组(2.5 μg·kg-1)4.94±0.67 9.67±0.94** 13.17±3.23** 12.17±2.73** 11.67±2.36** 10.83±1.86** 10.33±1.97** 10.0±1.15** 9.33±1.37** 8.33±2.13** 6.67±1.60*下丘脑组(2.5 μg·kg-1) 5.16±0.27 9.5±2.07** 14.17±3.31** 16.17±4.36** 13.67±2.88** 14.0±4.15** 13.17±4.36** 12.17±3.19** 10.5±3.02** 8.67±2.94** 7.83±1.72*第三脑室组(2.5 μg·kg-1)5.38±0.43 6.83±1.46* 13.0±2.30** 11.5±2.22** 10.5±2.14** 10.3±2.36** 9.5±2.75** 9.33±1.49** 9.17±2.11** 7.83±1.86* 6.83±1.07*尾状核组(2.5 μg·kg-1) 5.23±0.83 6.33±0.94 7.16±1.07* 9.33±1.11** 11.33±1.79** 12.33±1.69** 11.16±1.57** 10.33±1.11** 9.5±0.96* 8.17±1.34* 7.5±0.95*

图1 眼镜蛇神经毒素不同脑区中枢性镇痛作用
2.5 注射部位鉴定 每次实验结束后将大鼠处死,解剖大脑确定插入的部位是否准确。然后取脑组织置于10%甲醛溶液中固定,做0.2~0.5 mm连续脑组织切片,根据注射针头留下的痕迹准确确定其是否埋管准确。
3 讨论
痛觉的传递系统包括三个主要部分,即外周感觉神经、脊髓到脑干和丘脑的神经元网络以及丘脑和大脑皮质的相互联系,包括丘脑、脑桥、中脑在内的皮质下中枢和大脑皮质构成了痛觉中枢。其中,丘脑的许多核团对疼痛有着显著的调控作用,传递痛觉的脊髓丘脑束纤维就终止在丘脑的不同核团上。在这些核团中,含有对伤害性刺激的痛敏神经元,参与疼痛的兴奋或抑制作用。同时,刺激下丘脑的前部、中部、后部和视上核可提高痛阈,产生明显的镇痛作用。因此,丘脑是疼痛传递和调制中非常重要的整合中枢[4,5]。
本实验通过对大鼠下丘脑、中脑导水管周围灰质、第三脑室和尾状核四部位定位注射蛇神经毒素,结果表明这四个部位都具有较明显的镇痛作用,而下丘脑为镇痛最佳部位。眼镜蛇神经毒素的中枢作用部位为下丘脑、尾状核、第三脑室、PAG、海马和皮质等脑区。因本实验中动物样本数和脑区个数有限,关于注射眼镜蛇神经毒素后,中枢较高含量的乙酰胆碱和内源性阿片肽的产生机制,及其M型胆碱受体作用仍有待深入研究。
[1]陈汝筑,吴秀荣.眼镜蛇神经毒素的镇痛作用[J].中国药理学通报,1988,4(2):113 -117.
[2]徐叔云,卞如濂,陈修.药理实验方法学[M].第2版.北京:人民卫生出版社,1991:90.
[3]Paxinos G,Waston C.The Rat Brain in Stereotaxic Coordinates[M].Second Edition.Sydney:Academic Press,1986:30.
[4]Helmchen C,Lindig M,Petersen D,et al.Disappearance of central thalamic pain syndrome after contralateral parietal lobe lesion:implications for therapeutic brain stimulation[J].Pain,2002,98(3):325 -330.
[5]Desbois C,Villanueva L.The organization of lateral ventromedial thalamic connections in the rat:a link for the distribution of nociceptive signals to widespread cortical regions[J].Neuroscience,2001,102(4):885 -898.

