酸柏栀油软胶囊对去势大鼠学习记忆及脑内NO、Ach的影响*
李宝莉,符兆英,陈雅慧,高 枫,张正祥
(延安大学医学院,陕西 延安 716000)
卵巢功能衰退,体内雌激素水平下降致神经内分泌调节机制失衡而出现一系列症状,现代医学称为“围绝经期综合征”,主要采用性激素替代疗法,但存在诸多禁忌症和不良反应,临床应用受到限制。目前寻找具有雌激素样生物活性的天然药物是国内外研究的热点,其中延缓卵巢衰老是研究药物机理的中心环节。本课题采用酸枣仁油、柏子仁油、栀子仁油制备成酸柏栀油软胶囊,研究其对雌性去势大鼠学习记忆的影响,初步探讨其抗衰老的作用机制。
1 材料与方法
1.1 实验动物
健康雌性SPF级SD大鼠60只,3月龄,体重(280±20)g,由西安交通大学医学院实验动物中心提供,陕医动字:08-005。
1.2 实验药物
酸柏栀油软胶囊(soft capsule of compound oil of jujube,arboruitae and gardenia,SCCOJAG)是将酸枣仁油、柏子仁油、栀子油按3∶3∶l配伍,由西安东盛医药研究所制备成每粒 0.5 g,批号:081120。乙烯雌酚(Diethylstilbestrol;石家庄市协和药业有限公司生产,批号:H13021146)。
1.3 实验器材
KDC-160HR高速冷冻离心机,MT-200Morris水迷宫视频跟踪系统(成都泰盟科技有限公司制造),TU-1800PC紫外可见分光光度计(北京普析通用仪器有限责任公司)。E2、FSH、LH测定:采用罗氏COBASE411全自动化学发光免疫分析仪(电化学免疫发光法),所用诊断试剂、标准品和质控品均由瑞士罗氏公司提供。一氧化氮合酶(nitric oxide synthase,NOS)检测试剂盒(批号:20080913),乙酰胆碱转移酶(choline acety ltransferase,ChAT)检测试剂盒(批号:20080721),胆碱酯酶(acetylcholinesterase,AChE)检测试剂盒(批号:20080515)均购自南京建成生物工程研究所。
1.4 实验与分组
(1)卵巢去势组:取50只健康雌性SD大鼠,3%戊巴比妥钠(1 ml/kg)腹腔注射麻醉,无菌条件下行双侧卵巢切除术,术后立即肌注4×105U青霉素预防感染。随机分为5组(n=10):SCCOJAG大、中、小剂量组,乙烯雌酚组,模型组。(2)假手术组:开腹后不切除双侧卵巢,仅切除卵巢周围等体积的脂肪。术后2周,行阴道脱落细胞检查,确定造模成功。手术4周后开始灌胃给药,每天1次,连续12周。大、中、小剂量组分别给予 SCCOJAG 4.50 g/kg 、1.80 g/kg、0.72 g/kg;乙烯雌酚组给予己烯雌酚0.02 mg/kg,模型组和假手术组均给予等体积的生理盐水作对照。
1.5 Morris水迷宫实验
第121天于给药后1 h开始训练(每天9∶00-12∶00),水温保持在(22±2)℃。将水池等分为4个象限,在任意象限正中离池壁33 cm处放一个直径12 cm、高20 cm的平台,平台顶低于水面2 cm。实验前将大鼠置于站台上适应20 s,随后将大鼠从不同象限入水点背对站台放入水池,记录大鼠自入水到找到站台所需的时间,记为潜伏期,找到后在平台上保持15 s,如2 min内找不到,引导到平台上保持15 s。每天每只大鼠训练4个象限,连续训练5 d。定位航行实验结束后撤掉平台,选定和平台相对的象限中点为入水点,观察大鼠在120 s内跨越原平台所在位置的路径和次数,记录穿越次数。训练期间迷宫外参照物保持不变,室内保持安静。
1.6 血样的收集与检测
第126天空腹12 h末次给药1 h后,3%戊巴比妥钠(1 mL/kg)腹腔注射麻醉大鼠,颈总动脉导管引流取血,低温离心分离血清,测定性激素。
1.7 脑组织生化指标测定
(1)组织匀浆制备:取血后,在冰台上迅速剥离大脑皮层,冷生理盐水溶液冲洗残血,拭干。精确称取脑组织,置超声波组织匀浆器中粉碎,加入9倍预冷的生理盐水溶液,制成10%的组织匀浆液待测。(2)测试方法:NOS、ChAE、AChE的测定(比色法)严格按试剂说明操作。
1.8 统计学处理
采用SPSS 19.0统计分析软件,对水迷宫重复测量数据进行一般线性模型(general linear model,GLM)的 Repeated measures和Multivariate,用 Repeated measures单变量方差分析LSD-t检验,实现每组在每个时间点上的两两比较;用Multivariate多元方差分析LSD-t检验,实现每个时间点上组间的两两比较[1]。其它计量资料的方差分析采用Univariate中组间LSD-t检验/Tamhane-t′检验的两两比较。
2 结果
2.1 SCCOJAG对去势大鼠学习记忆的影响
去势大鼠的登台潜伏期较长,穿越原平台次数较少;SCCOJAG能缩短登台潜伏期,增加穿越原平台次数,与模型组比较有统计学意义;各给药组的潜伏期随训练天数增加逐渐缩短也有明显的统计学意义,作用类似乙烯雌酚组(表1)。
Tab.1 Influence of SCCOJAG on platform-climbing latency and crossing number in Morris water maze of castrated rats(±s)
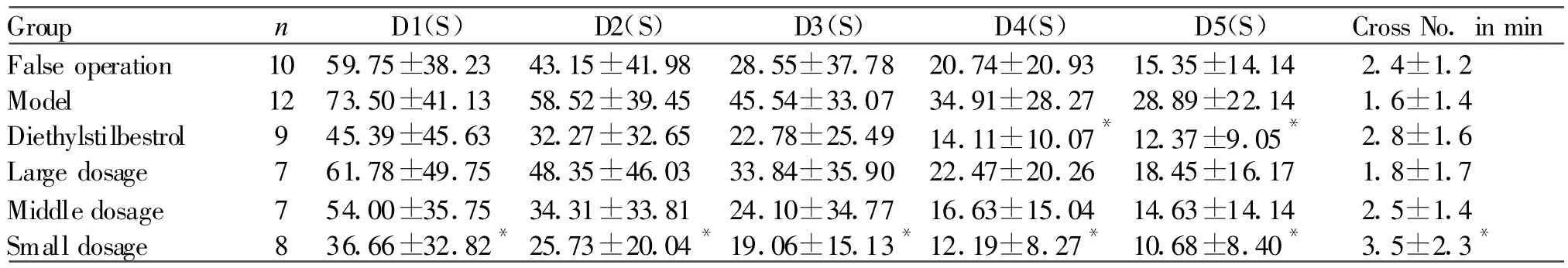
Tab.1 Influence of SCCOJAG on platform-climbing latency and crossing number in Morris water maze of castrated rats(±s)
SCCOJAG:Soft capsule of compound oil of jujube,arboruitae and gardenia*P<0.05 vs model group
Group n D1(S) D2(S) D3(S) D4(S) D5(S) Cross No.in min False operation 10 59.75±38.23 43.15±41.98 28.55±37.78 20.74±20.93 15.35±14.14 2.4±1.2 Model 12 73.50±41.13 58.52±39.45 45.54±33.07 34.91±28.27 28.89±22.14 1.6±1.4 Diethylstilbestrol 9 45.39±45.63 32.27±32.65 22.78±25.49 14.11±10.07*12.37±9.05* 2.8±1.6 Large dosage 7 61.78±49.75 48.35±46.03 33.84±35.90 22.47±20.26 18.45±16.17 1.8±1.7 Middle dosage 7 54.00±35.75 34.31±33.81 24.10±34.77 16.63±15.04 14.63±14.14 2.5±1.4 Small dosage 8 36.66±32.82*25.73±20.04*19.06±15.13*12.19±8.27* 10.68±8.40* 3.5±2.3*
2.2 SCCOJAG对去势大鼠血清雌性激素的影响
去势大鼠血清雌二醇(Estradiol,E2)减少,卵泡刺激素(Follicle-stimulating hormone,FSH)和促性腺激素(Luteinizing hormone,LH)增加;SCCOJAG可显著升高E2,降低FSH和LH,与模型组比较有统计学意义,以小剂量组作用强,作用类似乙烯雌酚组(表2)。
2.3 SCCOJAG对去势大鼠脑内NOS、ChAE、AChE的影响
去势大鼠脑内NOS、ChAE活性较低,AChE活性较高;SCCOJAG可增加脑内NOS、ChAE活性,降低AChE活性,与模型组比较有统计学意义,也以小剂量组作用明显,作用类似乙烯雌酚组(表3)。
Tab.2 Influence of SCCOJAG on serous sex hormone concentration of castrated rats(±s)
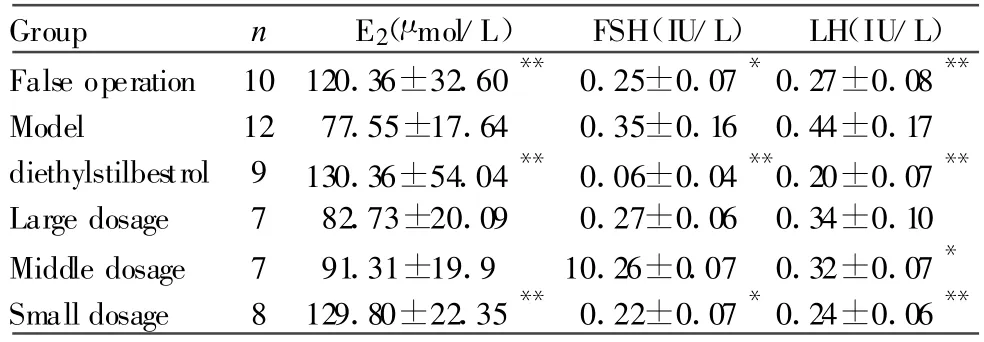
Tab.2 Influence of SCCOJAG on serous sex hormone concentration of castrated rats(±s)
E2:Estradiol;FSH:Follicle-stimulatinghormone;LH:Luteinizing hormone*P<0.05,**P<0.01 vs model group
Group n E2(μ mol/L) FSH(IU/L) LH(IU/L)False operation 10120.36±32.60** 0.25±0.07*0.27±0.08**Model 12 77.55±17.64 0.35±0.16 0.44±0.17 diethylstilbestrol 9 130.36±54.04** 0.06±0.04**0.20±0.07**Large dosage 7 82.73±20.09 0.27±0.06 0.34±0.10 Middle dosage 7 91.31±19.9 10.26±0.07 0.32±0.07*Small dosage 8 129.80±22.35** 0.22±0.07*0.24±0.06**
Tab.3 Influence of SCCOJAG on brain NOS,ChAE,and AChE activity of castrated rats(±s)

Tab.3 Influence of SCCOJAG on brain NOS,ChAE,and AChE activity of castrated rats(±s)
NOS:Nitric oxide synthase;ChAE:Choline acetyltransferase;AChE:Acetylcholinesterase*P<0.05,**P<0.01 vs model group
Group n NOS(μ mol/mg pro)ChAE(IU/g)AChE(μ mol/mg pro)False operation 107.45±3.48*225.59±57.63* 0.60±0.24*Model 124.53±2.87 183.24±31.01 0.87±0.35 diethylstilbestrol 9 8.16±4.01*276.31±99.36**0.47±0.23**Large dosage 7 5.34±3.37 201.24±46.28 0.78±0.31 Middle dosage 7 6.82±3.14 237.77±62.54* 0.58±0.22*Small dosage 8 8.76±4.32**256.31±78.05**0.41±0.26**
3 讨论
SCCOJAG缩短去势大鼠登台潜伏期,增加穿越原平台次数,提高了去势大鼠的学习记忆能力,该作用可能与其显著升高E2,降低FSH和 LH,增加脑内 NOS、ChAT活性,降低AChE活性,使脑内NO、Ach水平升高。
大鼠去卵巢后由于内源性雌激素水平下降,导致NOS神经元活性下降,NO合成减少,进而影响长时程增强效应(long-term potentiation,LTP)的形成和突触可塑性的建立,妨碍正常学习记忆行为的获得;雌激素能增加NOS的表达,刺激NO合成增加[2]。脑内Ach水平与学习记忆的增强呈量效关系,雌激素可以增加Ach的释放,增强 ChAT的活性[3],抑制AChE的活性,使脑内Ach增加,从而增强学习记忆。此机制尚不清楚,SCCOJAG可能通过体内转化或代谢转变为雌激素,也可能促进卵巢和其他腺体分泌雌激素,或作为植物雌激素而发挥作用。
SCCOJAG富含的油酸、亚油酸可以生成γ-亚麻酸,二高-γ-亚麻酸、花生四烯酸(arachidonic acid,AA)及前列腺素和白三烯等;α-亚麻酸进入体内后主要以二十碳五烯酸(eicosapntemacnioc acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)形式存在[4]。AA,EPA和DHA为脑发育和学习记忆功能所必需;AA和DHA能增加Ach的释放、参与LTP和突触可塑性的调节进而提高实验动物的学习能力;AA也可增加神经元葡萄糖的摄取,并促进记忆的形成[5];EPA等能增加细胞内Ca2+浓度,而增强LTP、记忆形成与巩固,因此SCCOJAG能增强学习记忆。
[1]邱 宏,金国琴,金如锋,等.水迷宫重复测量数据的方差分析及其在SPSS中的实现[J].中西医结合学报,2007,5(1):101-105.
[2]Kii N,Adaehi N,Liu K,et al.Acute effects of 17 betaestradiol on oxidative stress in ischemic rat striatum[J].J Neurosurg Anesthesiol,2005,17(1):27-32.
[3]Horvath K M,Hartig W,Van der Veen R,et al.17 betaestradiol enhances cortical cholinergic innervation and preserves synaptic density following excitotoxic lesions to the rat nucleus basalis magnocellularis[J].Neurosci,2002,110(3):489-504.
[4]李宝莉,朱 梅,符兆英,等.酸柏栀油软胶囊对小鼠镇静催眠促学习记忆作用的影响[J].中国老年学杂志,2012,32(8):1639-1642.
[5]Das U N.Alcohol consumption and risk of dementia[J].Lancet,2002,360(9331):490-491.

