酵母双杂交诱饵载体pGBKT7_MYC2构建及表达鉴定
刘 武,肖 牧,阮 颖,刘春林
(1湖南农业大学生物科学技术学院,长沙410128;2湖南农业大学农学院,长沙410128;3作物种质创新和资源利用国家重点实验室培育基地,长沙410128)
MYC2是一类含有helix-loop-helix(bHLH)结构域的转录因子,在拟南芥中能够激活或抑制茉莉酸 (JA)信号途径的相关基因表达[1]。Berger等[2]研究发现,MYC2 是 JAI1/JIN1(JASMONATE-INSENSITIVE1)的等位基因,能降低拟南芥植株根部对外源JA的敏感性。已有研究表明,MYC2不仅在JA信号传导途径中起着十分重要的作用[3],而且在JA信号途径与其他激素信号途径的相互作用中也起着重要的作用,能够正调控依赖于脱落酸 (ABA)途径的植物的抗旱反应以及参与由假单孢杆菌诱导的依赖于水杨酸 (SA)途径的防御反应[4]。此外,MYC2也能正调控JA或创伤反应基因VSP,LOX和TAT的表达,提高植株的抗性[1,5,6]。
但至今为止对由MYC2调控的相关基因的报道依旧很少。现已知,MYC2能负调控 PDF1.2,CHIB/PR3 和HEL/PR4 等 基 因 的 表 达[1,7],但myc2/jin1突变体植株却对一系列病原菌(Plectosphaerellacucumerina,Botrytiscinerea,Fusarium oxysporum)表现出很强的抗性。为了进一步研究MYC2因子在植物防御抗性中的作用以及其参与植物JA,SA等信号途径的作用机制,笔者利用特异性引物扩增了拟南芥植株中的MYC2基因,并以此构建了pGBKT7_MYC2酵母双杂交载体,为利用酵母双杂交技术寻找与 MYC2转录因子相互作用的蛋白及构建MYC2蛋白互作图谱打下了基础。
1 材料与方法
1.1材料
1.1.1 主要试剂
限制性内切酶PstI,SmaI,T4 DNA连接酶,PCR Mix等工具酶购自Fermentas公司;琼脂糖(Agarose)购自长沙维尔公司;LongAmp Taq DNA polymerase购自NEB公司;PMD19-T载体购自大连Takara公司;质粒提取试剂盒购自 Axygen公司;柱式 DNA胶回收试剂盒DNA、标准分子量Marker购自康维世纪公司;酵母用培养基购自Sigma公司;Western blot所需试剂购自 Millipore公司;其他常用试剂均为分析纯,购自上海国药。
1.1.2 菌株及质粒
大肠杆菌DH5,由湖南农业大学植物代谢调控实验室保存;酵母菌株 (Glod菌株)、表达载体pGBKT7、pGBKT7_CLF融合蛋白等由中国科学院上海植物生理生态研究所黄海课题组提供。
1.2方法
1.2.1 引物设计
根据Genebank上的基因序列,应用引物设计软件primer premier 5,结合酵母表达载体 pGBKT7的读框、多克隆位点,分别在上下游引物5'端插入相应的酶切位点SmaI及PstI。引物序列如下:
MYC2-F:5'- CCCGGGATGACTGATTACCGGCTACAA-3';
MYC2-R:5'-CTGCAGTTAACCGATTTTTGAAATCAAACTT- 3'。
1.2.2 诱饵载体构建示意图
载体选用pGBKT7表达载体,将克隆的MYC2全长CDS插入其多克隆位点。
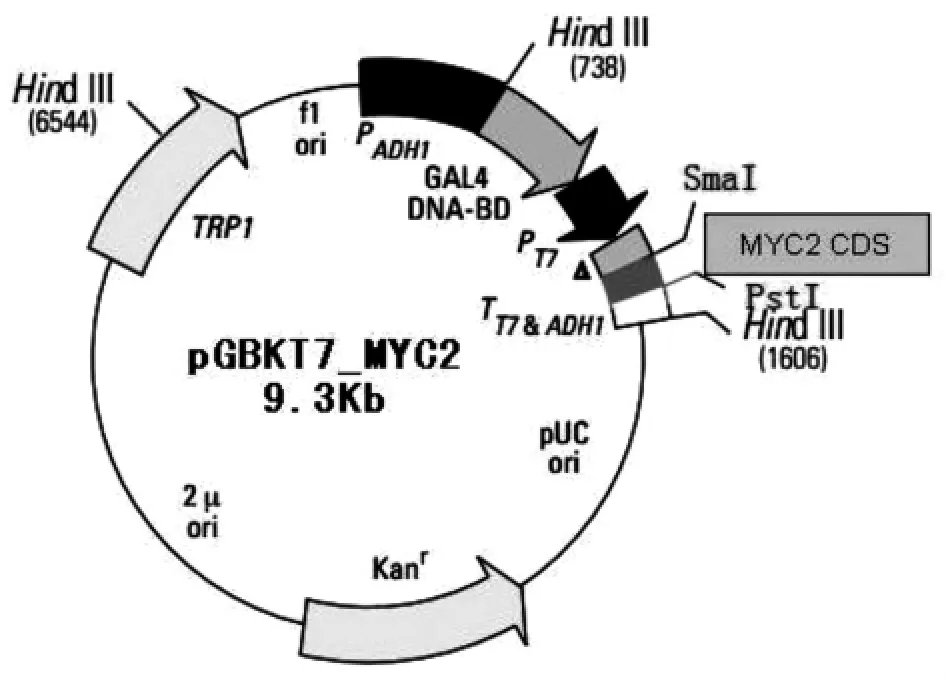
图1 pGBKT7_MYC2载体构建示意图
1.2.3 PCR扩增反应体系
反应体系总体积:30 μL;无菌超纯水:20 μL;Buffer:6 μL; 引 物 (10 μmol/L): 各 1.2 μL;long Taq(2.5 μmol/L):1.2 μL;dNTP(10 mmol/L):0.9 μL; 模板 cDNA(100 ng):1 μL(拟南cDNA)。
PCR扩增反应参数:94℃预变性30 s,94℃变性10 s,56℃退火50 s,65℃延伸90 s,共30个循环,最后65℃终延伸10 min,PCR产物4℃保存。
1.2.3 T载体连接及大肠杆菌转化
T载体连接具体操作参考Takara公司试剂盒。连接产物采用热激法转化大肠杆菌。选取菌落PCR检测为阳性的菌液,测序验证。
1.2.4 诱饵载体构建
用限制性内切酶PstI,SmaI对扩增的MYC2片段和表达载体pGBKT7进行酶切,回收基因片段和表达载体片段 (具体操作参见Fermentas公司试剂盒说明)。连接转化后,挑取阳性克隆提取质粒用双酶切鉴定。
1.3 重组质粒转化酵母菌株
1.3.1 制备酵母感受态细胞
诱饵载体转化的酵母株是Gold,采用醋酸锂转化法 (具体操作参见clontech公司酵母操作手册)。
1.3.2 转化酵母感受态细胞
将构建好的诱饵载体、鲑鱼精DNA和酵母感受态细胞混合,加入0.7 mL PEG/LiAc溶液振荡混匀。30℃振荡培养30 min,加入0.07 mL DMSO混匀,在42℃水浴15 min,冰浴10 min,离心,弃上清,以1.5 mL 1×TE重悬细胞后,铺于SD/-Trp平板。
1.4 Western blotting技术检测pGBKT7_MYC2诱饵蛋白表达
参照clontech公司的酵母手册操作,先进行酵母蛋白的提取。提出蛋白后,进行SDS-PAGE电泳,湿转100 V,1.5 h,封闭后加一抗 (c-myc)过夜,二抗 (羊抗鼠,1 h),洗涤后采用化学发光法检测目的蛋白条带。
2 结果与分析
2.1 拟南芥MYC2基因的PCR扩增
根据引物的退火温度,设计温度梯度PCR,确定最佳的退火温度为60℃。以60℃为退火温度进行PCR扩增,扩增出了1 880 bp左右的条带,扩增片段大小与预期大小一致 (图2)。

图2 longAmp酶扩增得到MYC2全长CDS
2.2 MYC2全长CDS片段连T-Vector及转化大肠杆菌DH5α

图3 菌落PCR检测阳性菌落
将扩增出的1 880 bp左右的目的带进行切胶回收,用T4连接酶将回收片段连接到pMD19-T载体,热激法转化大肠杆菌DH5的感受态细胞,取100 mL菌液涂到LB固体培养基上 (含有氨苄青霉素50 g/mL)生长,随机挑选数个单菌落进行PCR检测 (图3),以获得阳性克隆。
挑选验证正确后的克隆测序,测序结果显示去除酶切位点后序列长度为1 872 bp,与已发表的拟南芥MYC2全长CDS的序列一致,所克隆的序列是目的基因的全长CDS序列。
2.3 诱饵蛋白载体酶切检测
将测序正确的MYC2片段与酵母双杂交诱饵载体pGBKT7经PstI,SmaI双酶切后,用T4连接酶连接,构建酵母双杂交诱饵载体pGBKT7_MYC2。将连接产物转化大肠杆菌得到阳性克隆后,进行酶切验证 (图4),结果显示出现了约1 880 bp的目的片段。

图4 pGBKT7_MYC2质粒酶切结果
2.4 诱饵蛋白载体转化酵母菌
将经过酶切验证正确后的pGBKT7_MYC2诱饵蛋白表达载体转化到宿主菌Glod菌中,热激转化后将转化液均匀涂抹于 SD/-Trp培养基上,30℃培养2~3 d后,观察平板上酵母菌的生长情况。(图5)

图5 含目的蛋白重组质粒的Gold菌在SD/-Trp上的生长情况
2.5pGBKT7_MYC2诱饵蛋白表达载体自激活检测
将pGBKT7_MYC2质粒与pGADT7空质粒共转酵母Glod先后在SD/-LT和SD/-HLTA上进行筛选,发现仅对照组长出了正常菌落 (图6),表明pGBKT7_MYC2诱饵蛋白表达载体不存在自激活。

图6 pGBKT7_MYC2载体的酵母自激活检测结果
2.6pGBKT7_MYC2诱饵蛋白的表达
通过Western blotting分析表达质粒pGBKT7_MYC2融合蛋白的表达情况 (图7),经化学发光后显影,可见约70 000的特异性条带,大小与预期结果一致,说明pGBKT7_MYC2质粒能够在Gold菌中稳定表达。
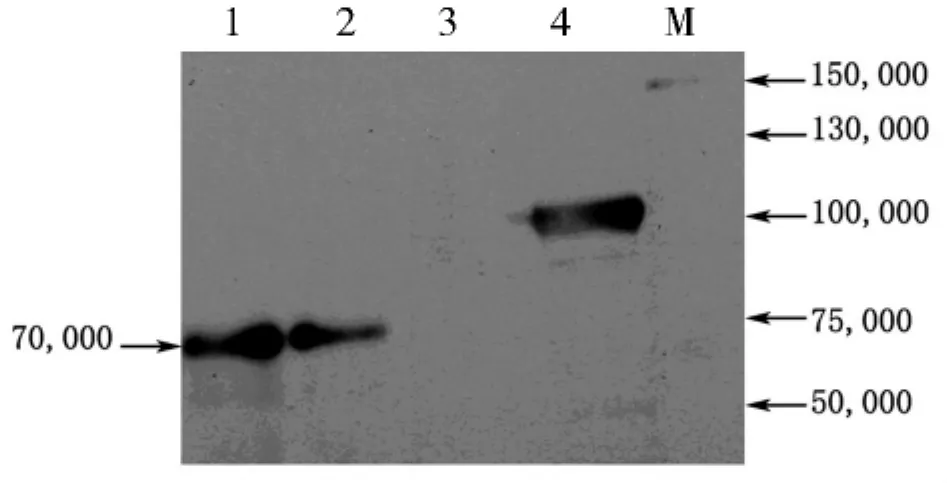
图7 诱饵质粒表达蛋白Western blotting检测结果
3讨论
植物在受到各种生物性胁迫以及非生物性胁迫后,会释放出水杨酸、茉莉酸、乙烯 (ethylene,ET)和脱落酸等信号分子[8],其中茉莉酸类物质不仅能使植物针对生物性胁迫以及非生物性胁迫做出特异性反应,还对植物的生长和发育有重要的调控作用[9~12]。对茉莉酸途径的研究发现,MYC2基因是茉莉酸信号途径中的关键组分之一[13,14]。虽然MYC2基因不能调控所有JA介导的信号途径分支,却是已知的唯一一个JAZ抑制子的靶标基因[15,16]。
酵母双杂交系统是一种具有高灵敏度的研究蛋白之间相互作用的技术[17]。根据酵母基因转录的特性,将编码DNA-BD的基因与已知蛋白质Bait protein的基因构建在同一个表达载体上,将编码AD的基因和cDNA文库的基因构建在AD-LIBRARY表达载体上,当上述两种载体所表达的融合蛋白能够相互作用时,功能重建的反式作用因子能够激活酵母基因组中的报告基因。
本实验利用基因重组的技术将从拟南芥中克隆到的MYC2全长CDS构建到酵母表达载体pGBKT7中,构建了一个可用于下一步酵母筛库所需的诱饵蛋白载体,为以后进行酵母筛库以及酵母双杂交获得MYC2蛋白的互作因子以及了解MYC2蛋白的调控网络奠定了试验基础,有利于进一步了解MYC2蛋白以及JA信号网络在植物中的调控机制。
[1]Lorenzo O,Chico JM,Sanchez-Serrano JJ,et al.Jasmonate-insensitive 1 encodes a MYC transcription factor essential to discriminate between different jasmonate-regulated defense responses inArabidopsis[J].Plant Cell,2004,16:1938 -1950.
[2]Berger S,Bell E,Mullet JE.Two methyl jasmonate -insensitive mutants show altered expression of AtVSP in response to methyl jasmonate and wounding [J].Plant Physiol,1996,111:525 -531.
[3]Lorenzo O,Solano R.Molecular players regulating the jasmonate signalling network [J].Curr Opin Plant Biol,2005,8:532-540.
[4]Laurie-Berry N,Joardar V,Street IH,et al.TheArabidopsis thalianajasmonate insensitive 1 gene is required for suppression of salicylic acid–dependent defenses during infection byPseudomonas syringae[J].Plant Microbe Interact,2006,19:789-800.
[5]Boter M,Ruiz-RiveroO,Abdeen A,et al.Conserved MYC transcription factors play a key role in jasmonate signaling both in tomato andArabidopsis[J].Genes Dev,2004,18:1577-1591.
[6]Abe H,Urao T,Ito T,et al.ArabidopsisAtMYC2(bHLH)and AtMYB2(MYB)function as transcriptional activators in abscisic acid signaling [J].Plant Cell,2003,15:63 -78.
[7]Anderson JP,Badruzsaufari E,Schenk PM,et al.Antagonistic interaction between abscisic acid and jasmonate-ethylene signaling pathways modulates defense gene expression and disease resistance inArabidopsis[J].Plant Cell,2004,16:3460 -3479.
[8]Pichersky E,Gershenzon J.The formation and function of plant volatiles:Perfumes for pollinator attraction and defense [J].Curr Opin Plant Biol,2002,5:237 -243.
[9]Balbi V,Devoto A.Jasmonate signaling network inArabidopsis thaliana:Crucial regulatory nodes and new physiological scenarios [J].New Phytol,2008,177:301-318.
[10]Browse J,Howe GA.New weapons and a rapid response against insect attack [J]. Plant Physiol,2008,146:832-838.
[11]Chico JM,Chini A,Fonseca S,et al.JAZ repressors set the rhythm in jasmonate signaling [J].Curr Opin Plant Biol,2008,11:486-494.
[12]Wasternack C.Jasmonates:An update on biosynthesis,signal transduction and action in plant stress response,growth and development[J].Ann Bot(Lond) ,2007,100:681-697.
[13]Lorenzo O,Chico JM,Sanchez-Serrano JJ,et al.Jasmonate insensitive 1 encodes a MYC transcription factor essential to discriminate between different jasmonate-regulated defense responses inArabidopsis[J].Plant Cell,2004,16:1938 -1950.
[14]Boter M,Ruiz-Rivero O,Abdeen A,et al.Conserved MYC transcription factors play a key role in jasmonate signaling both in tomato andArabidopsis[J].Genes Dev,2004,18:1577-1591.
[15]Heim MA,Jakoby M,Werber M,et al.The basic helix-loop-helix transcription factor family in plants:A genome-wide study of protein structure and functional diversity[J].Mol Biol Evol,2003,20:735-747.
[16]Toledo-Ortiz G,Huq E,Quail PH.TheArabidopsisbasic helix-loop-helix transcription factor family[J].Plant Cell,2003,15:1749 -1770.
[17]Coates PJ,Hall PA.The yeast two hybrid system for identifying Protein - protein interactions[J].Pathol,2003,1:4-7.

