小麦植株和麦田土壤莠去津残留气相色谱分析方法研究
李广领, 田雪亮, 王建华, 管文芳, 刘英杰, 陈锡岭
(河南科技学院,新乡 453003)
小麦植株和麦田土壤莠去津残留气相色谱分析方法研究
李广领, 田雪亮, 王建华, 管文芳, 刘英杰, 陈锡岭*
(河南科技学院,新乡 453003)
本研究确立了乙腈振荡提取、弗罗里硅土SPE小柱净化小麦植株和麦田土壤中莠去津残留样本的前处理方法,建立了柱程序升温、GC-NPD残留样品检测方法。结果表明,优化色谱条件下,莠去津的色谱保留时间为5.97min,在0.105~54.0mg/L浓度范围内,莠去津浓度与其色谱峰面积在GC-NPD上线性响应良好,回归方程为Y=38.79X-120.34(R2=0.998 8)。莠去津在小麦植株和麦田土壤中0.05~1mg/kg的3个水平的加标回收率均大于75%,各添加水平3次平行测定值的RSD均小于7%。其准确度和精密度均符合农药残留分析的要求。该色谱条件下仪器的最低检出量为0.38ng,方法的最低检出浓度为0.018mg/kg(植株)和0.021mg/kg(麦田土壤),此检测灵敏度可以满足该农药在小麦植株和麦田土壤中残留的定量检测要求。
莠去津; 小麦植株; 麦田土壤; 气相色谱法; 残留分析
莠去津(atrazine),又名阿特拉津,是瑞士Geigy公司于1952年成功研发的三嗪类除草剂,适用于玉米、高粱、果园和林地等防除一年生禾本科杂草和阔叶杂草,对一些多年生杂草也有一定的抑制使用[1],是目前世界上广泛使用的选择性内吸传导型芽前及苗后除草剂,该除草剂主要通过干扰植物光合作用而使杂草致死[2]。莠去津结构稳定、水溶性强、难降解,且其在土壤中存留时间与土壤有机质含量呈正相关关系[3]。另外,作为一种当前大面积应用的除草剂,不论是莠去津的母体化合物还是其代谢产物对自然环境、人类和动植物生长均具有明显的毒理学效应,目前,其污染效应已成为全球性的生态问题[4]。研究发现,莠去津具有生物蓄积性和环境激素的作用,可影响生物体正常的性别分化和性腺发
育[5-7],被联合国环境规划署(UNEP)于2006年认定为27种持久性有毒化学污染物(persistent toxic substances,PTS)之一[8]。莠去津易于被土壤有机质吸附[9],在土壤中的持留期长[10]。因此,施用过莠去津后的后茬作物非常容易受药害。一直以来,使用莠去津而引起的后茬作物药害事件频繁发生,因此,在人均耕地日渐减少和作物复种植数不断提高的今天,合理使用该农药、减少或避免其对后茬作物的药害是一个值得关注的问题。有关莠去津残留的现代分析方法,主要包括气相色谱法[11-13]、液相色谱法[14-15]、色谱与质谱联用 技 术[16-18]、免疫分析技术法[19-23]、电 化 学 和 生 物 传 感 器 技 术[24-25]等。其中的分析样品制备技术涵盖了液液萃取、固相萃取、基质固相分散萃取和微波辅助提取等。目前,麦田土壤和小麦植株中莠去津残留的气相色谱分析尚未见文献报道。本研究对麦田土壤和小麦植株中莠去津残留的样本前处理程序和GC-NPD检测方法进行了研究,旨在为麦田土壤和小麦植株莠去津残留测定提供技术支持,同时也为玉米小麦连作区科学使用该除草剂防除玉米田杂草提供理论依据。
1 材料和方法
1.1 仪器设备
Clarus-500GC-NPD(美 国 Perkin Elmer 公司),MTN-2800D氮吹浓缩装置(天津奥特赛恩斯仪器有限公司),TA2004N万分之一分析天平(上海精密科学仪器有限公司),RE-52旋转蒸发器(上海亚荣生化仪器厂),BS-1EA振荡培养箱(金坛市杰瑞尔电器有限公司),ASE-12固相萃取装置(天津奥特赛恩斯仪器有限公司)等。
1.2 试剂与材料
石油醚、丙酮、乙腈、氯化钠、无水硫酸钠等为天津科密欧化学试剂公司产品,均为A.R级;丙酮(色谱纯)为天津赛孚科技有限公司产品;莠去津(纯度99.9%)为美国BBI公司产品;弗罗里硅土SPE小柱(200mg/3mL),购于大连思谱精工有限公司。麦田土壤(3年内无莠去津施药背景,壤质土,土壤pH=8.1,有机质含量1.463%,全氮含量0.107%,速效磷含量44.1mg/kg,速效钾含量148.2mg/kg,含水量84.3%)和分蘖期小麦植株样品,采自于河南省农业科学院农业高科技示范园区试验田。
1.3 试验方法
1.3.1 气相色谱条件建立
以SUBTM-5毛细管柱(15m×0.25mm、1μm涂膜厚度)为分析柱,NPD为检测器。分别设置进样口、色谱柱、检测器各部分温度和载气流速等多组参数组合,以合适浓度的莠去津标准溶液进样,逐步优化色谱条件,确定最佳色谱分离、分析条件。
1.3.2 样品添加回收率试验
将从试验田中采集的小麦植株样品剪成约0.5cm长的小段;麦田土壤样品首先于实验室自然风干,过60目分样筛;将植株样品和土壤样品分别混匀,并分别准确称取4份各10.0g,其中的3份分别按0.05、0.5mg/kg和1mg/kg的添加水平添加莠去津标准样品得到模拟残留样本,在各份残留样本中分别加入50mL乙腈,室温振荡提取30min后减压抽滤,然后在滤液中加入10mL饱和氯化钠溶液萃取,萃取有机相用无水硫酸钠干燥后减压浓缩至近干,用丙酮定容至1mL。再将样品提取液上弗罗里硅土小柱,以适当体积比的石油醚/丙酮淋洗,洗脱液经氮吹浓缩装置浓缩后,用丙酮定容至1mL,再优化色谱条件进样分析。最后用PerkinElmerRChromatography Software Total-chrom Workstation处理谱图数据,根据加标量和检测值分别计算添加回收率和3次平行测定值的相对标准偏差。另外的一份小麦植株样品和土壤样品按与上述完全相同的前处理程序处理得空白样品,用于明确样品基质。
1.3.3 实际样品检测
将从大田采集的莠去津小麦土壤样品按添加回收率试验完全相同的样品前处理程序处理,得样品检测溶液,在优化色谱条件下进样分析,得检测结果。
2 结果与分析
2.1 供试农药的GC-NPD分析条件
图1为优化色谱条件下莠去津色谱图。试验发现,设置色谱柱温度程序:初温120℃(保持1min),以30℃/min升至180℃(保持1min),再以25℃/min升至230℃(保持2min),再以25℃/min升至280℃(保持1min);进样口285 ℃,检测器300 ℃;FN2=2mL/min、FH2=2mL/min、Fair=100mL/min,分流比9∶1,尾吹气流速为30mL/min,以1μL为进样量,经SUBTM-5型柱分离NPD检测可得图1所示莠去津稳定的出峰效果。
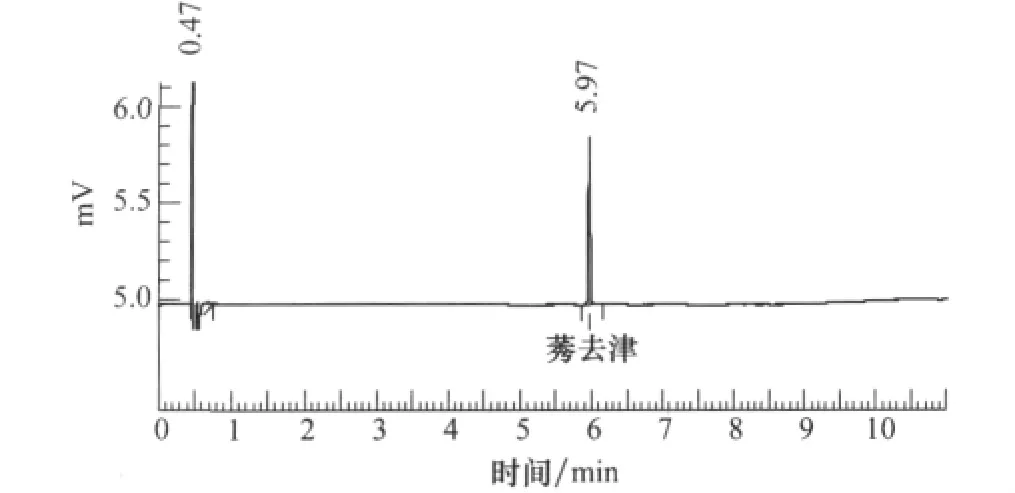
图1 优化色谱条件下莠去津标准样品的色谱图
2.2 莠去津标准样品在GC-NPD上的线性范围
将莠去津标准样品分别稀释为0.105、0.211、0.422、0.844、1.688、3.375、6.75、13.5、27.0mg/L和54.0mg/L 10个浓度,按2.1中色谱条件对系列浓度样品分别进样1μL,分别重复3次进样,得对应色谱图,以峰面积(3次重复的平均值)为纵坐标,以进样浓度为横坐标进行线性回归,得莠去津在1.05~512mg/L浓度范围内进样量与检测器响应值良好的线性响应关系,线性回归方程为y=38.79x-120.34(R2=0.998 8)。
2.3 添加回收率和最低检测浓度
图2和图3分别为小麦植株空白样本和其莠去津添加色谱图,图4和图5分别为土壤空白样本和其莠去津添加色谱图。
从表1添加回收率可以看出,经乙腈振荡提取、以5mL体积比为3∶2的石油醚/丙酮为淋洗液过弗罗里硅土SPE小柱净化,由GC-NPD检测得到的莠去津在小麦植株和麦田土壤中各添加水平的回收率均在75%以上,3次重复测定值的相对标准偏差均小于7%,说明方法的重复性良好。该色谱条件下仪器的最小检出量为0.38ng,方法的最低检出限为0.018mg/kg(植株)和0.021mg/kg(麦田土壤),此检测灵敏度可以满足该农药在小麦植株及麦田土壤中莠去津残留定量检测要求。
2.4 实际样品检测
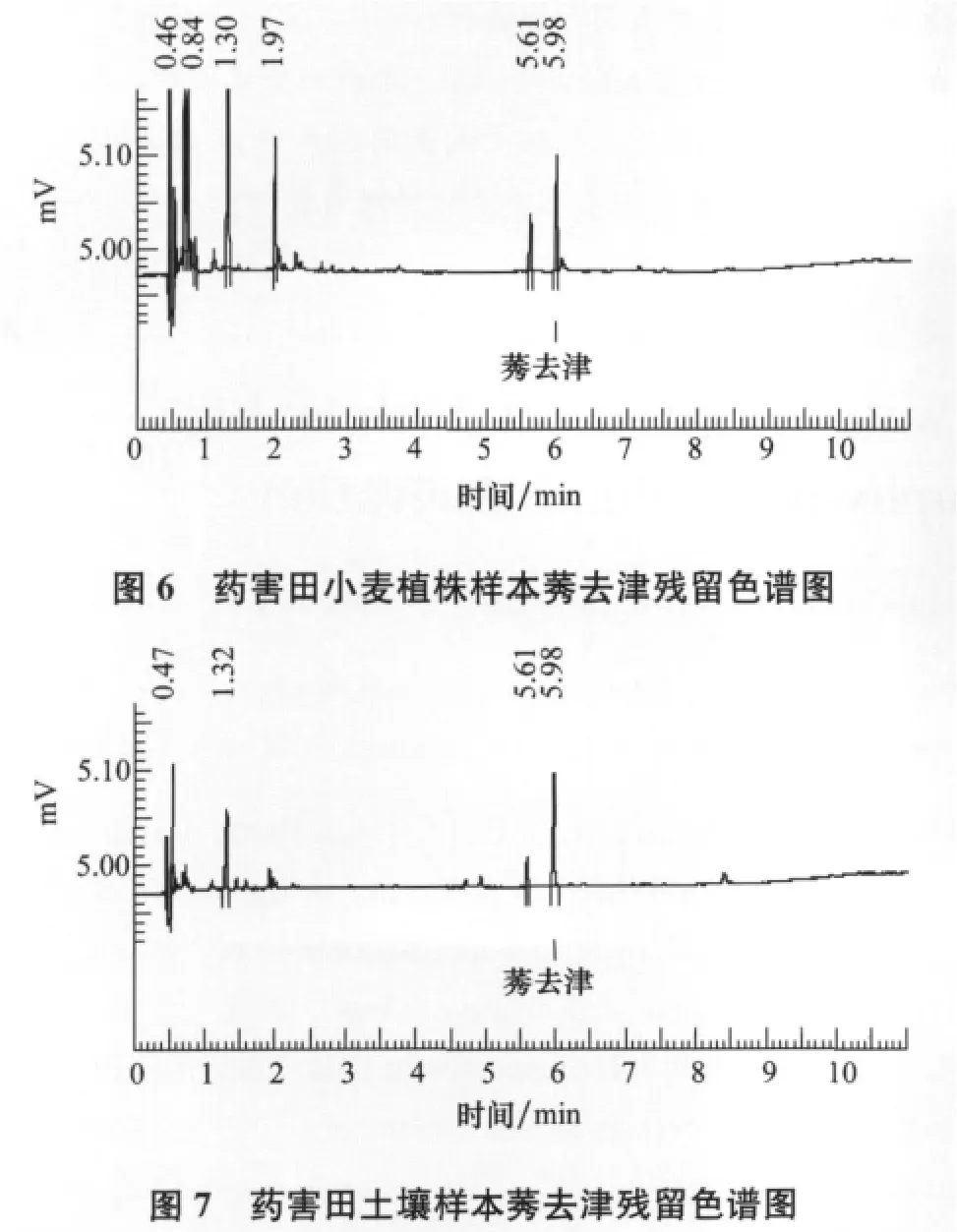
图6和图7为药害田采集小麦植株样本和土壤样本试验条件下检测到的莠去津残留色谱图。
从图6、7可以看出,田间采集的药害田小麦植株样本和麦田土壤样本中均检测出了一定水平的莠去津残留,色谱图经数据处理系统处理得小麦植株样本中的莠去津残留量为0.035mg/kg,麦田土壤样本中莠去津残留量为0.042mg/kg。
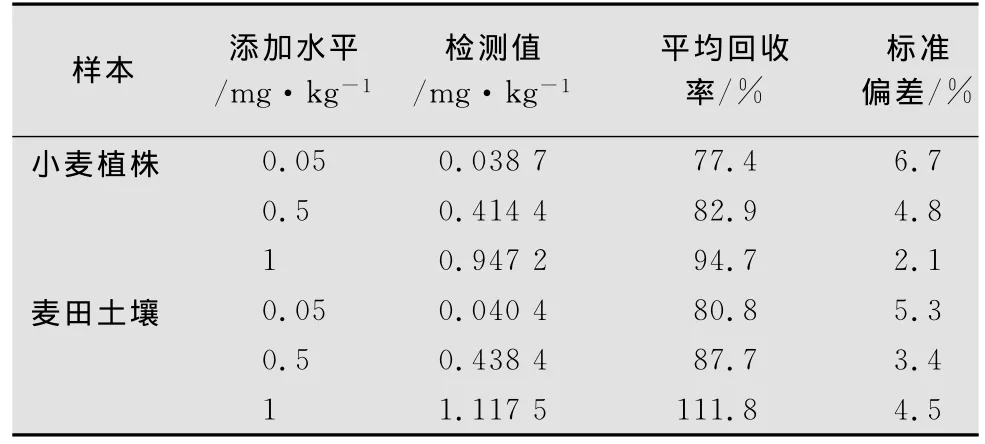
表1 莠去津在小麦植株和麦田土壤中的添加回收率和精密度
3 结论与讨论
本文采用乙腈振荡提取、弗罗里硅土SPE样品净化方法,GC-NPD检测方法分析了小麦植株及土壤中莠去津残留量,该方法重现性好、检测灵敏度高、实用性强。试验证明该残留样本前处理方法简便,且提取效率高;所建立GC-NPD分析方法线性范围宽、重复性好、检测限低,可以满足小麦植株及土壤样本中莠去津残留量的分析检测要求,该方法为莠去津在小麦植株中的残留试验提供了可靠方法,同时也为莠去津防除玉米田杂草的安全剂量确定提供了更为全面、客观、科学的理论依据。
[1]Solomon K R,Baker D B,Richards R P,et al.Ecological risk assessment of atrazine in north American surface waters[J].Toxicological Environmental Chemistry,1996,15(1):31-76.
[2]Nriagu J O,Pacyna J M.Quantitative assessment of world wide contamination of air,water and soils by trace metals[J].Nature,1988(333):134-139.
[3]Assaf N A,Turco R F.Influence of carbon and nitrogen application on the mineralization of atrazine and its metabolites in soil[J].Pesticide Science,1994,41:41-47.
[4]聂果,吴春先,高立明,等.莠去津的生态毒理学及其环境行为学研究进展[J].现代农药,2007,6(4):32-37,54.
[5]Stoker T E,Laws S C,Guidici,et al.The effects of atrazine on puberty in male wistar rats:an evaluation in the protocol for assessment of pubertal development and thyroid function[J].Toxicological Sciences,2000,58(1):50-59.
[6]Hayes T,Kelly H,Tsui M,et al.Herbicides:feminization of male frogs in the wild[J].Nature,2002,419(6910):895-896.
[7]Tyrone B,Vicky K,Anne N,et al.Atrazine induces complete feminization and chemical castration in male African clawed frogs(Xenopuslaevis)[J].PNAS,2010,107(10):4612-4617.
[8]楚敬杰,张世秋,徐小梅.《斯德哥尔摩公约》的实施进展及相关国际活动研究[J].安全与环境学报,2004,4(S1):58-61.
[9]秦传玉,赵勇胜,刘娜,等.阿特拉津在土壤中的吸附行为[J].环境污染与防治,2007,29(3):165-167.
[10]Demon M,Schiavon M,Portal J M,et al.Seasonal dynamics of atrazine in three soils under out door conditions[J].Chemosphere,1994,28(3):453-466.
[11]张威,王庆海,张国安,等.气相色谱法测定水生植物中的阿特拉津残留[J].分析科学学报,2011,27(1):125-127.
[12]朱莉萍,董静,孙军,等.分散型固相萃取-气相色谱法测定蔬菜及其制品中灭线磷、嘧霉胺、莠去津、氟硅唑、噻嗪酮、异丙威残留量[J].分析试验室,2008,27(8):79-82.
[13]李晶,董丰收,刘新刚,等.基质固相分散萃取-气相色谱法同时检测人参中五氯硝基苯及其代谢物残留[J].农业环境科学学报,2009,28(1):216-220.
[14]祁彦,占春瑞,张新忠,等.高效液相色谱法测定大豆中13种三嗪类除草剂多残留量[J].分析化学,2006,34(6):787-790.
[15]林琳,王海,张海燕,等.微波提取-高效液相色谱法测定土壤中痕量阿特拉津[J].中国卫生检验杂志,2009,19(11):2560-2561,2585.
[16]陈砚朦,钟淑婷,甘凤娟,等.超高效液相色谱/串联质谱分析生活饮用水中莠去津和灭草松[J].中国卫生检验杂志,2008,18(4):590-592.
[17]王国强,朱昱,齐宝坤,等.固相萃取-硅烷化-气质联用分析尿中莠去津及其去烃基代谢物[J].分析化学,2009,37(3):441-444.
[18]Antignac J P,de Wasch K,Monteau F,et al.The ion suppression phenomenon in liquid chromatography-mass spectrometry and its consequences in the field of residue analysis[J].Analytica Chimica Acta,2005(529):129-136.
[19]胡晓航,王皙玮,吴玉梅,等.酶联免疫法测定土壤中莠去津[J].中国糖料,2011(1):28-30.
[20]邓安平,杨红,Milan F.酶联免疫吸附分析法测定土壤试样中的阿特拉津[J].分析化学,1999,27(6):657-660.
[21]徐德武,杨根海,秦凤琴,等.用放射免疫测定法分析土壤中莠去津残留量的研究[J].核农学报,1998,12(5):309-313.
[22]徐德武,朱永清,杨根海,等.用放射免疫测定法分析水中莠去津残留量的研究[J].青岛农业大学学报(自然科学版),2000,17(3):225-228.
[23]Giersch T.A new monoclonal antibody for the sensitive detection of atrazine with immunoassay in micro titer plate and dipstick format[J].Journal of Agricultural and Food Chemistry,1993,41:1006-1011.
[24]曹巧玲,高志贤,张俊明,等.阿特拉津抗体芯片制作条件的优化[J].解放军预防医学杂志,2007,25(6):409-411.
[25]张智慧,应淑华,史汶灵,等.一种新型的检测阿特拉津的酪氨酸酶传感器的研制[J].化学传感器,2010,30(3):35-40.
Residue analysis methods of atrazine in wheat plants and wheat field soils by GC-NPD
Li Guangling, Tian Xueliang, Wang Jianhua, Guan Wenfang, Liu Yingjie, Chen Xiling
(HenanInstituteofScienceandTechnology,Xinxiang453003,China)
A method for determination of atrazine residue in wheat plants and wheat field soils has been developed by extraction with acetonitrile,purification with SPE cartridge and determination with GC-NPD.The results showed that,under the optimal conditions,the retention time of acetamiprid was 5.97 minutes;the calibration curves showed good linearity(y=-38.79x-120.34,R2=0.998 8)at 0.105-54.0mg/L of atrazine.The recovery rates were determined in wheat field soil blank spiked at 0.05 mg/kg,0.5 mg/kg and1 mg/kg,respectively,and the overall recovery rates were over 75%,with a relative standard deviation(RSD)less than7%.The detection limit of acetamiprid was 0.38 ng,and the limit of quantification was 0.018 mg/kg and 0.021 mg/kg in wheat plants and wheat field soils,respectively.The results indicated that the method is simple,efficient and reliable,and it’s suitable for the determination of atrazine residues in wheat field soils.
atrazine; wheat plant; wheat field soil; gas chromatography; pesticide residue analysis
TQ 450.263
A
10.3969/j.issn.0529-1542.2012.05.018
2012-01-11
2012-03-07
公益性行业(农业)科研专项(200803002-6)
* 通信作者E-mail:chenxiling@hist.edu.cn

