南瓜花叶病毒胶体金免疫层析试纸条的研制
梁新苗, 边 勇, 邓丛良, 李桂芬, 周 琦, 汪万春
(1.北京出入境检验检疫局,北京 101312;2.中国检验检疫科学研究院动植物检疫研究所,北京 100029)
南瓜花叶病毒胶体金免疫层析试纸条的研制
梁新苗1*, 边 勇1, 邓丛良1, 李桂芬2, 周 琦1, 汪万春1
(1.北京出入境检验检疫局,北京 101312;2.中国检验检疫科学研究院动植物检疫研究所,北京 100029)
使用柠檬酸三钠还原法制备25nm粒径的胶体金颗粒,在pH7.6,蛋白用量13μg/mL条件下,制备形成稳定胶体金蛋白复合物;使用微定量喷头在硝酸纤维素膜上喷好病毒检测线和质控线,组装制成免疫层析检测试纸条。结果表明经过条件优化后制备的南瓜花叶病毒试纸条特异性好,可在10min内检测出结果,且对南瓜花叶病毒阳性材料的检测灵敏度可达到稀释104倍。
南瓜花叶病毒; 胶体金免疫层析; 检测试纸条
南瓜花叶病毒(Squashmosaicvirus,SqMV)为豇豆花叶病毒属(Comovirus)成员,主要危害黄瓜、甜瓜、西葫芦、哈密瓜等葫芦科植物,受侵染的植物出现环斑,严重的出现水泡状斑点,有的出现叶绿素分布不均,叶面出现黄斑或深浅相间斑驳花叶,有时沿叶脉叶绿素浓度增高,形成深绿色相间带,严重的致叶面呈现凹凸不平,脉皱曲变形。病情严重时,茎蔓和顶叶扭缩,果实染病出现褪绿斑。开花结果后病情趋于加重,影响寄主植物品质及产量。该病毒可通过种子、汁液接触传播和昆虫介体传播。在对该病毒的防治过程中,既需要进行准确检测,又需要田间快速诊断。本文以此为出发点,利用胶体金免疫层析技术[1],制备了具有简便、快速、灵敏度高等特点的南瓜花叶病毒检测试纸条,以适应基层工作的实际需求。
1 材料与方法
1.1 病毒来源
由中国农业科学院郑州果树研究所提供。
1.2 病毒繁殖
1g病毒阳性材料加入适量接种缓冲液后,在研钵中磨碎,取研磨液,于西葫芦幼苗的两片子叶完全展开时进行摩擦接种,接种完毕后用蒸馏水冲洗。待出现明显危害症状后,取显症状叶片备用。
1.3 病毒抗体制备
用纯化病毒制剂免疫家兔,共免疫4次,每次0.25mg病毒,后腿肌肉注射。第1次免疫用弗氏完全佐剂乳化,第2、3、4次免疫用弗氏不完全佐剂乳化。每次免疫间隔一周。第4次免疫后一周耳静脉采血测效价[2]。
1.4 胶体金的制备[3-6]
采用柠檬酸三钠还原法制备胶体金颗粒,参考魏梅生等[3]的方法,步骤如下:
(1)取0.01%氯金酸溶液100mL加热煮沸;
(2)37℃预温1%柠檬酸钠,取1.5mL,快速一次加入氯金酸溶液中,溶液由蓝逐渐变为红色,煮沸3~5min;
(3)冷却后,用0.22μm滤膜过滤去除杂质,4℃保存备用;
(4)在530nm下测定吸光值,检测胶体金制备质量,吸光值应在0.8~1.2之间。
(5)或进行镜检。如出现粒子体积偏差太大,粒子凝聚,粒子边缘不清晰等问题,须重新制备。
1.5 金标抗体的条件优化及制备[7-8]
1.5.1 最适pH的确定
采用倪同浩等[7]报道的方法,具体如下:
(1)取若干个1.5mL试管,分别加入1mL所制备的胶体金;
(2)用0.1mol/L K2CO3分别添加10μL,20μL……100μL;
(3)取一96孔培养板,按pH从低到高分别将上述胶体金取100μL加入孔中,重复3次;
(4)每孔分别加入3μL浓度为1mg/mL的抗体,混合,室温下放置10~15min;
(5)每孔分别加入20μL浓度为10%NaCl溶液,混合,室温下放置10min;
(6)观察胶体金颜色变化,记录保持红色的最低pH;
(7)观察胶体金颜色变化直到室温下放置2h,记录仍保持红色的最低pH。
(8)以最低pH增加0.5为最适pH。
1.5.2 胶体金与抗体配比量的确定
(1)用0.22μm微孔滤膜过滤或高速离心去除蛋白中残物或多聚体;
(2)取一96孔滴定板,每个重复为若干个孔,分别加入最佳pH的胶体金100μL,重复3次;
(3)各孔依次加入不同量的蛋白(浓度为0.1mg/mL)1~20μL,混匀,室温下放置15min;
(4)加入20μL 10%NaCl,室温下放置10min;
(5)颜色仍保持红色的最小蛋白用量即最小蛋白浓度;
(6)为确保结果准确性,可放大反应体积重复以上步骤;
(7)确定最小浓度后,按照最小浓度的130%为最佳浓度。
1.5.3 金标抗体的制备
(1)取50mL所制备的胶体金;
(2)加入适量25mmol/L K2CO3调整pH 至最适浓度;
(3)加入最适浓度的抗体,混匀,室温放置10min;
(4)加入10%聚乙二醇(PEG20000)1mL(终浓度为0.2%),室温放置5min;
(5)14 000r/min离心20min,小心吸除上清;
(6)沉淀溶于5mL保存液,加5mL稀释液溶解为絮状物;
(7)4℃保存备用。
1.6 检测试纸条的制作
1.6.1 金标垫的制备
取3mL胶体金一抗体结合物,加3mL稀释液混匀。放入玻璃纤维素纸浸泡10min,取出置37℃烤箱中烤干,热合封口,置4℃冰箱备用。
1.6.2 NC膜的制备
(1)将病毒抗体和羊抗兔抗体用固相缓冲液分别稀释,终浓度为2mg/mL和2.5mg/mL;
(2)在三维喷点平台上,将两种抗体均匀地平行喷在硝酸纤维素膜上,分别为T线和C线,两线间隔5mm;
(3)室温条件下自然风干;
(4)在0.1%BSA封闭液中封闭1h;
(5)将NC膜在洗涤液中洗涤2次,每次5min;
(6)室温条件下自然风干。
1.6.3 试纸条的组装
(1)在双面胶塑料板中央黏附抗体固相硝酸纤维素膜;
(2)在双面胶塑料板T线一侧黏附金标抗体结合物玻璃纤维素纸条带,并与抗体固相膜重合2mm,再粘贴一层胶带;
(3)同样在C线一侧黏附吸水纸,也与抗体固相膜重合2mm,粘贴一层胶带;
(4)用BioDotCM4000切条机切成4mm宽的试纸条。
1.7 试纸条的检测方法
将有胶体金复合物的一端插入离心后的检测样品液中,10min左右判断结果。若试纸条仅质控C线出现紫红色线而检测T线未显色,结果为阴性;若试纸条上C线和T线均出现紫红色,结果为阳性;若试纸条C线和T线都没有显色,则说明此试纸条已经失效,结果无效。
1.8 试纸条的质量检测
1.8.1 特异性试验
分别取携带南瓜花叶病毒、西瓜花叶病毒、黄瓜绿斑驳花叶病毒、小西葫芦黄花叶病毒的发病叶片按1∶10(W/V)加入PBS缓冲液,用研钵研磨成浆,2 000r/min离心10min,上清即为制备好的检测样品。将金标试纸条插入上述溶液中,取出后观察,按照1.7的方法进行判断。每种病毒3个重复。
1.8.2 灵敏度试验
取检测样品,分别稀释101倍、102倍、103倍、104倍、105倍、106倍、107倍、108倍,进行灵敏度比较,测试方法同1.8.1。
1.8.3 稳定性试验
将包被抗原抗体的免疫胶体金层析条用塑料袋密封,加入干燥剂,分别置于4、37℃、室温(20~25℃)条件下,其中置于4℃和室温条件的试纸条每隔7d取出3条,置于37℃的每天取出3条,分别检测阴性样本和阳性样本。观察检测线的有无、颜色深浅及玻璃纤维素膜上金标抗体的释放程度。4℃和室温条件下的保存试验持续4周,37℃条件下保存试验持续7d。
2 结果
2.1 最适pH
在96孔板上依次加入NaCl后,在1号~4号孔为浅蓝色,5号、6号孔为过渡色,7号~9号孔为红色,因此最低pH为7号管,使用精密试纸测量其pH为7.1,因此最适pH为7.6。见图1。
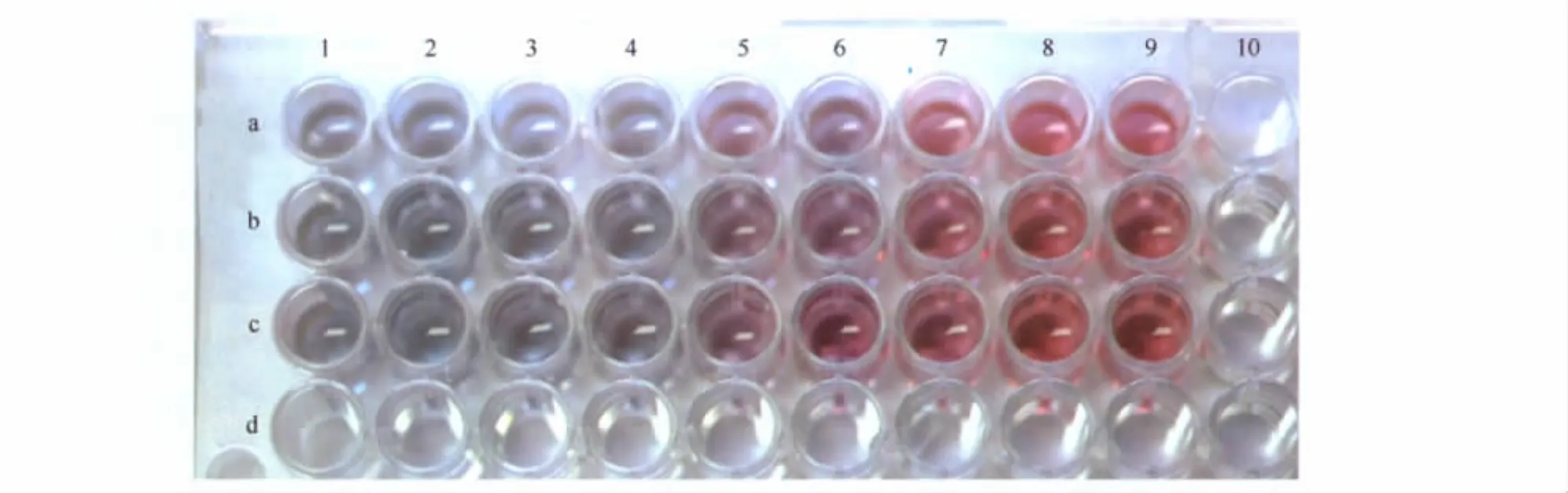
图1 最适pH测试
2.2 胶体金与抗体配比量
由于胶体金为带负电的疏水性颗粒,在未结合蛋白或结合不足时,加入NaCl后,由于盐离子效应,使胶体金颗粒的性质发生变化,从而出现由红变蓝的聚沉现象。因此可以通过加入不同量的抗体蛋白,来确定最小抗体配比量,进而确定最适抗体用量。结果如图2,在96孔板上按照不同抗体用量进行比较后,在1号~5号孔为浅蓝色,6号、7号孔为过渡色,8号~9号孔为红色,因此胶体金与抗体的最适配比为8号管,即当每1mL胶体金溶液中抗体量等于或大于10μg/mL时,胶体金抗体蛋白结合物的光密度值不再发生较大的变化,趋于平稳,说明胶体金颗粒对抗体蛋白的吸附基本达到饱和,因此最适抗体用量为13μg/mL。
2.3 试纸条特异性
经过与南瓜花叶病毒、西瓜花叶病毒、黄瓜绿斑驳花叶病毒、小西葫芦黄花叶病毒的阳性材料测试比较,仅南瓜花叶病毒阳性材料检测线及质控线均出现明显条带,其他阳性材料仅质控线出现条带,检测线未出现条带,因此本试纸条具有特异性,结果见图3。
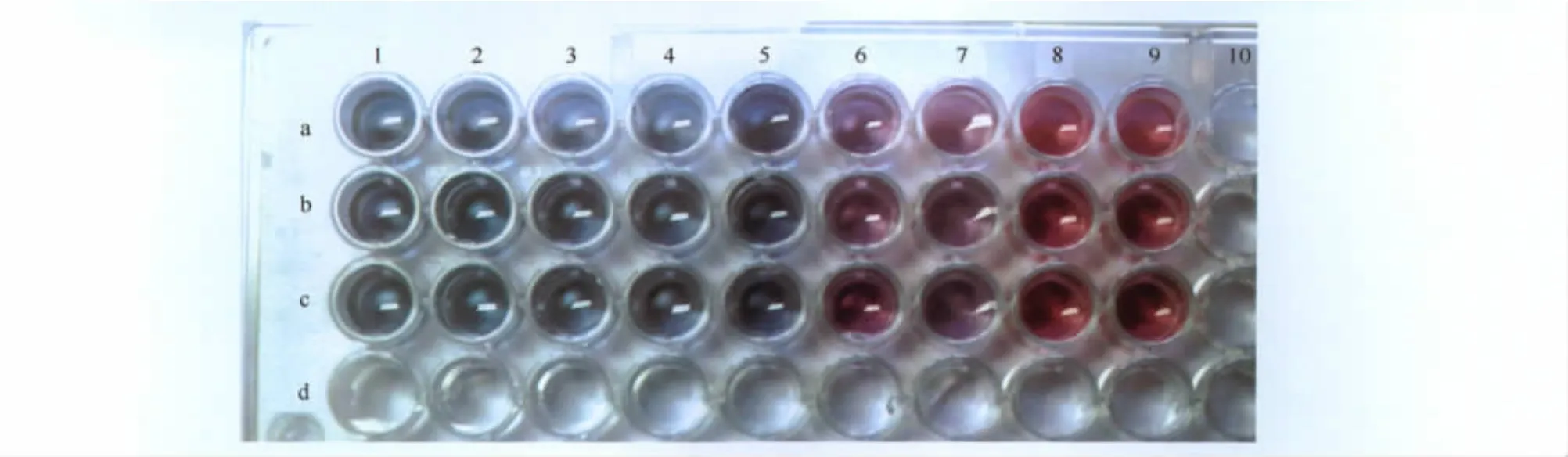
图2 最适抗体用量测试
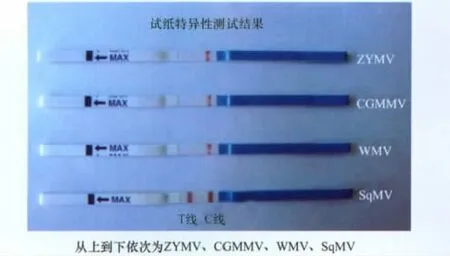
图3 试纸特异性测试结果
2.4 试纸条灵敏度
分别稀释101倍、102倍、103倍、104倍、105倍等不同稀释倍数,由图4可见在阳性材料稀释104倍后检测线亦有较明显条带,稀释105倍后检测线条带不明显,因此本试纸条的检测灵敏度为阳性材料稀释104倍。
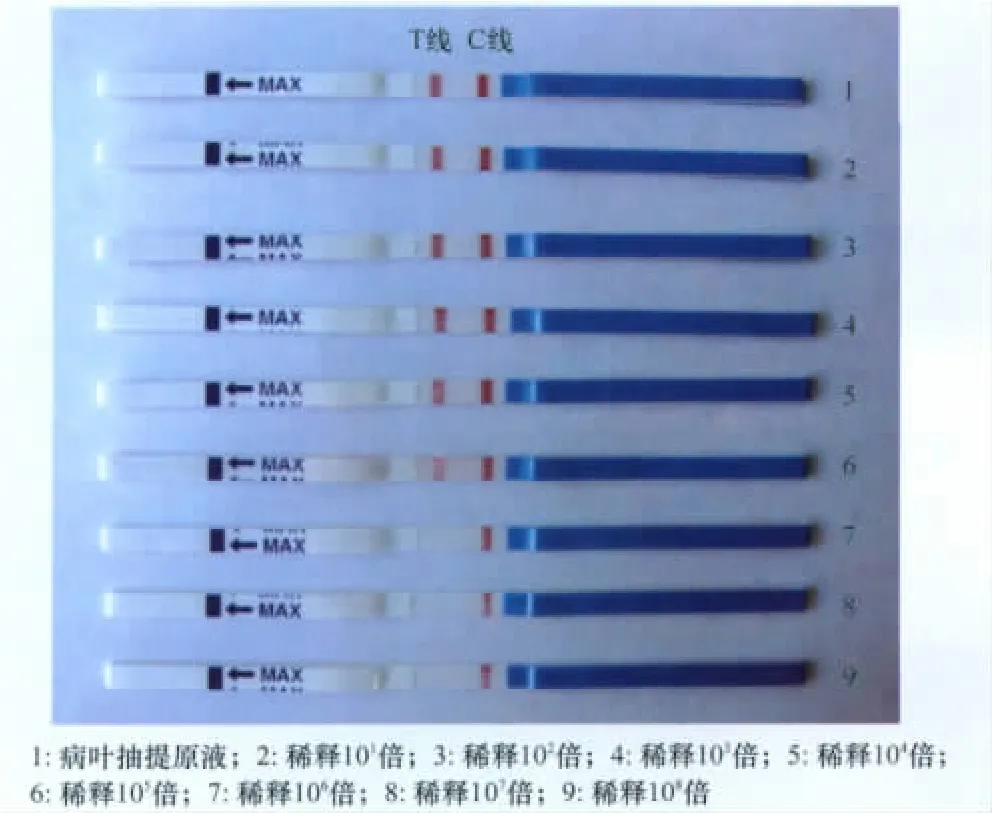
图4 试纸灵敏度测试结果
2.5 试纸条稳定性
从试纸条的测试结果来看,将试纸条放在内放干燥剂的封口塑料袋中,室温和37℃下保存长时间后颜色略减弱,其他不同温度、不同时间的测试结果无明显变化,说明在适当条件下保存,本试纸条具有较好的稳定性。
3 讨论
由于传统的实验室检测方法程序较为复杂,分析费用较高且耗时等因素,并不适宜大田病害检测时的普遍应用,如何建立植物病害简便、快速、灵敏,适合现场快速检测的方法,是植物病害检测工作发展的方向。本试验的目的是建立南瓜花叶病毒胶体金免疫层析试纸条检测的方法,使用自制的高特异性金标抗体,通过对试纸条的条件优化,制作出南瓜花叶病毒胶体金免疫层析检测试纸条。该检测方法最大的优点是无需借助检测仪器,检测快速、简便,10~15min内即可检测出结果,且具有特异性好、灵敏度高等优点。作为一种快速筛查的手段,既可节省检测成本,又可用于广大基层单位开展南瓜花叶病毒的检测和防控工作中,具有潜在的经济价值和社会效益。
[1]汪琳,周琦,赖平安,等.免疫胶体金技术及其在检验检疫中的应用[J].检验检疫科学,2004,14(4):56-58.
[2]祁伟,韦传宝,杜宇.小西葫芦黄花叶病毒外壳蛋白抗体制备[J].生物学杂志,2010,27(1):35-38.
[3]魏梅生,李桂芬,张周军,等.胶体金免疫层析法快速检测烟草环斑病毒[J].植物检疫,2002,16(2):82-83.
[4]魏梅生,刘洪义,李桂芬.马铃薯X病毒和马铃薯Y病毒胶体金免疫层析试纸条的研制[J].植物保护,2006,32(6):139-141.
[5]魏梅生,杨翠云,李桂芬.番茄环斑病毒和烟草环斑病毒复合型胶体金免疫层析试纸条的研制[J].植物检疫,2008,22(2):75-77.
[6]孙艳秋,赵奎华,曹远银,等.黄瓜细菌性角斑病免疫胶体金检测试纸条的研制[J].植物病理学报,2011,41(2):131-138.
[7]倪同浩.链霉素胶体金免疫层析快速检测试纸条的研制[D].扬州:扬州大学,2009.
[8]张晓雷.四种检疫性植物病毒的胶体金免疫层析试纸条的研究[D].合肥:安徽农业大学,2009.
Gold immunochromatography assay for rapid detection ofSquashmosaicvirus
Liang Xinmiao1, Bian Yong1, Deng Congliang1, Li Guifen2, Zhou Qi1, Wang Wanchun1
(1.BeijingEntry-ExitInspectionandQuarantineBureau,Beijing101312,China;2.InstituteofAnimalandPlantQuarantine,CAIQ,Beijing100029,China)
Tri-sodium citrate with aqueous gold chloride was warmed up and mixed to make 25 nm colloidal gold particles under the conditions of pH7.6 and 13μg/mL protein.Test line and control line on nitrocellulose filter were spread to assemble immunostrip.The results indicated that the virus could be tested specifically on immunostrip within 10 minutes,and the sensitivity was a dilution of 104-fold purifiedSquashmosaicvirus.
Squashmosaicvirus; gold immunochromatography assay; immunostrip
S 432.41
A
10.3969/j.issn.0529-1542.2012.05.017
2011-12-15
2012-01-10
国家质检总局科技计划项目(2008IK234);国家质检公益性项目(200111035);国家重点基础研究发展计划(“973”)项目(2011CB932800)
* 通信作者E-mail:liangxm@bjciq.gov.cn

