烟粉虱中甘薯褪绿矮化病毒(SPCSV)的快速检测技术
张 盼, 宋国华, 乔 奇, 秦艳红,张德胜, 田雨婷, 郑文明, 张振臣*
(1.河南农业大学生命科学学院,郑州 450002;2.河南省农业科学院植物保护研究所,郑州 450002;3.河南省许昌市农产品质量安全检测检验中心,许昌 461000)
烟粉虱中甘薯褪绿矮化病毒(SPCSV)的快速检测技术
张 盼1,2, 宋国华3, 乔 奇2, 秦艳红2,张德胜2, 田雨婷2, 郑文明1, 张振臣2*
(1.河南农业大学生命科学学院,郑州 450002;2.河南省农业科学院植物保护研究所,郑州 450002;3.河南省许昌市农产品质量安全检测检验中心,许昌 461000)
建立了利用NCM-ELISA、RT-PCR和半巢式RT-PCR检测烟粉虱中SPCSV的方法,比较了3种检测方法的灵敏性。结果表明,NCM-ELISA最低能从16头带毒烟粉虱中检测出SPCSV;RT-PCR能稳定地从3头以上带毒烟粉虱中检测出SPCSV;半巢式RT-PCR能稳定地从单头烟粉虱中检测出SPCSV。检测灵敏性研究表明,用体外转录的RNA作为核酸模板,RT-PCR可检测的最低浓度为5.69×104拷贝/μL,半巢式RT-PCR为5.69×101拷贝/μL,说明半巢式RT-PCR检测方法的灵敏性比RT-PCR高1 000倍。
甘薯褪绿矮化病毒; 烟粉虱; 硝酸纤维素膜酶联免疫吸附测定; 半巢式RT-PCR
甘薯褪绿矮化病毒(Sweetpotatochloroticstunt virus,SPCSV)属于长线形病毒科(Closteroviridae)毛形病毒属(Crinivirus)成员。该病毒的基因组为双组分单链正义RNA,基因组大小为17.6kb左右[1]。根据血清学关系和核苷酸序列,SPCSV可划分为东非(EA)和西非(WA)两个株系[2]。20世纪70年代首先在非洲发现了SPCSV,目前主要分布在非洲和南美的一些国家[3]。SPCSV是危害甘薯的主要病毒之一,特别重要的是,SPCSV可与马铃薯Y病毒属(Potyvirus)的甘薯羽状斑驳病毒(Sweetpotatofeatherymottle virus,SPFMV)协生共侵染甘薯引起甘薯病毒病害SPVD(sweet potato virus disease,SPVD)。SPVD 是甘薯上最严重的病毒病害之一,通常可使甘薯减产50%~98%,甚至绝收[3-4]。
2010年Qiao等[5]首先报道了SPCSV在我国的发生。张振臣等[6]在我国广东、江苏、四川、安徽等主要甘薯产区均发现了SPVD的存在,说明SPVD在我国已有较广泛的分布。SPCSV是SPVD的主要病原之一,主要由烟粉虱(Bemisiatabaci)以半持久方式传播[7],感染SPCSV的甘薯通常会迅速的形成SPVD,SPVD的流行跟烟粉虱的数量密切相关[8]。因此,建立一种简便、快速、灵敏的检测烟粉虱中SPCSV的方法,对于该病的预警和防治具有重要意义。近年来,硝酸纤维素膜酶联免疫吸附测定(NCM-ELISA)[9],反 转录 - 聚 合 酶 链 式 反 应(RT-PCR)[10],巢式 RT-PCR[11]等方法已经被用于传毒昆虫中病毒的检测,但目前尚未见针对烟粉虱中SPCSV检测方法的研究报道,为此,我们建立了利用 NCM-ELISA、RT-PCR和半巢式 RT-PCR检测烟粉虱中SPCSV的方法,比较了3种检测方法的可靠性和灵敏性,期望获得一种快速、高效的检测烟粉虱体内SPCSV的方法。
1 材料与方法
1.1 供试毒源和烟粉虱
将感染SPCSV的甘薯植株种植于防虫温室内用于饲养烟粉虱,将经过饲养3d以上的烟粉虱成虫视为带毒烟粉虱。无毒烟粉虱采自棉花田,每年7-9月份从河南省农业科学院原阳试验基地的大田棉花上采集烟粉虱成虫,用健康的四季小白菜饲养两周后作为阴性对照。收集带毒烟粉虱成虫和无毒烟粉虱成虫用液氮速冻后,置于-70℃保存备用。将经过NCM-ELISA和RT-PCR检测SPCSV为阴性的甘薯茎尖培养试管苗作为甘薯阴性对照。
1.2 试剂及试剂盒
SPCSV的硝酸纤维素膜酶联免疫吸附测定(NCM-ELISA)检测试剂盒购自国际马铃薯中心(CIP);UNIQ-10柱式总RNA抽提试剂盒为上海生工生物工程公司产品;UNIQ-10柱式DNA胶回收试剂盒购自北京百泰克生物技术公司;RNase抑制剂、AMV 反转录酶、TaqDNA 聚合酶、pMD19-T载体、T7RNA Polymerase购自TaKaRa公司。其他常用试剂为国产分析纯。
1.3 引物设计
根据GenBank中已登录的SPCSVhsp70基因的核苷酸序列设计3条引物CSV70P1:5′-GACGG(G/T)GGTAC(G/T)ATGAA(A/G)GTCC-3′,CSV70P2:5′-GGCTCACAAAC(A/T/C)GA(C/T)TTCATAAACAT-3′,CSV70P3:5′-TCAACCCCAACCCATCGTTTTAG-3′。 其 中,CSV70P1和CSV70P2用作半巢式RT-PCR的第1轮扩增,预期扩增片段大小为431bp;CSV70P1和CSV70P3用作半巢式RT-PCR的第2轮扩增引物,预期扩增片段大小为170bp。引物由上海生工生物工程公司合成。
1.4 NCM-ELISA检测烟粉虱中SPCSV
用解剖针挑取烟粉虱成虫放入1.5mL离心管中,加入100μL抽提缓冲液,用研磨棒充分研磨,5 000r/min离心3min。取上清液5μL点于硝酸纤维素膜上,室温晾干,然后按照NCM-ELISA检测试剂盒说明书进行操作。首先将膜浸入封闭缓冲液中室温封闭1h,洗涤后加入SPCSV特异性抗体溶液,室温孵育过夜;然后弃去抗体溶液,洗涤后加入酶标抗体溶液,室温孵育1h;最后,弃去酶标抗体溶液,洗涤后加入底物溶液,显色60min,蒸馏水洗膜终止反应。阳性样品在膜上形成紫色沉淀,阴性样品则无颜色反应。利用NCM-ELISA方法分别对1、2、4、8、16、32、64、128头和256头烟粉虱中的SPCSV进行检测,分别以无毒烟粉虱和SPCSV CP基因的原核表达蛋白作为阴性和阳性对照。同样的处理,重复检测3次,以测试结果的稳定性。
1.5 RT-PCR检测烟粉虱中SPCSV
用解剖针挑取单头烟粉虱成虫放入加有30μL预冷的RNA提取液的1.5mL离心管中,用DEPC处理过的研磨棒充分研磨,再用170μL的抽提液冲洗研磨棒,然后按照UNIQ-10柱式总RNA抽提试剂盒说明书,提取烟粉虱成虫体内总RNA。利用RT-PCR试剂盒进行反转录和PCR。反转录体系为:4μL RNA 模板,2μL 5×RT buffer,0.5μL CSV70P2(10μmol/L),1μL dNTPs(10mmol/L),0.25μL RNase抑制剂(40U/μL)和0.5μL AMV反转录酶 (5U/μL),用 DEPC-H2O 补足 10μL,42℃反转录40min,99℃5min,5℃5min。PCR反应体系为:2.5μL cDNA,2.5μL 10×PCR buffer,1μL dNTPs(2.5mmol/L),0.5μL CSV70P1(10μmol/L)和CSV70P2(10μmol/L),0.2μLTaq酶(5U/μL),用ddH2O补足25μL。PCR反应条件:94℃预变性2min;94℃30s,54℃30s,72℃45s,35个循环,最后72℃延伸10min。扩增产物经1.0%琼脂糖凝胶电泳、UVP凝胶成像系统观察和照相。
1.6 半巢式RT-PCR检测烟粉虱中SPCSV
取4μL核酸模板按1.5中的条件进行首轮RT-PCR扩增,将扩增产物稀释20倍后,取1μL产物作为第2轮PCR扩增的模板,第2轮PCR扩增体系为:2.5μL 10×PCR buffer,1μL dNTPs(2.5mmol/L),0.5μL CSV70P1(10μmol/L)和CSV70P3(10μmol/L),0.2μLTaq酶(5U/μL),用ddH2O补足25μL。PCR反应条件:94℃预变性2min;94℃30s,56℃30s,72℃30s,完成32个循环,最后72℃延伸10min,PCR产物的电泳、染色及成像同1.5。
1.7 RT-PCR和半巢式 RT-PCR产物的克隆和序列测定
将部分RT-PCR和半巢式RT-PCR产物进行纯化,分别与pMD19-T载体连接,连接产物转化大肠杆菌TG1,经蓝白斑筛选和PCR鉴定后获得阳性克隆。核苷酸序列测定由TaKaRa公司完成。利用DNAMAN和BLAST软件对所测序列进行比较分析。
1.8 RT-PCR和半巢式 RT-PCR检测SPCSV的灵敏性比较
按照T7RNA Polymerase说明书进行RNA体外转录。在上游引物CSV70P1的5′端引入T7启动子序列,以SPCSVhsp70基因的重组质粒为模板,进行PCR扩增,扩增的双链DNA片段(454bp)在T7 RNA聚合酶的作用下经体外转录形成单链RNA(cRNA),纯化后用核酸测定仪测得cRNA浓度为148.1ng/μL,根据阿伏伽德罗常数将浓度换算为5.69×1011拷贝/μL(cRNA 含量=6.02×1023×148.1×10-9/(454×345)=5.69×1011拷贝/μL)。将该cRNA用DEPC-H2O按10倍梯度稀释成5.69×1010~5.69×101拷贝/μL,分别取浓度为5.69×107~5.69×101拷贝/μL的7个浓度梯度的RNA作为检测模板,分别按照1.5和1.6方法进行RT-PCR和半巢式RT-PCR灵敏性检测,比较两者灵敏性的差异。
2 结果与分析
2.1 NCM-ELISA检测烟粉虱体内的SPCSV
以SPCSV特异性抗体作为一抗,应用NCMELISA方法分别检测1、2、4、8、16、32、64、128头和256头烟粉虱中的SPCSV。结果表明,NCMELISA方法最低能从16头带毒烟粉虱中检测出SPCSV,相同数量的无毒烟粉虱和健康甘薯检测结果为阴性(图1)。同样的处理重复检测3次,灵敏性和特异性结果均相同。

图1 NCM-ELISA检测烟粉虱中SPCSV
2.2 RT-PCR检测烟粉虱体内的SPCSV
以提取的烟粉虱总RNA为模板,利用引物CSV70P1/CSV70P2进行 RT-PCR扩增。结果表明,从10、5、3、2和单头带毒烟粉虱中均能扩增出一条大小为431bp的特异性条带,而从无毒烟粉虱和脱毒甘薯试管苗均中未能扩增出相应的条带(图2)。为了检验RT-PCR检测带毒烟粉虱的稳定性,分别对单头、2头和3头带毒烟粉虱各进行了10次RT-PCR重复试验,发现单头烟粉虱中SPCSV的检出率是40%,2头检出率为60%,3头的检出率为100%。说明利用RT-PCR方法能稳定检测出3头烟粉虱中的SPCSV。
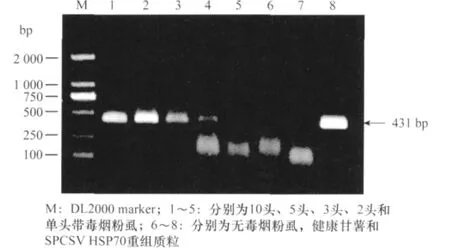
图2 RT-PCR检测烟粉虱中SPCSV
2.3 半巢式RT-PCR检测烟粉虱体内的SPCSV
采用半巢式RT-PCR分别对单头、2头、3头带毒烟粉虱中SPCSV的带毒情况进行检测。结果显示,半巢式RT-PCR从单头、2头和3头带毒烟粉虱体内均能扩增出170bp的目的条带,而不能从无毒烟粉虱和脱毒甘薯试管苗中扩增出相应条带(图3)。对单头带毒烟粉虱进行了10次半巢式RT-PCR重复检测,阳性率为100%。说明利用半巢式RT-PCR方法能稳定检测出单头烟粉虱中的SPCSV。
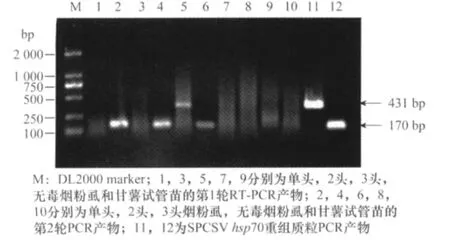
图3 半巢式RT-PCR检测烟粉虱中SPCSV
2.4 RT-PCR和半巢式RT-PCR产物的序列测定
RT-PCR和半巢式RT-PCR扩增出的片段序列测定结果表明,所克隆片段的核苷酸序列与SPCSV WA株系的相似性为97.6%~100%,说明两种方法所扩增出的片段均为SPCSV的特异性片段。
2.5 RT-PCR和半巢式 RT-PCR 检测SPCSV的灵敏性比较
以制备的SPCSV的cRNA作为模板,进行RT-PCR检测,结果表明,RT-PCR可检测的cRNA最低浓度为5.69×104拷贝/μL(图4)。以第1轮RT-PCR的扩增产物为模板,进行半巢式RT-PCR扩增,结果半巢式RT-PCR最低能从浓度为5.69×101拷贝/μL的cRNA中检测出SPCSV(图5),表明建立的半巢式RT-PCR的检测灵敏度比RT-PCR高1 000倍。
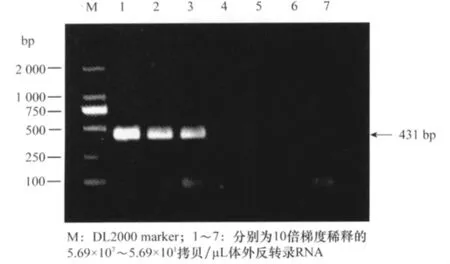
图4 RT-PCR检测SPCSV的灵敏性
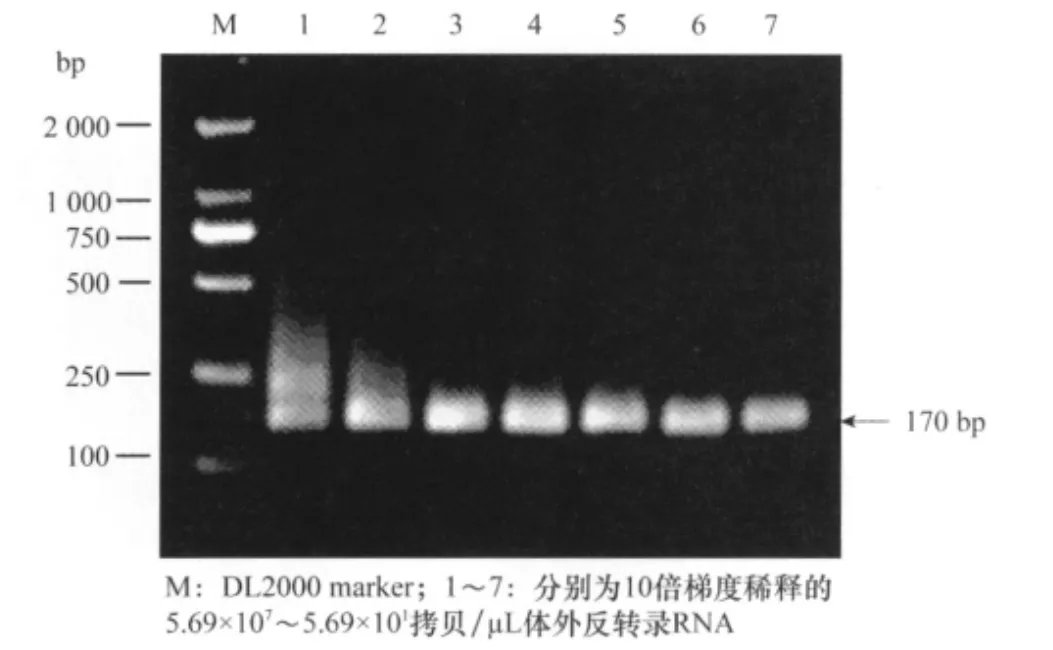
图5 半巢式RT-PCR检测SPCSV的灵敏性
3 讨论
本试验采用了 NCM-ELISA、RT-PCR和半巢式RT-PCR 3种方法对烟粉虱中的SPCSV进行检测,3种方法均能从带毒烟粉虱中检测出SPCSV,但灵敏性有差异。NCM-ELISA的检测灵敏性最低,RT-PCR 其 次,半 巢 式 RT-PCR 最 高。NCMELISA方法比较简便、经济,在很小的NC膜上可以进行大量样品检测,结果可以长期保存,但检测灵敏度相对较低,最低能从16头带毒烟粉虱中检测出SPCSV。RT-PCR能从单头烟粉虱中检测出SPCSV,但由于每头烟粉虱中的带毒量可能不同,以及RNA提取与反转录过程中会造成部分RNA的损失,检测单头烟粉虱时不太稳定,有假阴性情况的出现。本试验经过多次重复,发现只有从3头以上的带毒烟粉虱中才能稳定地检测出SPCSV。半巢式RT-PCR的检测灵敏度最高,比RT-PCR的灵敏度高1 000倍,能从单头带毒烟粉虱体内稳定地检测出SPCSV,可防止因病毒含量低而漏检。此外,半巢式RT-PCR通过第2轮PCR扩增,可以进一步验证第1轮RT-PCR扩增产物的特异性,其扩增结果的稳定性也高于RT-PCR。
SPCSV的长距离传播主要通过种薯和种苗,而短距离主要通过烟粉虱进行传播[7-8,12]。烟粉虱生存能力强、繁殖速度快,据报道,烟粉虱经过48h的饲毒就能进行有效传染,而且烟粉虱的数量越大,病毒传播的有效性越强[8,12],因此,建立高效快速的检测方法,加强对烟粉虱带毒情况的监测,对于该病毒的预警和防治具有重要意义。我国自2010年首次发现SPCSV以来[5],目前在全国多个甘薯种植区陆续检测到该病毒病的存在[6],由于对SPCSV尚无特别有效的防治方法,做好烟粉虱带毒率的检测,加强对烟粉虱的防治,可有效减少SPCSV的蔓延扩散,减少病害引起的损失。
[1]Kreuze J F,Savenkov E I,Valkonen J P T.Complete sequence and analyses of the subgenomic RNAs ofSweetpotato chloroticstuntvirusreveal several new features for the genusCrinivirus[J].Journal of Virology,2002,76:9260-9270.
[2]Hoyer U,Maiss E,Jelkmann W,et al.Identification of the coat protein gene of a sweet potato sunken vein closterovirus isolate from Kenya and evidence for a serological relationship among geographically diverse closterovirus isolates from sweet potato[J].Phytopathology,1996,86:744-750.
[3]Gutiérrez D L,Fuentes S,Salazar L F.Sweet potato virus disease(SPVD):distribution,incidence,and effect on sweet potato yield in Peru[J].Plant Disease,2003,87:297-302.
[4]Njeru R W,Mburu M W K,Cheramgoi E,et al.Studies on the physiological effects of viruses on sweet potato yield in Kenya[J].Annals of Applied Biology,2004,145:71-76.
[5]Qiao Q,Zhang Z C,Qin Y H,et al.First report ofSweetpo-tatochloroticstuntvirusinfecting sweet potato in China[J].Plant Disease,2011,95:356.
[6]张振臣,乔奇,秦艳红,等.我国发现由甘薯褪绿矮化病毒和甘薯羽状斑驳病毒协生共侵染引起的甘薯病毒病害[J].植物病理学报,2012,42(3):328-333.
[7]Valverde R A,Sim J,Lotrakul P.Whitefly transmission of sweet potato viruses[J].Virus Research,2004,100(1):123-128.
[8]Artitua V,Adipala E,Carey E E,et al.The incidence of sweet potato virus disease and virus resistance of sweet potato grown in U-ganda[J].Annals of Applied Biology,1998,132:399-411.
[9]王贵珍,周益军,周雪平.以直接斑点免疫结合测定法检测灰飞虱体内的水稻条纹病毒[J].浙江大学学报(农业与生命科学版),2005,31(1):37-40.
[10]Mehta P,Brlansky R H,Gowda S,et al.Reverse-transcription polymerase chain reaction detection ofCitrustristezavirusin aphids[J].Plant Disease,1997,81:1066-1069.
[11]Cambra M,Olmos A,Gorris M T,et al.Detection ofCitrus tristezavirusby print capture and squash capture-PCR in plant tissues and single aphids[C]∥Fourteenth International Organization Citrus Virologists Conference,California,America,2000:42-49.
[12]Byamukama E,Gibson R W,Aritua V,et al.Within-crop spread of sweet potato virus disease and the population dynamics of its whitefly and aphid vectors[J].Crop Protection,2004,23:109-116.
Rapid detection technologies of theSweetpotatochlorotic stuntvirusinBemisiatabaci
Zhang Pan1,2, Song Guohua3, Qiao Qi2, Qin Yanhong2, Zhang Desheng2,Tian Yuting2, Zheng Wenming1, Zhang Zhenchen2
(1.CollegeofLifeSciences,HenanAgriculturalUniversity,Zhengzhou450002,China;2.InstituteofPlantProtection,HenanAcademyofAgriculturalSciences,Zhengzhou450002,China;3.AgriculturalProductsQualitySafetyTestingandInspectionCentreinXuchang,Xuchang461000,China)
The methods of NCM-ELISA,RT-PCR and semi-nested RT-PCR were used to detect theSweetpotato chloroticstuntvirus(SPCSV)in the whiteflyBemisiatabaci,and the sensitivities of these methods were compared.The results showed that SPCSV could be detected from at least 16 whiteflies carrying the virus by NCMELISA,occasionally from single whitefly and steadily from more than three whiteflies by RT-PCR;SPCSV could be steadily detected from single insect by semi-nested RT-PCR.WithinvitroRNA transcript as template,the sensitivity were up to5.69×104copies/μL and5.69×101copies/μL by RT-PCR and semi-nested RT-PCR,respectively,indicating that the detection sensitivity of the semi-nested RT-PCR was 1 000 times higher than that of the RT-PCR.
Sweetpotatochloroticstuntvirus(SPCSV);Bemisiatabaci; NCM-ELISA; semi-nested RT-PCR
S 432.41
A
10.3969/j.issn.0529-1542.2012.05.016
2011-12-26
2012-04-25
国家甘薯产业技术体系建设项目(CARS-11-B-07)
* 通信作者Tel:0371-65711547;E-mail:zhangzhenchen@126.com

