牙周膜成纤维细胞对成骨细胞细胞数量和碱磷酶活性的影响
梁 莉 刘洪臣 周 威 温莉莎
牙周膜在健康状态下保持生理和代谢平衡,源于其结构中多种细胞通过一定的途径相互作用,彼此间进行数量和位置的相互调控[1]。其中,牙周膜成纤维细胞和成骨细胞是牙周组织的两种重要的细胞成分,它们对于维持正常牙周膜的生理功能起关键作用。本研究通过建立人牙周膜成纤维细胞(human periodontalligamentfibroblastcells,HPLFs)与成骨细胞(Osteoblast cells,OB)transwell共培养系统,研究人牙周膜成纤维细胞对成骨细胞生物学特性的影响,为深入探讨正畸牙齿移动的生物学机制以及牙周膜形成和再生的相关因素奠定基础,同时也为临床正畸治疗提供一定的实验依据。
1. 材料和方法
1.1 主要试剂 DMEM(Dulbecco’s modified Eagle medium)培养基(Gibco公司,美国),胎牛血清(Fetal bovine serum,FBS)(浙江金华清湖犊牛利用研究所),胰蛋白酶(Gibco公司,美国),跨膜培养器(trainswell,孔径 0.4/μm,Millipore,美国),碱性磷酸酶试剂盒(南京建成生物工程公司),DG-3022型酶联免疫监测仪(南京华东电子仪器厂),抗波形丝蛋白抗体和角蛋白抗体(Dako公司,丹麦),SABC试剂盒(武汉博士德生物工程公司)。
1.2 人牙周膜细胞的原代培养和鉴定 选取11-13岁因正畸需要而拔除的前磨牙,无菌条件下刮取牙根中1/3的牙周膜组织,剪成1.0 mm×1.0mm×1.0mm小块,平铺于25ml培养瓶底,加入含10%FCS的DMEM培养液,放入CO2孵箱,在37℃、5%CO2、100%湿度条件下培养,倒置显微镜下观察细胞生长情况。当细胞铺满瓶底80%时,0.25%胰酶消化,1∶2传代。用波形丝蛋白抗体和角蛋白抗体进行染色鉴定。取4-6代细胞进行实验。
1.3 人成骨细胞的培养 选用人成骨细胞株HOS TE85(由美国 UCSF细胞库惠赠)。HOS TE85细胞用DMEM培养液(含10%胎牛血清)。在37℃、5%CO2孵箱中进行传代培养。
1.4 建立共同培养模型 先接种Obs 48h后,按millipore transwell的说明,放入transwell装置,以保证培养液能上下相通,而装置内外的细胞被隔开,在transwell中加入人HPLFs。(见图1)
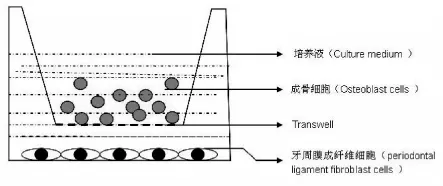
图1 细胞共培养模型
实验分为两组:单独培养的OBs组和与HPLFs共培养的OBs组。
1.5 人HPLFs对OBs增殖的影响 先取对数生长良好的OBs接种于24孔板,每孔1ml(含细胞104个),48h后,去培养液,按上述实验分组,加入人HPLFs,每孔2×105,每组各设 12个复孔。分别在1d、3d、5d、7d收集OBs,台盼蓝染色计数活细胞数,取均值。
1.6 人HPLFs对OBs碱性磷酸酶(ALP)活性的影响 取对数生长良好的OBs接种于24孔板,每孔1ml(含细胞104个),48h后,去培养液,按上述实验分组,加入HPLFs,每孔2×105,每组各设12个复孔。分别在1d、3d、5d、7d各取1块培养板,收集OBs,置于24孔培养板中,每孔1ml(含细胞104个),再分别加入细胞裂解液200μ l,37℃裂解约4h,适当吹打,收集裂解液。取裂解液 50μ l,加入底物 50μ 1,37℃保温 5-20min,420nm波长测定A值,间接反映细胞碱性磷酸酶活性。
1.7 统计学分析测量 采用SPSS 13.0统计软件处理,两组数据间的比较采用t检验。设P<0.05为差异有显著性。
2. 结果
2.1 HPLFs的生长情况 倒置显微镜下观察培养的HPLFs呈星形或梭形,胞体丰满,胞浆均匀,胞核呈圆形或卵圆形,核仁清晰(见图2)。所培养的细胞经SABC免疫组织化学检测呈抗波形丝蛋白阳性,抗角蛋白阴性,证明细胞为来源于中胚层的成纤维样细胞。(见图3)

图2 HPLF细胞的形态(×100)
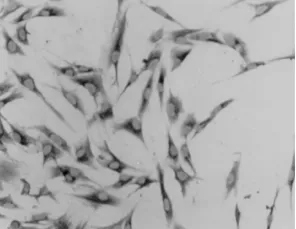
图3 HPLF细胞波形丝蛋白染色(SABC,×200)
2.2 人HPLFs对OBs增殖的影响 从细胞生长曲线可以看出,1d时transwell共培养组OBs细胞计数高于对照组,但两组间无显著性差异;3d和5d时transwell共培养组OBs细胞计数分别为4.5×104及8.5×104,高于对照组,且两组分别与对照组OBs细胞计数有显著性差异(P<0.05);7d时transwell共培养组HPLFs细胞计数低于对照组,但两组间细胞计数无显著性差异(见图4)。
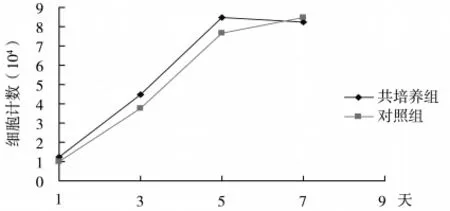
图4 人HPLFs对OBs增殖的影响
2.3 人HPLFs对OBs碱性磷酸酶(ALP)活性的影响 transwell共培养组与对照组相比,共培养组OBs ALP活性低于对照组。经组间t检验:在1d时两组OBsALP活性无显著性差异,3d时有显著性差异(P<0.05),5d及7d时差异尤其显著(P< 0.01)(见附表)。
附表 人HPLFs对OBs碱性磷酸酶(ALP)活性的影响(±s)

附表 人HPLFs对OBs碱性磷酸酶(ALP)活性的影响(±s)
*P< 0.05**P<0.01与同时间对照组相比。n=12
?
3. 讨论
成骨细胞和牙周膜成纤维细胞都是牙周组织的重要组成成分,参与牙周正常生理代谢、创口愈合或牙种植界面形成。故成骨细胞与牙周膜成纤维细胞的关系在牙周膜的改建中处于核心地位[2,3]。
近年来发展起来的跨室联合培养技术(transwellcoculture),在研究炎症趋化因子、肿瘤转移等方面得到广泛应用,现已应用于口腔生物医学领域[4,5]。此培养体系可以保证培养液能上下相通,而装置内外的细胞被隔开,使体外研究更能模拟体内的微环境。本研究采用这种联合培养技术用于研究人牙周膜成纤维细胞对成骨细胞增殖和分化的影响,建立了人成骨细胞与牙周膜成纤维细胞的共培养体系[8],能够更好地研究人牙周膜成纤维细胞对成骨细胞的影响。
本实验研究结果表明,在3d和5d时共培养组OBs计数均高于对照组,且两组间OBs计数有显著性差异。但在3d时两组OBs ALP活性有显著性差异,5d及7d时有极显著性差异,且共培养组OBs ALP活性低于对照组,表明人牙周膜成纤维细胞促进成骨细胞的细胞数量增加,但抑制其碱性磷酸酶的活性。
ALP是成骨样细胞早期分化的重要标志之一,其活性高低可反映相应组织细胞的钙化能力和向成骨细胞转化的趋势[7]。牙周膜成纤维细胞抑制成骨细胞的作用在体内表现为牙周膜结构宽度的保持及发育期颅骨骨缝的维持中[6]。其机制可能是牙周膜成纤维细胞分泌的前列腺素(prostaglandins,PG)等物质抑制了成骨细胞的成骨作用,用环加样酶抑制剂吲哚美辛、前列腺素(PG)和前列腺素F2(PGF2)抗体可降低其影响[8]。
综上所述,本文研究发现人牙周膜成纤维细胞促进成骨细胞的细胞数量增加,但抑制其碱性磷酸酶的活性,为深入探讨正畸牙齿移动的生物学机制以及牙周膜形成和再生的相关因素奠定了基础,同时也为临床正畸治疗提供一定的实验依据。
[1]Hoshi N,Negishi H,Okada S,et al.Response of human fibroblasts to implant surface coated with titanium dioxide photocatalytic films[J].J ProsthodontRes,2010,54(4):185-191
[2]Jonsson D,NebelD,BratthallG,etal.The human periodontal ligament cell:a fibroblast-like cell acting as an immunecell[J].JPeriodontal Res,2011,46(2):153-157
[3]Kasaj A,Willershausen B,Reichert C,et al.Ability of nanocrystalline hydroxyapatite paste to promote human periodontal ligament cell proliferation[J].J Oral Sci,2008,50(3):279-285
[4]Ding C,Cai Y,Marroquin J,et al.Plasmacytoid dendritic cellsregulateautoreactiveB cell activation via solublefactors and in a cell-to-cell contact manner[J].J Immunol,2009,183(11):7140-7149
[5]Bernhardt A,Thieme S,Domaschke H,et al.Crosstalk of osteoblast and osteoclast precursorson mineralized collagen--towardsan in vitro model for boneremodeling[J].J Biomed Mater ResA,2010,95(3):848-856
[6]Docheva D,Padula D,Popov C,et al.Establishment of immortalized periodontal ligament progenitor cell line and its behavioural analysis on smooth and rough titanium surface[J].Eur Cell Mater,2010,19(5):228-241
[7]贺慧霞,刘洪臣,郭宏等.牙周膜干细胞向成骨细胞方向分化实验[J].中华老年口腔医学杂志,2011,5(9):129-133
[8]Ghanaati S,Willershausen I,Barbeck M,et al.Tissue reaction to sealing materials:different view at biocom-pat ibility[J].Eur JMed Res,2010,15(11):483-492

