离子色谱法检测生物丁醇中的无机阴离子
杜晓磊,夏春,王存进,侯倩慧,余季金
(1.青岛普仁仪器有限公司,山东青岛 266043; 2.青岛市计量测试所,山东青岛 266101; 3.青岛大学,山东青岛 266071)
21世纪以来,世界经济高速发展,自然资源以前所未有的速度被消耗着,一些重要资源如石油甚至面临枯竭的危险,世界各国纷纷研究可以替代的产品。目前汽油的燃料替代品以生物丁醇的研究和生产最为热门。生物丁醇之所以被视为一个替代乙醇的更好燃料添加剂,是因为它比乙醇具有更低的蒸气压和更高的能量密度,也可以和汽油以非常高的比例混合。尤其是丁醇的辛烷值和汽油更接近[1]。与化石燃料相比,生物丁醇具有更强的可再生能源的特征。
早期的生物丁醇是利用玉米和大麦等多种谷类作物发酵制取的,现在业界主要使用秸秆和木质种类的纤维发酵生产丁醇[2]。随着生物丁醇发酵和相关分离技术的日益完善,其产品的价格也将日益降低。
不同的发酵原料要求生物丁醇生产工艺有所不同。为了保证产品的质量,必需对其中的杂质进行例行检测。生物丁醇中过量的无机阴离子,可能会对机动交通工具的引擎产生腐蚀作用,其排放的尾气,也将影响大气的质量[3-5]。
目前测定醇类物质中无机阴离子的标准方法一般采用离子选择电极法、比色法、沉淀滴定等方法,此类方法操作复杂、存在基体干扰大、准确度低等缺点[6]。已有的文献表明,离子色谱法测定醇类物质中的等无机阴离子具有操作简便、准确度高、重现性好等优点[7-8]。笔者应用国产离子色谱仪测定了生物丁醇中Cl-等无机阴离子的浓度,无丁醇基体干扰,灵敏度高,重现性好,为生物丁醇中无机阴离子的测定提供了一种可靠的方法,该方法目前在国内外尚未见文献报道。
1 实验部分
1.1 主要仪器与试剂
离子色谱仪:PIC-10A型,青岛普仁仪器有限公司;
可调万用电炉:龙口市电炉制造厂;
Na2CO3,NaHCO3:分析纯,上海埃彼化学试剂有限公司;
Cl-标准溶液:浓度均为1000 mg/L,国家标准物质研究中心;
30% H2O2溶液:分析纯,烟台三和化学试剂有限公司;
生物丁醇样品:某研制单位的生物丁醇中试产品;
实验用水为超纯水(Millipore纯水机制得,电阻率大于18.2 MΩ·cm)。
1.2 色谱条件
色谱柱:NJ-SA-4A阴离子交换分离柱(250 mm×4.6 mm);淋洗液:1.92 mmol/L Na2CO3-1.8 mmol/L NaHCO3混合液,流速为 1.3 mL/min;进样体积:200 μL。
1.3 样品预处理
在50 mL烧杯中加入10 mL生物丁醇样品和2 mL H2O2,混匀,静置约5 min。把烧杯置于电炉上,使用低温档加热(在通风橱中操作),使液态样品慢慢蒸发。当样品接近蒸干时(体积大约1 mL),停止加热,让样品自然冷却5 min。加入20 mL去离子水,温热溶解潮盐,再冷却至室温。将样品转移定容至100 mL容量瓶中。样品经过0.22 μm滤膜,进行IC检测。
2 结果与讨论
2.1 色谱条件的选择
分析醇类物质中的无机阴离子时一般采用碳酸盐淋洗液或KOH淋洗液[7-8],若使用自再生抑制模式,两种淋洗液均存在基体干扰。而使用外加酸抑制模式则不存在基体干扰。考虑到预处理方法中已将丁醇去除,本实验采用Na2CO3-NaHCO3淋洗液。
2.2 样品中阴离子谱图
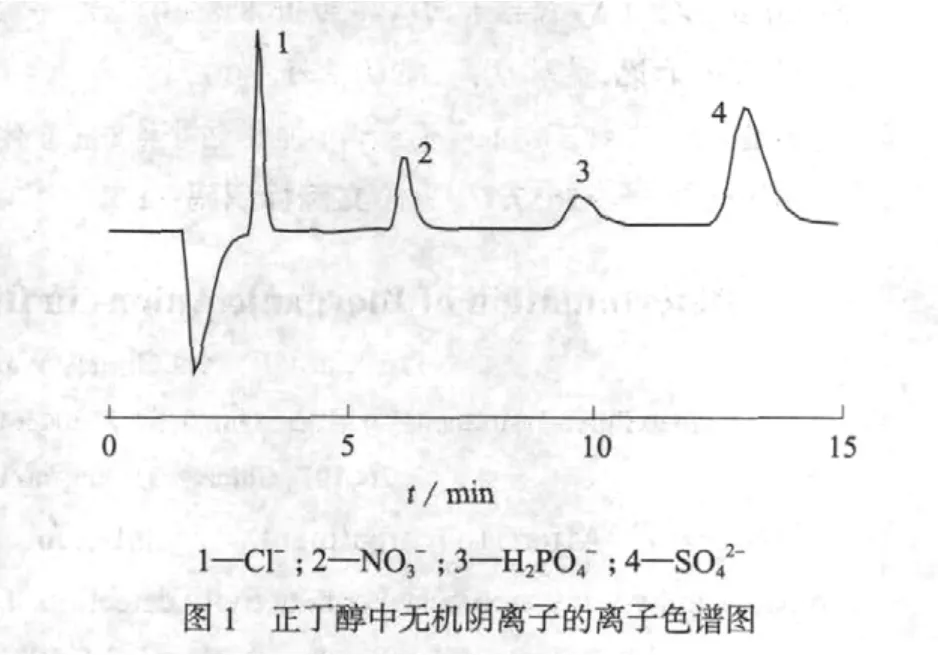
图1是生物丁醇样品的离子色谱图,图1表明生物正丁醇样品中主要存在Cl-,NO3-,H2PO4-和SO42-等无机阴离子。文献中[7]提到,甲醇基体会将Cl-峰覆盖,无法检测Cl-,因此去除样品中的醇类基体十分必要。生物丁醇样品经过预处理后已不存在丁醇基体干扰。
2.3 标准曲线与检出限
分别配制一系列Cl-,标准溶液,在确定的色谱条件下依次进样分析,以标准溶液浓度X(mg/L)为横坐标,色谱峰面积Y为纵坐标,绘制标准工作曲线,以3倍的信噪比(S/N=3)计算检出限4种离子的线性范围、线性方程、相关系数以及最低检出限(n=3)见表 1。

表1 线性范围、线性方程、相关系数和检出限
2.4 精密度试验
将正丁醇样品按照1.3的处理方法平行处理5次。5份样品中离子的保留时间与峰面积测定结果见表2。
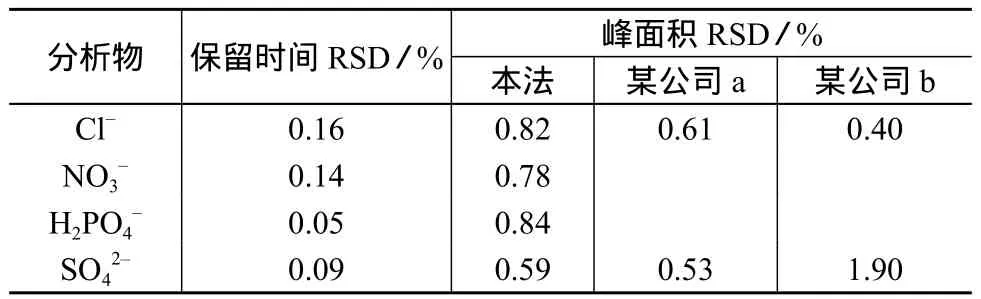
表2 保留时间与峰面积重现性结果
由表2可知,本法无论保留时间还是峰面积都具有较高的重现性。而在某国外公司提供的方法中,由于SO42-在甲醇中溶解度有限,10 mg/L SO42-会逐渐流失,致使峰面积重现性较差(n=10,RSD=1.90%)。
2.5 加标回收率
向1.3所得样品中添加已知量的Cl-,NO3-,4种离子,在确定的离子色谱条件下进行加标回收试验,样品平行测定3次,试验结果见表3。由表3可知的加标回收率分别为99.13%,102.22%,96.87%和97.42%,表明本方法测定结果准确、可靠。

表3 样品加标回收率(n=3)
3 结语
以PIC-10离子色谱检测生物丁醇(中试产品)中的无机阴离子,样品经过前处理可以消除丁醇基体干扰,灵敏度高,重现性好,适用于醇类物质中无机阴离子的测定,可应用于生物丁醇研制行业的例行检测。所测试的中试样品中氯离子,硫酸根等4种无机阴离子均在谱图中明显可见。与更高级别的产品相比,硝酸根等有偏高的迹象[9],故建议进一步优化生物丁醇的提取工艺。
[1]刘娅,刘宏娟,张建安,等.新型生物燃料-丁醇的研究进展[J].现代化工,2008,28(6): 28-32.
[2]Green E M. Fermentative production of butanol-the industrial perspective[J]. Current Opinion in Biotechology, 2011,22(3):337-343.
[3]Lee S Y,Park J H,Jang S H,et al. Fermentative butanol production by clostridia[J]. Bio-techology and Bioengineering,2008,101(2): 209-228.
[4]应明.生物丁醇萃取剂回收过程工艺条件的优化[J].天然气化工:化学与化工, 2011,36(1): 39-41.
[5]闫永亮,刘宏娟,张建安.代谢工程在生物丁醇生产中的应用及研究进展[J].现代化工,2012,32(4): 25-30.
[6]崔鹤,林雨霏,刘靖靖,等.离子色谱法测定乙醇中无机阴离子[J].理化检测:化学分册, 2012,48(1): 113-115.
[7]郭莹莹,张嘉捷,施青红.水溶性有机溶剂中痕量阴离子的离子色谱测定及机理研究[J].浙江大学学报:理学版,2005,32(2):194-197.
[8]叶明立,朱岩,施青红.离子色谱法测定有机溶剂中痕量阴离子[J]. 分析化学 , 2005,33(2): 187-190.
[9]GB/T 6027-1998 工业正丁醇[S].

