拟南芥abf3和abf4突变体对ABA和盐胁迫响应
刘 帅,朱明鲲,刘 旭,李 玲
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广东广州510631)
ABF是一类AREB类转录因子,可以与ABA诱导基因的启动子区域结合调节下游靶基因的表达[1].2000 年,UNO 等[2]和 CHOI等[3]分别从拟南芥中分离出4种bZIP蛋白,其中ABF1主要参与低温、ABA胁迫的应答反应;ABF3主要受 ABA、高盐、低温、热、氧化胁迫诱导;ABF2/AREB1、ABF4/AREB2则主要参与ABA、干旱、高盐、热和氧化胁迫应答反应[2].AREBs转录因子特异存在于植物中,超表达和abf4突变体植株,分析它们对ABA和盐胁迫响应特点,揭示ABF3和ABF4的功能差异,为深入研究ABF在ABA信号途径的作用提供依据.
1 材料与方法
1.1 材料与处理
哥伦比亚生态型野生型拟南芥(Columbia,缩写为Col).拟南芥突变体abf3(SALK 127755)和abf4(SALK 069523)购于拟南芥资源中心(Arabidopsis Biological Resource Center,ABRC),经本实验室纯化鉴定.
ABA处理:种子消毒后,播种于含有不同浓度的ABA的1/2MS固体培养基上,4℃放置2 d,然后在光照培养箱中(昼夜温度为22°/20°,光照周期为16 h/8 h,平均湿度为40% ~60%)培养.
盐胁迫处理:种子播种于含有 0、100、200 mmol/L NaCl的1/2MS固体培养基上,4℃同步化处理2 d,然后光照培养箱中(昼夜温度为22°/20°,光照周期为16 h/8 h,平均湿度为40% ~60%)培养.
1.2 试验试剂及PCR引物
Taq DNA聚合酶、RNA提取试剂TRizol、DNase I(RNAase-free)、One Step RT-PCR试剂盒均购自TaKaRa;引物合成和PCR产物测序由上海英俊公司完成,名称及序列如下:2Bd3-LP(ABF4)5’-GGGTTTTAGGGCTTGGATGCT-3’,2Bd3-R(ABF)5’-TTCACAGGCGCAGAAAATGCT-3’,ABF3-F 5’-TTGATGGTGTGAGTGAGCAGC-3’,ABF3-R 5’-TGGCAAGAGTTGGACGTTGTG-3’,LBa1 5’-TGGTTCACGTAGTGGGCCATCG-3’;其他常规试剂均为国产分析纯.
1.3 试验方法
1.3.1 RT-PCR检测 按照 TaKaRa提供的 TR-izol使用方法提取南芥叶片RNA备用,使用one step RT-PCR对基因的转录产物进行基因表达鉴定.程序:50℃逆转录30 min,94℃终止反应2 min,94℃变性2 min,94℃变性 30 s,60℃退火30 s,72℃延伸70 s,28个循环,72℃延伸5 min.质量分数为1%琼脂糖凝胶电泳检测PCR产物.
1.3.2 种子萌发率 种子经春比后,在光照条件下培养1 d后,统计萌发率,每12 h统计1次,重复3次.
1.3.3 绿胚率统计 种子经光照培养16 d统计绿胚率,重复3次.
1.3.4 根长比率 拟南芥在1/2 MS培养基培养至长出2片子叶(约3 d),点种在1/2MS固体培养基正常板和含质量分数0.8%蔗糖的1/2MS固体培养基上,平板垂直培养8 d,测量主根长度.
1.3.5 气孔开度和开度率测定 3周龄叶片置于气孔开度溶液(KCl 50 mmol/L,CaCl250 μmol/L,MES 10mmol/L,pH 6.15)0.5 h,撕下叶片表皮立即放入固定液(V(无水乙醇)∶V(冰醋酸)=3∶1)中为对照叶片.处理叶片置于含10μmol/L ABA的气孔处理溶液1 h后固定,显微镜下拍照记录结果.
1.3.6 叶绿素含量测定 参照李合生等[4]的方法测定和计算叶绿素含量,单位为mg/g.
1.3.7 叶片黄化率统计 植株盐处理采用人工浇盐水的方式.选取规格一致的花盆装入质量相同的土,将在光照培养箱中生长至四片子叶的幼苗移栽入土中,每次实验处理中野生系和转基因系均为32株.在第3周,幼苗长到约12片叶时,进行即分别在第1、第 5、第 9 天分别浇 100、200、300 mmol/L 的NaCl溶液0.8 L,处理后第12~15天拍照,统计叶片黄化率.
1.3.8 盐胁迫叶片鲜重减少率统计 使用1.3.7中的植株,分别在盐处理第1、15天统计叶片莲座叶子鲜重,统计叶片鲜重变化率.
1.3.9 数据统计 数据结果通过Excel 2003分析,T检验双样本异方差分析.
2 结果与分析
2.1 突变体的鉴定筛选
根据abf3和abf4突变体的基因结构图谱(图1 A)为依据合成基因表达鉴定的引物,通过RT-PCR检测突变体中ABF3,ABF4基因表达的电泳图.abf3和abf4突变体株系中相应突变基因在基因表达鉴定中均表达缺失(图1B),表明基因组鉴定所得的abf3和abf4突变体植株为单基因缺失表达的纯合子,用于后续生理实验.

图1 abf3和abf4突变体的基因结构图谱(A)和分子鉴定(B)Figure 1 Schematic diagram(A)and molecular identification(B)of abf3 and abf4
2.2 突变体对外施ABA的响应
种子在光照条件下培养60 h后,abf3、abf4在没有ABA处理(对照)条件下,其萌发率与Col差别不明显,经 0.1、0.5、1.0 μmol/L ABA 处理的种子,萌发率均高于Col,均表现为对ABA不敏感,说明外源ABA抑制种子萌发通过ABF3和ABF4起作用(图2).
在正常生长条件下,拟南芥各株系绿胚率均为100%;abf3和abf4经1μmol/L ABA 处理16 d,其绿胚率高于Col(图3A),abf3绿胚率高于abf4植株,表明abf3和abf4显著降低对ABA的敏感性,ABF3基因在响应ABA信号途径中所起的作用比ABF4明显.
分析ABA处理12 d后突变体和野生型的根长比率,结果表明,用20μmol/L或50μmol/L ABA处理abf3的根长比率都显著高于Col;而20μmol/L ABA处理的abf4的根长比率与Col没有明显变化,但50μmol/L处理的abf4的根长比率低于Col(图3B).表明与ABF4比较,ABF3基因的根生长在响应ABA信号途径中起到更关键作用的结果.
abf3、abf4叶片经气孔开放乳液浸泡0.5 h后,其叶片的气孔开度均比Col略大,但无明显差异(图4A).10μmol/L ABA 浸泡1 h处理的 abf3、abf4气孔开率均比Col大,abf4气孔开率变化仅为10%左右.说明 abf3、abf4的气孔对 ABA的敏感性低于Col.ABF3、ABF4均参与ABA信号通路对气孔开度的调节,其中ABF4可能比ABF3起到更关键作用.
2.3 abf3和abf4突变体对盐胁迫响应
在含100 mmol/L NaCl的1/2MS的培养基培养16 d后,与在正常生长条件培养结果相比,abf3和abf4突变体的绿胚率比Col低,abf3对NaCl的相应程度高于abf4(图5).在150 mmol/L NaCl处理的abf3根长比率比Col高.当NaCl浓度为200 mmol/L时,abf3的根长比率高于Col,而abf4与Col无明显差异.总之ABF3对NaCl的敏感性.
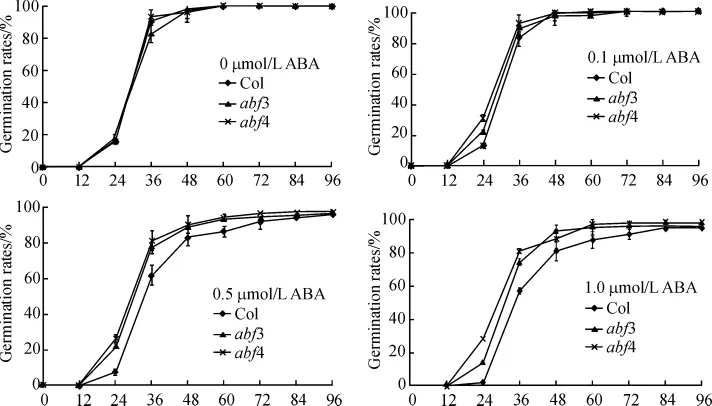
图2 不同浓度ABA处理对abf3和abf4突变体萌发率的影响Figure 2 Effect of applying ABA at different concentration on germination rates in abf3 and abf4 mutants
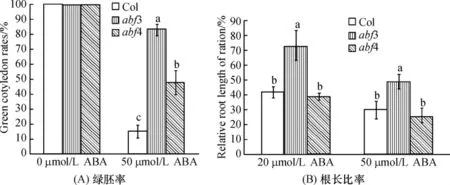
图3 不同浓度ABA处理对abf3和abf4突变体的绿胚率(A)和根长比率(B)的影响Figure 3 Effect of applying ABA on green cotyledon rates(A)and relative root length(B)in abf3 and abf4 mutants
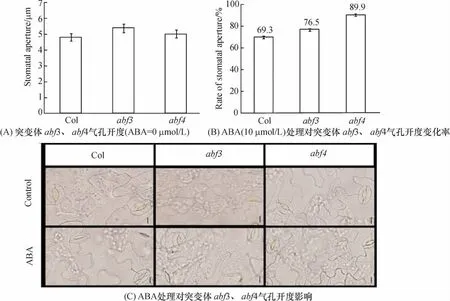
图4 ABA处理对突变体气孔开度的影响Figure 4 Effect of applying ABA on stomatal aperture in abf3 and abf4 mutants
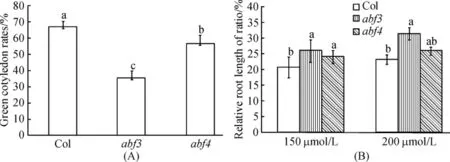
图5 NaCl处理对突变体的绿胚率(A)和主根长比率(B)的影响Figure 5 Effect of NaCl on green cotyledon rates(A)and relative root length(B)of the ABFmutants and wild-type plants
abf3和abf4突变体在100 mmol/L NaCl处理后叶片的叶绿素含量均大幅度降低,与野生型比较,abf3降低达到极显著水平,说明ABF3、ABF4突变体在拟南芥的抗盐性中发挥重要作用(图6).
拟南芥植株抽薹前在第1、第5、第9天分别用100、200、300 mmol/L 的 NaCl溶液进行根处理,3 次处理后第3~6 d,abf3、abf4植株叶片的黄化率均高于Col,且 abf3黄化现象极为明显(表1).盐处理的同时,称量第1天、第15天植株莲座叶的鲜重,abf3、abf4鲜重比正常条件下培养值明显降低,较Col极为明显(图7).

图6 NaCl处理对突变体叶绿素含量的影响Figure 6 Effectof NaCl on total chlorophyll contents inmutants and wild-type plants

表1 盐胁迫下突变体植株叶片黄化Table 1 Yellowing rates of 3-week-old plants under NaCl stress
3 讨论
目前认为AREB/ABF转录因子属于bZIP转录因子家族中的A亚族,N端含有3个保守的结构域(C1、C2、C3),C端前端包含1个高度保守的碱性亮氨酸拉链结构,结合DNA和其他蛋白,需要磷酸化修饰被激活[5].水稻在干旱和高盐胁迫下,存在类似的AREB/ABF调节因子并受到SnRK2磷酸化作用,其中 3个 SnRK2基因被 ABA激活[6].水稻AREB1类似基因TRAB1被SnRK2蛋白激酶家族成员SAPK磷酸化,通过迅速磷酸化响应ABA[7-8].

图7 NaCl处理下突变体叶片鲜重变化率Figure 7 Effect of NaCl on frash weight changing rate in mutants under high salt condition
本实验证实在abf3、abf4突变体植株中,叶片气孔不能关闭,对外施ABA信号不敏感.在突变体抗旱性分析实验中,发现abf3、abf4抗旱性均弱于Col植株,表现低抗旱性,可能与ABA的信号转导能力下降有关;KIM等[9]发现超表达 ABF3或 ABF4/AREB2诱导ABA的超敏感,可提高转基因植株的抗旱能力,与本实验结果一致.作者推测ABA应答因子如ABF3或ABF4等通过被SnRK2磷酸化调节蛋白活性,而ABF3或ABF4作为转录调节因子结合在rd29B、rab18、ICK1、ABI1等众多基因的启动子区域[9],调节气孔开闭,控制水分流失,抵御干旱.正常情况下,拟南芥中ABF3、ABF4在根、叶、花以及未成熟的果荚中均有表达,且根中表达量最高,但ABF3在叶中表达微弱,ABF4在叶中表达较高[10],推测可能也是abf3中,气孔开度变化较abf4大的原因.
在种子萌发和幼苗生长阶段,abf3和abf4突变体植株对ABA敏感性(萌发、绿胚)较Col弱,在根长方面,abf3突变株对 ABA敏感性显著降低,而abf4对ABA敏感性与Col无明显差异;TAKUYA和YOSHIDA 等[11]通过对 abf2、abf3、abf4 单突变、双突变以及三突变的生理表型分析认为在萌发及幼苗生长阶段,转录因子ABF3在ABA信号通路中起到关键作用.abf4对ABA的敏感性可能是由于ABF2与ABF4功能上的互补[12],与本实验结果基本一致.
abf3和abf4突变体对NaCl胁迫的敏感性大于Col,NaCl处理后突变体叶片叶绿素含量降低,黄化率增加,均表现出对盐胁迫的低抗性,其中abf3对盐的抗性较 abf4更低.推测 ABF3、ABF4作为SnRK2的底物被磷酸化,调控下游基因的表达,在这一过程中转录因子ABF3可能起着更关键的作用,有待深入研究.
[1]洪岚,刘旭,李玲.植物AREB/ABF转录因子及其参与的ABA信号转导[J].植物生理学报,2011,47(3):211-217.
[2]UNO Y,FURIHATA T,ABE H,et al.Arabidopsis basic leucine zipper transcription factors involved in an abscisic acid-dependent signal transduction pathway under drought and high-salinity conditions[J].Proc Natl Acad Sci USA,2000,97:11632-11637.
[3]CHOIH,HONG J,HA J,et al.ABFs,a family of ABA-responsive element binding factors[J].JBiol Chem,2000,275:1723-1730.
[4]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[5]FURIHATA T,MARUYAMA K,FUJITA Y,et al.Abscisic acid-dependent multisite phosphorylation regulates the activity of a transcription activator AREB1[J].Proc Natl Acad Sci USA,2006,103:1988-1993.
[6]KOBAYASHIY,YAMAMOTO S,MINAMIH,et al.Differential activation of the rice sucrose non fermenting1-related protein kinase2 family by hyperosmotic stress and abscisic acid[J].Plant Cell,2004,16:1163-1177.
[7]KAGAYA Y,HOBO T,MURATA M,et al.Abscisic acidinduced transcription is mediated by phosphorylation of an abscisic acid response element binding factor,TRAB1[J].Plant Cell,2002,14:3177-3189.
[8]KOBAYASHIY,MURATA M,MINAMIH,et al.Abscisic acid-activated SNRK2 protein kinases function in the gene-regulation pathway of ABA signal transduction by phosphorylating ABA response elementbinding factors[J].Plant J,2005,44:939-949.
[9]KANG JY,CHOIH I,IM M Y,et al.Arabidopsis basic leucine zipper proteins that mediate stress-responsive abscisic acid signaling[J].Plant Cell,2002,14:343-357.
[10]KIM S,KANG JY,CHO D I,etal.ABF2,and ABRE-binding bZIP factor,is an essential componentof glucose signaling and its overexpression affects multiple stress tolerance[J].Plant J,2004,40:75-87.
[11]YOSHIDA T,FUJITA Y,SAYAMA H,et al.AREB1,AREB2,and ABF3 are master transcription factors that cooperatively regulate ABRE-dependent ABA signaling involved in drought stress tolerance and require ABA for full activation[J].Plant J,2010,61:672-685.
[12]SCHLOQIPS,NOQUEIA F T,DRUMMOND R,etal.Identification of new ABA and MEJA-activated sugarcane bZIP genes by data mining in the SUCEST dat abase[J].Plant Cell Rep,2008,27:335-345.

