鸭新城疫病毒单克隆抗体的制备及双抗体夹心ELISA 方法的初步建立
孙敏华,董嘉文,吕殿红,周秀蓉,李林林,胡奇林
(广东省农业科学院兽医研究所 广东省公共卫生公共实验室,广东广州510640)
新城疫(Newcastle disease,ND)是由新城疫病毒(NDV)引起的一种严重危害养禽业的急性高度接触性传染病。早在1971年,Higgins D A[1]在香港发现9起鸭新城疫病毒感染的急性病例,并分离出高致病性的NDV。而自2000年后,我国分离鉴定的绝大多数鸭新城疫病毒对鸭的致死率在50%以上,对鸡的致死率可高达100%[2-4]。其中,部分毒株与水禽新城疫病毒关系密切[5]。由于NDV宿主范围广泛,且目前高致病性毒株所占比例大,给养禽业带来了巨大的威胁。
目前,新城疫的确诊主要依靠病毒的分离鉴定,该法准确、特异,但相对费时费力。ELISA方法能进行批量检测、速度快,适合于基层兽医和动物检疫部门使用。1995年,吴红专等研制出新城疫单抗夹心ELISA试剂盒,临床样本的检测结果表明其阳性符合率达100%[6]。也建立了针对甲型H1N1流感病毒及鹿流行性出血病病毒的双抗体夹心ELISA方法[7-8]。鉴于此,本研究制备了抗鸭新城疫病毒单克隆抗体,建立了单抗夹心ELISA方法,为快速诊断鸭新城疫奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞系 1.5kg清洁级新西兰兔和6周~8周龄Balb/c雌性小鼠购自南方医科大学实验动物中心,骨髓瘤细胞SP2/0由华南农业大学郭霄峰教授惠赠。
1.1.2 试剂 HAT选择培养基、DMEM培养基为Gibco公司产品;HT培养基为Invitrogen公司产品;PEG 1450为Sigma公司产品;蛋白分子量标准Fermentas公司产品;胎牛血清为杭州四季青生物有限公司产品;HRP标记的羊抗鼠二抗为Proteintech公司产品;HRP标记的羊抗兔二抗和弗氏佐剂为鼎国生物有限公司产品;禽流感H5、H9标准阳性抗原为哈尔滨维科生物技术开发公司产品;ELISA反应板为Corning公司产品。
1.2 方法
1.2.1 抗原的制备 鸭新城疫病毒由广东省农业科学院兽医研究所禽病研究室鉴定、保存。经尿囊腔接种于12日龄鸭胚,收集24h后死亡的鸭胚尿囊液,经差速和蔗糖密度梯度离心纯化,测定蛋白含量,保存于-70℃,用作免疫抗原和包被抗原。
1.2.2 ELISA筛选方法的建立 参照文献[9]选择6周龄雌性Balb/c小鼠进行免疫,采集血清。将Balb/c小鼠阳性血清和阴性血清均作倍比稀释,同时设立SP2/0细胞培养上清及空白对照,选择OD490nm值在1.0左右,P/N比值最大的抗原稀释浓度为最适工作浓度。
1.2.3 单克隆抗体及腹水的制备、筛选和鉴定 按照常规方法融合[9],用ELISA方法筛选阳性克隆,进行亚克隆及腹水制备。制备鸭胚成纤维细胞,参考文献[9]进行单抗中和活性的测定。取细胞培养上清单克隆抗体,按照 Mouse MAb Isotyping Kit(Hycult Biotech)说明书进行亚类鉴定。测定单抗亚类后,用间接ELISA方法测定腹水效价。
1.2.4 单克隆抗体的特异性 将传染性支气管炎病毒 (IBV)、禽 呼 肠病毒 (ARV)、鹅 细 小病毒(GPV)、鸭肝炎病毒(DHV)、鸭瘟病毒(DPV)、NDV LaSota株、F48E9株尿囊液以及禽流感H5、H9标准阳性抗原按1∶10稀释后包被ELISA反应板,应用ELISA方法进行测定。
1.2.5 双抗体夹心ELISA方法的初步建立及其特异性、敏感性和重复性试验 用PEG沉淀法[10]对2C1腹水进行纯化;用辛酸-硫酸铵沉淀法[11]对兔抗鸭新城疫病毒血清进行纯化,测定蛋白含量,用SDS-PAGE鉴定纯度。分别以纯化的单抗和多抗为包被抗体,进行双抗体夹心ELISA,以确定最佳包被抗体。以方阵法确定抗体、抗原最佳工作浓度、作用时间等。特异性试验是以DPMV尿囊液作为阳性对照,正常鸡胚、鸭胚尿囊液为阴性对照,对IBV、ARV、GPV、DHV、DPV 的尿囊液及 H5、H9标准阳性抗原进行ELISA检测。敏感性试验是将DPMV尿囊液作1∶5~1∶5 120稀释,分别测定其血凝活性及ELISA效价,以确定该方法的敏感性。重复性试验是将DPMV阴、阳性尿囊液分别按1∶10、1∶20稀释,各做3个重复,统计数据计算批内变异系数;在不同时间重复3次该试验,统计数据计算批间变异系数。
1.2.6 双抗体夹心ELISA方法检测临床样品时阴阳性判定标准的确定 以双抗体夹心ELISA方法检测30份NDV非免疫鸡的泄殖腔拭子样品,根据统计学原则,样本的OD490nm值>阴性样本OD均值(¯X)+3×SD时,可以在99.9%的水平上判定为阳性。
1.2.7 人工感染样品的检测 取DPMV尿囊液1∶10稀释后人工滴鼻感染3只6周龄SPF鸡,每只0.2mL。分别于感染后1d~7d,采集对照组和感染鸡的泄殖腔拭子于2mL PBS中,挤压拭子后,5 000r/min离心5min,取0.1mL上清用ELISA方法检测,同时平行取0.3mL上清用双抗处理后,接种SPF鸡胚制备的成纤维细胞单层进行病毒分离,每份样品接3孔细胞,每孔0.1mL。病毒鉴定采用血凝和血凝抑制试验。
2 结果
2.1 抗原的制备
感染鸭胚尿囊液经高速离心沉淀,蔗糖密度梯度纯化,取出40%~60%之间的白色病毒层,脱糖后,将沉淀溶于3mL PBS中,紫外分光光度计测得病毒的蛋白含量为6.52mg/mL。
2.2 单克隆抗体的筛选及其特性测定
当包被的病毒量为0.8μg/孔,阳性鼠血清1∶800稀释,羊抗鼠二抗1∶10 000倍稀释时,P/N比值最大,且阳性值最接近1.0。因此,选择该条件下的抗原包被量和二抗作用浓度来筛选单克隆抗体。细胞融合后,经ELISA筛选,选取P/N>3.0的细胞孔,用有限稀释法克隆3次后,获得一株稳定的杂交瘤细胞株,命名为2C1。特异性试验表明,2C1不与IBV、ARV、GPV、DHV、DPV尿囊液以及禽流感H5、H9标准阳性抗原发生交叉反应,但与新城疫病毒La Sota株、F48E9株尿囊液发生反应;中和试验结果表明,该株单抗没有中和活性;抗体亚类鉴定表明,该单克隆抗体重链为IgM,轻链为κ链(图1)。杂交瘤细胞株2C1所制备的腹水ELISA效价大于1∶64 000。

图1 单克隆抗体2C1亚类鉴定结果Fig.1 Subtype identification of monoclonal antibody 2C1
2.3 双抗体夹心ELISA方法的初步建立
2C1腹水用120g/L的PEG6000溶液沉淀两次。兔抗NDV血清经辛酸-硫酸铵沉淀法纯化、透析、离心后,与纯化前的腹水和多克隆抗体进行SDS-PAGE后发现,纯化后的抗体在凝胶中均呈现出重链和轻链两条特异性的条带,且大小与预期相符(图2)。ELISA试验表明,以纯化后的2C1腹水作为包被抗体,兔抗DPMV多克隆抗体为第二抗体,其P/N值高,且阴阳性区别明显。方阵试验结果表明,当纯化后的单抗包被量为4μg/孔,鸭副黏病毒尿囊液1∶10稀释,兔抗鸭副黏病毒多克隆抗体浓度为0.1μg/孔,HRP标记的羊抗兔二抗1∶10 000倍稀释,每种组分作用1h时,P/N值最大,条件最优。
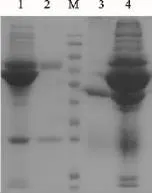
图2 单抗2C1及抗NDV兔血清纯化前后SDS-PAGE电泳比较结果Fig.2 The comparison of SDS-PAGE results of the unpurified and precipitated monoclonal antibody 2C1and polyclonal antibody against duck NDV
2.4 双抗体夹心ELISA方法特异性、敏感性和重复性的确定
在最佳工作条件下,IBV、ARV、GPV、DHV、DPV的尿囊液以及禽流感H5、H9标准阳性抗原的OD490nm值最高为0.122,与阴性对照的比值小于2,特异性良好(表1)。倍比稀释后的尿囊液HA效价为1∶10,ELISA效价(按P/N>3.0计算)为1∶640,因此判定ELISA方法敏感性至少比HA高64倍(表2)。纯化的鸭副黏病毒稀释后,ELISA至少可以检测到0.2μg的病毒(表3)。重复性试验表明,两个稀释度抗原的批间重复变异系数为5.22%~9.15%,批内重复的变异系数为2.03%~5.34%。
2.5 双抗体夹心ELISA方法检测临床样品时阴阳性判定标准的确定
30份未免疫新城疫疫苗的鸡泄殖腔拭子ELISA检测平均OD值为0.130,标准差为0.038,计算可得,当样品的OD490nm值大于0.244时,可判定为阳性。
2.6 人工感染样品的检测结果
根据ELISA阴阳性判定标准判定,1号鸡第4天和第5天拭子检测结果为阳性;2号鸡无阳性结果;3号鸡攻毒后第3、第4、第5天检测结果阳性。这些ELISA阳性检测结果中,1号和2号的检测结果与病毒分离相符合,而第3号鸡攻毒后的第3天和第6天检测结果与病毒分离不符。综合计算,ELISA检测结果与病毒分离的总符合率为91.7%(表4)。

表1 双抗体夹心ELISA特异性检测结果Table 1 The specificity of the sandwich ELISA

表2 HA和双抗体夹心ELISA检测鸭新城疫病毒结果比较Table 2 The results of HA test and the sandwich ELISA for detecting the duck NDV

表3 双抗体夹心ELISA方法敏感性试验Table 3 The sensitivity of the sandwich ELISA
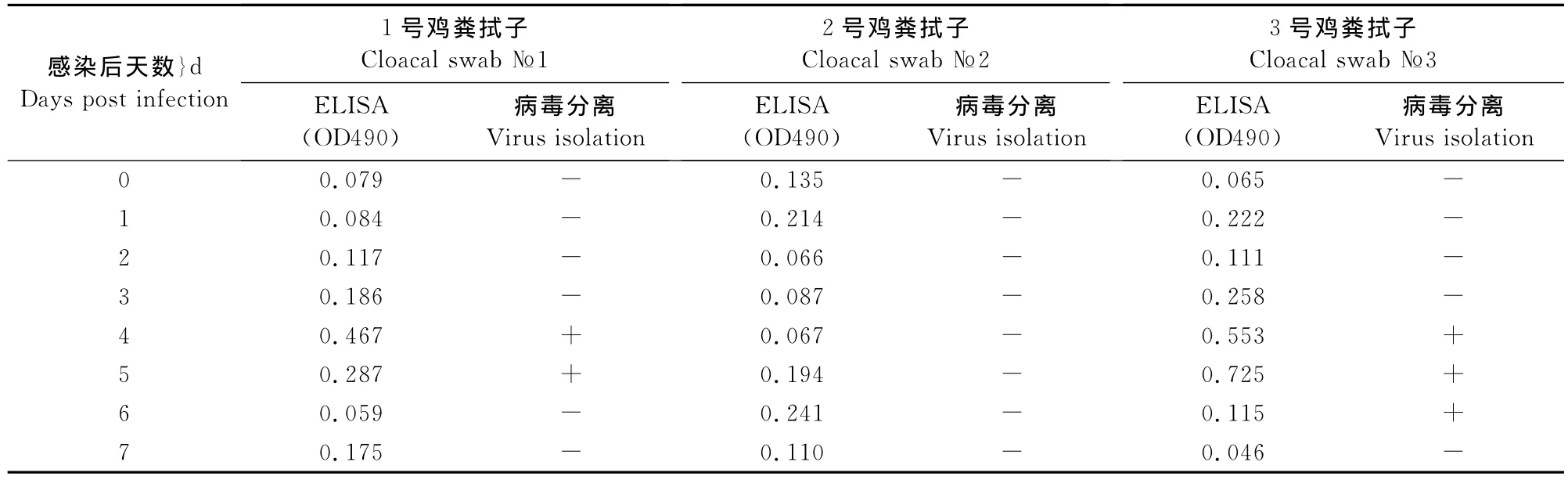
表4 人工感染样品ELISA检测结果Table 4 The detective results of experimentally infected chickens by sandwich ELISA
3 讨论
本研究采用蔗糖密度梯度离心法纯化了鸭新城疫病毒,利用淋巴细胞杂交瘤技术,获得了一株抗鸭新城疫病毒单克隆抗体2C1的杂交瘤细胞株。单抗筛选采用了全病毒包被的间接ELISA方法,扩大了筛选范围。2C1经中和试验后,发现其不具有中和活性,因此在后续制备具有中和活性的单抗时用HI试验筛选可能会获得理想的结果。经ELISA检测,2C1腹水的ELISA效价大于1:64 000,且与其他禽类病毒无交叉反应,证明其特异性良好,可以用于后续夹心ELISA方法的建立。单克隆抗体亚类鉴定结果表明2C1的重链为IgM。由于IgM通常以五聚体的形式存在,且容易聚集,在高盐和低盐溶液中溶解度都不高,因此纯化方法有别于IgG。Mahassni S H等[13]研究发现,细胞培养上清中抗牛凝血素的小鼠IgM单抗最佳的纯化方法是离子交换层析,而腹水中的最佳纯化方法是G-100凝胶过滤。曹军平等[10]研究发现利用PEG6000沉淀法纯化的单抗较纯净,且活性损失少。综合成本和时间因素,本研究选用PEG沉淀法进行2C1腹水的纯化。而鸭新城疫病毒多克隆抗体的纯化,本研究参考 McKinney M M 等[11]和曹军平等[10]的研究,选择了辛酸-硫酸铵法进行了纯化。对纯化前后的样品进行SDS-PAGE(图2),结果显示纯化效果良好,去除了杂蛋白,且重链和轻链分子量大小符合预期。
在选择夹心ELISA中的包被抗体时,用纯化后的腹水2C1和纯化的鸭新城疫病毒多克隆抗体分别包被酶标板,进行ELISA预试验。结果表明,当2C1作为包被抗体,抗鸭新城疫病毒多克隆抗体作为第二抗体时,才能获得较高的P/N值。方阵试验表明,当2C1包被浓度为4μg/孔,鸭新城疫病毒尿囊液1∶10稀释,抗鸭新城疫病毒多克隆抗体作用浓度为0.1μg/孔,HRP标记的羊抗兔酶标抗体1∶10 000倍稀释,每种成分作用1h时,P/N比值最高。特异性试验表明所建立的鸭新城疫病毒检测方法不与IBV、ARV、GPV、DHV、DPV 发生交叉反应。该ELISA方法比传统HA试验方法至少敏感64倍,可以检测出0.2μg的纯化病毒。吴红专等[6]研 制 的 PEG-ELISA 试 剂 盒 的 敏 感 性 为0.25ng~0.5ng的纯化病毒,比本研究的结果高出800倍,这可能与单抗亲和力及PEG具有沉淀免疫复合物的作用有关。因此,高亲和力的单抗是试剂盒研制成功的关键。
小样本人工感染样本检测结果表明,本研究所建立的夹心ELISA方法与病毒分离的符合率为91.7%。由于所取样本有限,后续试验需扩大样本检测数量,以便评价本研究建立方法的实用性。ELISA和病毒分离的结果表明,感染后的SPF鸡排毒高峰在3d~5d,这与文献报导类似[14]。由于双抗体夹心ELISA试验中参与反应的成分多,非特异性反应很难完全消除。本研究在检测含大量粪便的拭子时,ELISA检测结果存在偏高的现象,其原因尚待进一步研究。目前,能够进行鉴别诊断的单抗夹心ELISA方法尚不多见[6,15],且 ELISA 呈阳性者不全是强毒力株,还有中等毒毒力株或弱毒力株[16]。因此,鉴别诊断ELISA方法是今后研究的重点。
[1] Higgins D A.Nine disease outbreak associated with myxoviruses among ducks in Hongkong[J].Trop Anim Health Prod,1971,5:232-240
[2] 张训海,朱鸿飞,陈溥言,等.鸭副粘病毒强毒株的分离和鉴定[J].中国动物检疫,2001,18(10):24-26.
[3] 陈少莺,胡奇林,陈仕龙,等.鸭副粘病毒的分离与初步鉴定[J].中国预防兽医学报,2004,26(2):118-120.
[4] 王耀邦,楼忠宝.番鸭副粘病毒病的实验室诊断与病毒分离鉴定[J].浙江畜牧兽医,2008(3):30-31.
[5] 张青娴,李 银,张敬峰,等.鸭源副粘病毒Y03株F基因的克隆及序列分析[J].江苏农业学报,2006,22(4):421-424.
[6] 吴红专,张如宽,刘秀梵.新城疫单抗ELISA试剂盒的研制及其初步应用[J].中国兽医科技,1995,26(5):3-6.
[7] 王云龙,周春峰,孙新城,等.甲型H1N1流感病毒双抗体夹心ELISA检测方法的初步建立[J].动物医学进展,2011,32(8):37-41
[8] 陈 兵,李健波,杨俊兴,等.鹿流行性出血病病毒双抗夹心ELISA方法的建立[J].动物医学进展,2011,32(10):1-5.
[9] 殷 震,刘景华.动物病毒学 [M].北京:科学出版社,1997:744.
[10] 曹军平,闫桂玲,刘秀梵,等.两种简易高效的单克隆抗体提纯方法[J].单克隆抗体通讯,1995,11(2):52-54.
[11] McKinney M M ,Parkinson A.A simple,non-chromato-graphic procedure to purify immunoglobulins from serum and ascites fluid[J].J Immunol Meth,1987,96(2):271-278.
[12] 张姝慧.禽流感病毒H5、H9亚型单抗及ELISA鉴别诊断方法的研究和应用[D].湖北武汉:华中农业大学,2005.
[13] Mahassni S H,Klapper D G ,Hiskey R G.Purification of a murine IgM monoclonal antibody[J].Hybridoma,2009,28(3):189-197.
[14] 张太翔,张金玲,田国宁,等.鸭群感染禽副粘病毒后的排毒规律[J].中国动物检疫,2008,25(9):39-40.
[15] 陈昌海,张如宽,刘秀梵.用单抗夹心ELISA自免疫鸡群检测新城疫强毒[J].中国畜禽传染病,1993(4):28-31.
[16] 蒋凤英,胡建华,倪建平,等.单抗夹心ELISA检测免疫鸡群新城疫病毒[J].上海交通大学学报:农业科学版,2002,22(3):286-289.

