皮肤汗腺癌临床诊治分析
李涛 吴伟 * 金谷 孙才兴 孟旭莉
浙江省肿瘤医院骨和软组织肿瘤外科,* 病理科,浙江 杭州 310022
皮肤汗腺癌是一种临床少见的皮肤恶性肿瘤,由于病例数均较少,其诊断、治疗及预后等还尚不明确。本研究对2001年2月—2012年5月期间浙江省肿瘤医院骨和软组织肿瘤外科收治的33 例皮肤汗腺癌患者的临床资料进行分析,讨论其临床病理特征、治疗及预后等。
1 资料和方法
1.1 一般资料
对2000年2月—2012年5月浙江省肿瘤医院收治的33例皮肤汗腺癌患者进行回顾性分析。起始入组39例,经病理复习排除6例后共33例。入组患者年龄29~82岁,中位年龄62岁,男性18例,女性15例,发病部位为头面部12例,腋下4例,上肢4例,会阴部7例,下肢2例,肩部1例,背部1例,腹股沟区1例,臀部1例 (表1)。
1.2 临床表现
本组33例患者中,大多数患者的肿瘤最常见表现为无痛性的肿块,红色或多种颜色,到诊断时病史为2个月至40年,随着肿块的增大多出现破溃,会阴部的病变也以瘙痒或局部溃破为主要症状。
1.3 治疗情况
32例患者行手术治疗,行切缘2~5 cm的广泛切除,术后切口不能直接缝合予植皮的患者有10例,局部皮瓣转移修复的有2例。13例患者行区域淋巴结清扫术。3例患者行术后放疗(50~60 Gy),2例术后化疗,其中1例因肺和骨转移行化疗,1例为多次术后复发并出现腹股沟淋巴结转移行化疗。化疗方案主要是以异环磷酰胺、表柔比星、氮烯咪胺为基础的联合化疗方案(表1)。
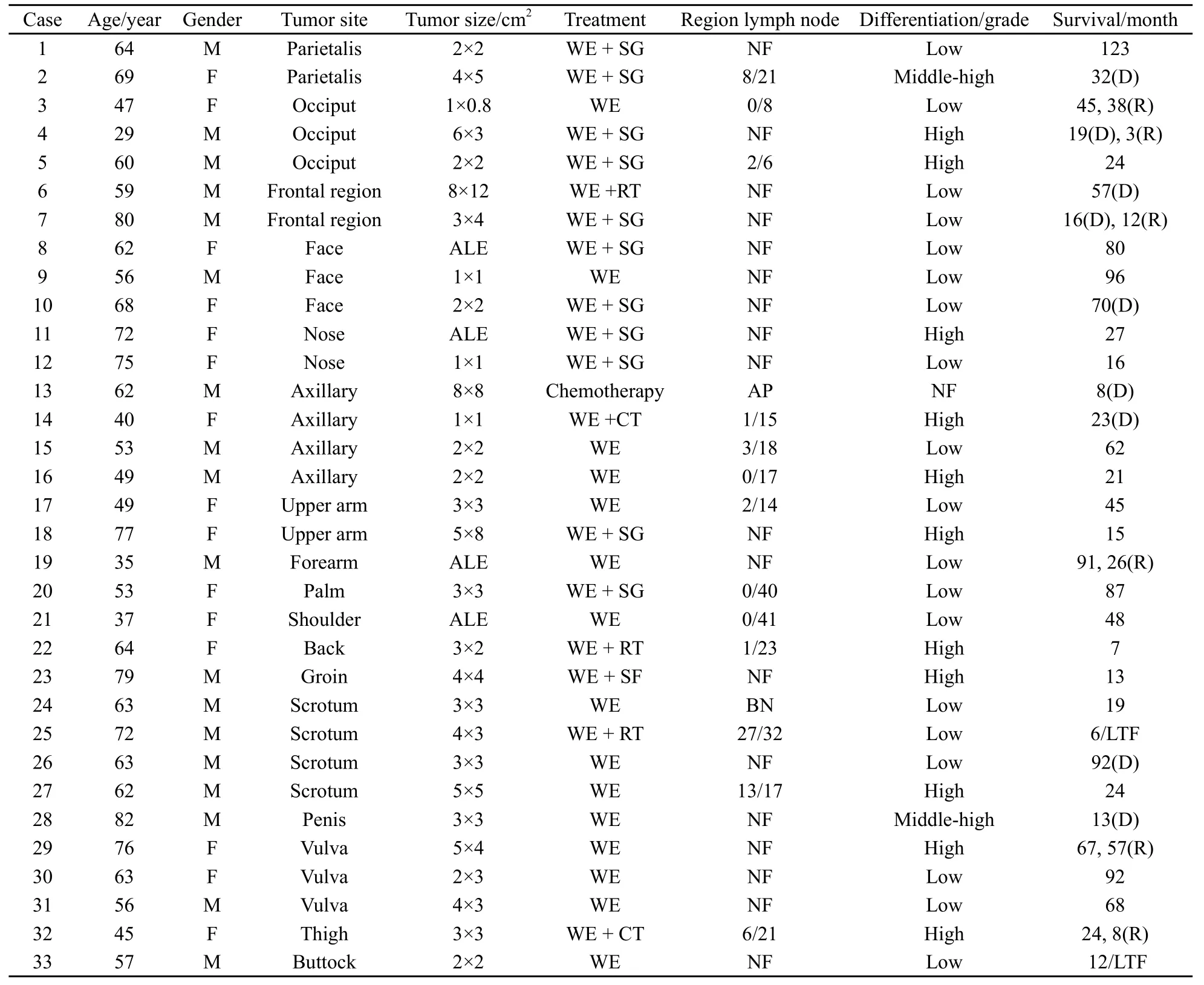
表1 33例汗腺癌的临床特点Tab.1 Clinicopathological characteristics of 33 patients with HCC-EHPM
1.4 病理诊断
所有病例均经浙江省肿瘤医院病理科确诊,组织学特征是乳头状、实性或弥漫性生长的肿瘤细胞集中于真皮深层,并常累及皮下脂肪(图1A);可类似于乳腺导管癌,出现粉刺状坏死(图1B);瘤细胞异型,细胞质丰富、嗜伊红,细胞核圆形或卵圆形,可见明显核仁(图1C)及核分裂(图1D);肿瘤分化差时,细胞间无粘附性,类似组织细胞,呈单个分布,并可混杂较多炎症细胞(图1E),浸润范围广时可见周围神经侵犯(图1F);部分病例表皮可以出现播散型Paget样网状细胞增生病的特点。
1.5 随访
通过门诊、信件及电话随访。生存时间定义为诊断之日至末次随访或死亡时间。
1.6 统计学处理
应用SPSS 13.0统计软件包处理数据,生存率计算采用Kaplan-Meier,生存比较采用Logrank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 淋巴结转移情况
在13例行淋巴结清扫的患者中,9例出现淋巴结转移(69.2%),其中大部分就诊时临床上已有肿大淋巴结,初次治疗未行淋巴结清扫术患者有2例在随访期间出现淋巴结转移。
2.2 局部复发及转移情况
本组中6例出现术后复发,复发时间为3~57个月,中位时间为19个月。1例就诊时即发生肺和骨转移,1例术后13个月出现肺转移,1例术后3年出现复发并伴肝转移。
2.3 生存率分析
截至随访至2012年5月,全组31例患者获得随访,2例失防,随访6~73个月,中位随访38个月。
本组患者5年总生存率为70.0%,无复发生存率为57.0%,原发肿瘤高分化组与低分化组的生存率分别为78.9%和69.2%(P=0.028,图2),无复发生存率分别为73.7%和53.8%,差异有统计学意义(P=0.002,图3)。因只有部分病例行淋巴结清扫术,故未对淋巴结转移状况进行比较。

图1 汗腺癌组织学特点Fig.1 Histopathological features of HC of sweat gland carcinoma

图2 原发肿瘤高分化组和低分化组生存率曲线图Fig.2 Overall survival curves of different differentiated primary tumor

图3 高分化组和低分化组无复发生存率生存率曲线图Fig.3 Relapse free survival curves of different differentiated primary tumor
3 讨 论
汗腺癌是一种少见的皮肤附件恶性肿瘤,易发生于多种部位,最常见于面部、腋窝和上肢,多发生于中老年人,50~70岁为发病高峰[1-3]。此外,该病缺乏大宗研究报道,病理研究报道较多,而临床研究相对较少。该病临床表现多为皮下无痛性生长缓慢的单发肿块,呈红色或多种颜色。肿瘤部位出现的溃疡少见[4]。本研究报道的肿瘤增大后多出现破溃,与报道相似[4]。
手术治疗是汗腺癌的首选治疗,多数学者认为切缘距原发灶应在2 cm以上,切除的边缘组织需要进行病理诊断或者术中需对切缘送冰冻检查以提高切除的彻底性。因原发灶切除后不能直接缝合,可给予植皮及局部皮瓣转移修复。Wick等[1]报道,尽管经过广泛的切除,约80%的汗腺癌患者仍会出现1次或多次的局部复发,约56%的患者有多次复发病史,但复发与远处转移无相关性。
汗腺癌的淋巴结转移率高,区域淋巴结的清扫仍有争议,El-Domeiri等[5]报道的39例汗腺癌患者中,19例患者出现复发,28例在原发灶切除术后出现淋巴结转移,转移和复发与原发灶的级别有一定的关系,提示应考虑在原发灶诊断时区域淋巴结的情况,在低级别的病变切除区域淋巴结对生存率有无改变。Chamberlain等[6]认为,目前没有明确的证据表明淋巴结清扫有效。Wong等[7]认为,如果临床有可触及的肿大淋巴结,建议行淋巴结清扫术。Morris等[4]报道,淋巴结清扫应考虑原发病灶的分化程度和淋巴结受累的情况。本研究中,低分化的患者淋巴结转移率也较高。笔者认为,在没有前哨淋巴结活检条件的单位,可行B超、CT、PET/CT、B超下细针穿刺等手段提高淋巴结的检出率,再结合原发灶的分化程度来决定是否行淋巴结清扫术。但以上检查会遗漏亚临床病灶。Delgado等[8]对6例汗腺癌患者进行前哨淋巴结活检,结果显示,4例患者前哨淋巴结为阳性,其中1例发生于颈部的汗腺癌有双侧的前哨淋巴结均为阳性,因此认为前哨淋巴结活检在高淋巴结转移率的汗腺癌中是一个有用的分期工具。
放化疗治疗汗腺癌的报道较少,虽然缺乏临床随机研究的报道,但目前认为放化疗对汗腺癌的疗效不佳。Harari等[9]对淋巴结阴性而切缘阳性的患者进行术后放疗,3年后无复发,对2例局部复发的病例的原发灶予以70 Gy和区域淋巴结予以50 Gy的治疗。虽然1例出现完全缓解,但另1例疾病未得到控制并死亡。Yugueros等[10]报道,对2例分化差的汗腺癌行术后辅助放疗,无局部复发,对5例术后复发的患者进行放疗,有3例患者死于远处转移。
汗腺癌化疗的疗效和具体的有效药物目前尚不明确,也多为个例报道,Morris等[4]报道,对1例有转移性的汗腺癌患者行环磷酰胺+5-FU+氮烯咪胺的化疗,结果无效。Mertens等[11]对1例有广泛汗腺癌的患者行环磷酰胺+顺铂+氮烯咪胺的化疗,维持完全缓解达1年。Gutermuth等[12]对1例67岁伴有局部复发和区域淋巴结转移的患者行紫杉醇结合干扰素治疗。经治疗肿瘤稍有缩小。本组中有1例患者因肺和骨转移行化疗,另有1例因多次术后复发并出现腹股沟淋巴结转移行化疗。化疗方案为异环磷酰胺、表柔比星、氮烯咪胺为基础的联合方案,但均未获得部分缓解的结果。Schroder等[13]报道,部分汗腺癌雌激素受体(estrogen receptor,ER)为阳性,对1例64岁ER阳性的转移性汗腺癌的女性患者行他莫昔芬治疗,完全缓解达3年。
文献报道汗腺癌的预后主要与就诊时原发病灶的分化程度和淋巴结转移的状况有关,分化差的汗腺癌预后差[14]。El-Domeiri等[5]报道淋巴结阴性和淋巴结阳性的患者10年生存率分别为9%和56%。本组中原发肿瘤高分化的患者的生存率和无复发生存率均优于低分化患者,因此在治疗过程中对分化差的汗腺癌的侵袭性要有充分的准备,以便能够更好地治疗该疾病。
[1] WICK M R, GOELLNER J R, WOLFE J T 3rd. Adnexal carcinomas of the skin. Ⅰ. Eccrine carcinomas[J]. Cancer,1985, 56(5): 1147-1162.
[2] HOU J L, WU L Y, ZHANG H T, et al. Clinicopathologic characteristics of 12 patients with vulvar sweat gland carcinoma[J]. Int J Gynecol Cancer, 2010, 20(5): 874-878.
[3] KIM Y M, KIM J W, OH D E. A case of histiocytoid variant eccrine sweat gland carcinoma of the orbit[J]. Korean J Ophthalmol, 2011, 25(1): 54-56.
[4] MORRIS D M, SANUSI I D, LANEHART W H. Carcinoma of eccrine sweat gland: experience with chemotherapy, autopsy findings in a patient with metastatic eccrine carcinoma, and a review of the literature[J]. J Surg Oncol, 1986, 31(1): 26-30.
[5] EL-DOMEIRI A A, BRASFIELD R D, HUVOS A G, et al.Sweat gland carcinoma: a clinico-pathologic study of 83 patients[J]. Ann Surg, 1971, 173(2): 270-274.
[6] CHAMBERLAIN R S, HUBER K, WHITE J C, et al. Apocrine gland carcinoma of the axilla[J]. Am J Clin Oncol, 1999,22(2): 131-135.
[7] WONG T Y, SUSTER S, NOGITA T, et al. Clear cell eccrine carcinomas of the skin. A clinicopathologic study of nine patients[J]. Cancer, 1994, 73(6): 1631-1643.
[8] DELGADO R, KRAUS D, COIT D, et al. Sentinel lymph node analysis in patients with sweat gland carcinoma[J]. Cancer,2003, 97(9): 2279-2284.
[9] HARARI P M, SHIMM D S, BANGERT J L, et al. The role of radiotherapy in the treatment of malignant sweat gland neoplasms[J]. Cancer, 1990, 65(8): 1737-1740.
[10] YUGUEROS P, KANE W J, GOELLNER J R. Sweat gland carcinoma: a clinicopathologic analysis of an expanded series in a single institution [J]. Plast Reconstr Surg, 1998,102(3): 705-710.
[11] MERTENS W C, SHUM D T, GILCHRIST J A.Adenocarcinoma of the eccrine sweat gland: response to both combination chemotherapy and local field irradiation[J].Euro J Cancer, 1996, 32(2): 372-373.
[12] GUTERMUTH J, AUDRING H, VOIT C, et al. Antitumor activity of paclitaxel and interferon-alpha in a case of metastatic eccrine porocarcinoma[J]. J Eur Acad Dermatol Venereol, 2004, 18(4): 477-479.
[13] SCHRODER U, DRIES V, KLUSSMANN J P, et al. Successful adjuvant tamoxifen therapy for estrogen receptor-positive metastasizing sweat gland adenocarcinoma: need for a clinical trial[J]. Ann Otol Rhinol Laryngol, 2004, 113(3 Pt 1): 242-2444.
[14] HALL J, KNEE G A, HERN R P, et al. Sweat-gland tumors: A clinical review of cases in one center over 20 years[J]. Clin Oncol, 2006, 18(4): 351-359.

