不同毒力猪繁殖与呼吸综合征病毒对仔猪肺和外周免疫器官损伤的研究
何玉利,刘永刚,王 刚,石文达,武嘉男,刘 鹤,2,董建国,韩梓峰,2,姜成刚,田志军,蔡雪辉*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物疫病诊断中心,黑龙江哈尔滨150001;2.东北农业大学,黑龙江哈尔滨150001)
猪繁殖与呼吸综合征(Porcine respiratory and reproductive syndrome,PRRS)是由PRRS病毒(PRRSV)感染引起的怀孕母猪流产、早产、死胎及仔猪呼吸系统症状的疾病。该病于1987年首次出现于美国,此后呈全球性流行,给世界养猪业造成了严重的经济损失。郭宝清等于1996年首次在国内某猪场分离到PRRSV,并命名为CH-1a株[1]。2006年,我国南方暴发了“猪高热病”,主要症状为持续性高热,具有高发病率和高死亡率。研究表明其病原为PRRSV变异株,与经典株相比,变异株在NSP2基因中存在两处共30个氨基酸的缺失[2]。
PRRSV感染可造成机体免疫器官损伤,中和抗体产生时间较晚,并在扁桃体、淋巴结等外周免疫器官中呈持续性感染[3]。本实验的目的是比较研究PRRSV变异毒株与PRRSV经典毒株对肺脏及外周免疫器官的损伤状况,为进一步探索PRRSV感染的致病机理提供实验依据。
1 材料和方法
1.1 病毒株、质粒及实验动物 PRRSV变异毒株HuN4-F5和PRRSV经典毒株CH-1a-F19由本实验室保存:病毒含量均为3×105.0TCID50/mL;荧光定量RT-PCR所需的标准阳性质粒由韦天超博士提供;45头35日龄的健康断奶仔猪购自哈尔滨五方猪场。
1.2 主要试剂 总RNA抽提试剂盒购自上海生工生物工程技术服务有限公司;PRRSV N蛋白抗体检测试剂盒购自IDEXX公司;LIVTEST SUIS PRRS抗体检测试剂盒购自LSI公司;禽源反转录酶(AMV)、RNA酶抑制剂、ExTaqDNA聚合酶(Hot Start Version)购自TaKaRa公司。
1.3 实验设计 45头35日龄的健康断奶仔猪,经RT-PCR和ELISA检测均为PRRSV阴性,随机分为3组,每组15头。分别接种PRRSV HuN4株(3×105.0TCID50/mL)、PRRSV CH-1a 株(3×105.0TCID50/mL)和PBS,接种途径均为肌肉注射1 mL、滴鼻2 mL。实验期间每日观察临床症状并测量直肠温度,分别于感染后的0 d、3 d、5 d、7 d、10 d、12 d和14 d采血,并在感染后0 d、3 d、7 d、10 d和14 d迫杀,每组3头,观察肺脏、脾脏、扁桃体、颌下淋巴结、腹股沟淋巴结、肠系淋巴结等组织的病理变化情况。
1.4 病理组织学观察 剖检时取肺脏、脾脏、扁桃体、颌下淋巴结、腹股沟淋巴结、肠系淋巴结置于10%中性福尔马林溶液中固定,常规石蜡切片,HE染色,光镜观察组织病理学变化。
1.5 病毒RNA的提取及反转录 病料及血清RNA的提取按照总RNA抽提试剂盒说明书进行。利用随机引物进行反转录,程序为:25℃10 min、42℃60 min、0℃ 2 min。
1.6 荧光定量RT-PCR方法检测组织中病毒载量按照文献[5]的方法进行。
1.7 PRRSV感染仔猪血清抗体水平检测 采用IDEXX抗体检测试剂盒检测PRRSV N蛋白抗体,抗体水平用S/P值表示:当S/P值≥0.4时为阳性,S/P值<0.4时为阴性;LIVTEST SUIS PRRS试剂盒检测PRRSV囊膜蛋白抗体,抗体水平用IRPC值表示,当IRPC值>20时为阳性,IRPC值≤20时为阴性。试验操作均严格按照试剂盒说明书进行。
2 结 果
2.1 临床症状 HuN4感染组:病毒感染后4 d体温明显上升,达40.5℃,5 d~8 d达到峰值,最高达41.3℃,之后逐渐下降,但实验结束前一直高于40℃(图1)。临床症状:病毒接种后后4 d开始出现精神沉郁、食欲下降,并伴有咳嗽打喷嚏;7 d后仔猪喜卧、聚堆、皮肤潮红;10 d后部分仔猪耳部,腹部及尾部发绀,体温开始下降。整个试验过程中死亡6头,死亡率为40%。CH-1a感染组:感染后5 d体温一过性升高到40.5℃,随后下降,个别猪在感染后5 d~7 d表现为食欲下降等一过性反应,但整个实验期内精神状态良好,没有出现仔猪死亡。对照组:整个试验过程中体温和精神状态均正常。
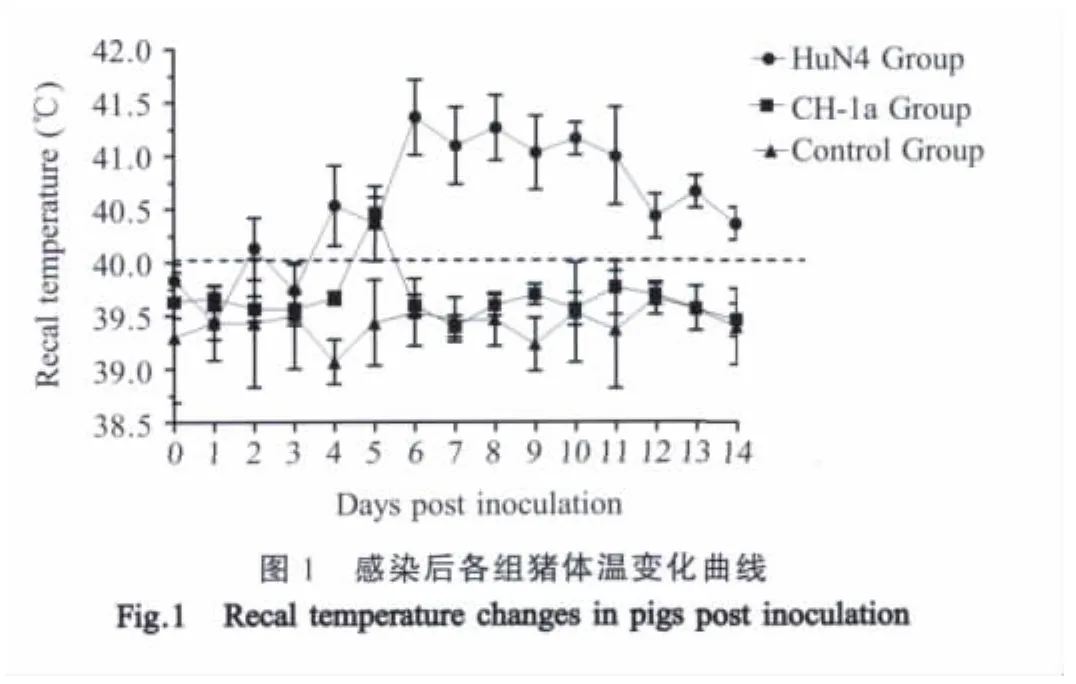
2.2 剖检病理变化 HuN4感染组眼观病理变化显著,随时间的延长,肺脏大面积淤血,有肉样变,颌下淋巴结、腹股沟淋巴结及肠系淋巴结肿大出血,脾脏有大面积出血点;实验过程中死亡的仔猪,各淋巴结严重肿大。CH-1a感染组个别仔猪肺组织轻微淤血,肾脏表面有出血点,淋巴结轻度肿大;对照组各脏器均正常(表1)。
2.3 不同毒力PRRSV在肺脏和外周淋巴器官内的动态变化 HuN4感染组:感染后3 d肺脏及各淋巴结病毒载量明显升高,分别为106copies/g和107copies/g,感染后10 d病毒载量达到峰值,之后开始呈现下降趋势。CH-1a感染组:整个试验过程中肺脏及各淋巴结病毒载量较低,感染后14 d病毒载量为105copies/g左右。对照组未检出PRRSV(表2)。
2.4 不同毒力PRRSV株抗N蛋白及膜蛋白抗体变化规律 HuN4感染组抗N蛋白抗体出现在接种后7 d,S/P=0.6,随后抗体水平逐渐升高,感染后14 d S/P值达到2.0;抗囊膜蛋白抗体在整个实验过程中呈阴性。CH-1a感染组抗N蛋白抗体出现在感染后10 d,S/P=1.7;抗囊膜蛋白抗体在整个实验过程中呈阴性(图 2、3)。
2.5 组织学病理变化 感染后不同时间取样,病变组织经HE染色,制作石蜡切片,镜下观察。
HuN4感染组:感染后7 d,肺脏:肺泡间隔增宽,伴有少量巨噬细胞浸润(图4A);扁桃体及各淋巴结主要表现为实质内淋巴细胞减少、坏死崩解呈多空泡状,并伴有少量巨噬细胞浸润,颌下淋巴结及腹股沟淋巴出血;脾脏:白髓内淋巴细胞减少呈空泡状,其中死亡猪表现为红髓增生,白髓内淋巴细胞减少、坏死崩解呈空泡状(图4C)。感染后14 d,肺脏:间质性肺炎,伴有小血管淤血,发病严重猪变现为化脓性肺炎;扁桃体及各淋巴结主要表现为实质内淋巴细胞显著减少(图5B),呈现出大小不一的空隙,部分淋巴结无明显的淋巴小结,并伴有出血;脾脏:炎性脾肿(图5C)。
CH-1a感染组:感染后7 d,肺脏:支气管及其周围肺泡隔增宽伴有少量淋巴细胞浸润;扁桃体及各淋巴结主要表现为实质内淋巴细胞明显坏死崩解并伴有轻度减少(图4E),其中扁桃体隐窝内有大量嗜中性粒细胞浸润,肠系淋巴结小结内有少量巨噬细胞浸润,髓质内有少量嗜酸性粒细胞浸润;脾脏:白髓内淋巴细胞无明显减少。感染后14 d,肺脏:轻度间质性肺炎(图5D),个别猪小血管内有血栓形成;扁桃体及各淋巴结主要表现为实质内淋巴细胞轻度减少,呈小空泡状;脾脏:白髓内淋巴细胞轻度减少,呈小空泡状(图5F)。
上述病变从损伤的程度来看,HuN4株对肺脏及免疫器官的损伤明显比CH-1a株更加严重,14 d时免疫器官的病变更加明显。对照组仔猪无病变(表3)。
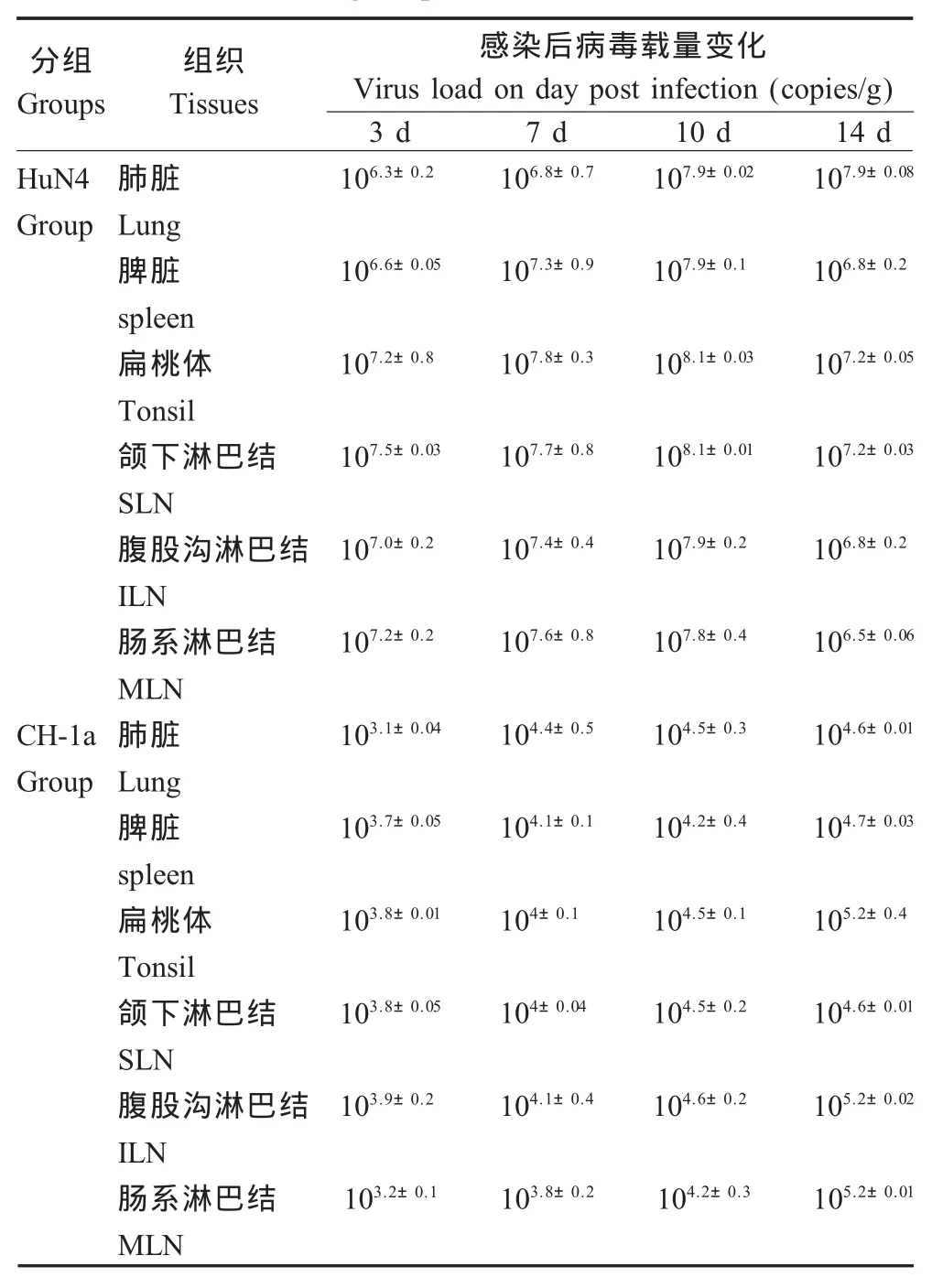
表2 感染后外周免疫器官及肺脏内病毒载量变化Table 2 Virus load in lung and peripheral immune organs post infection
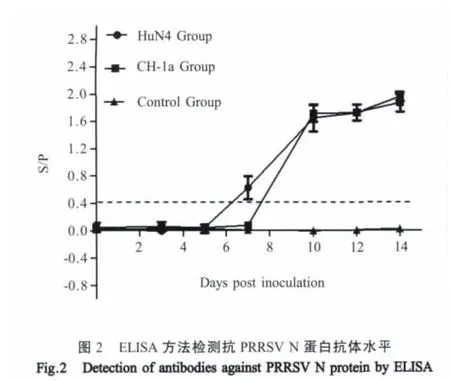
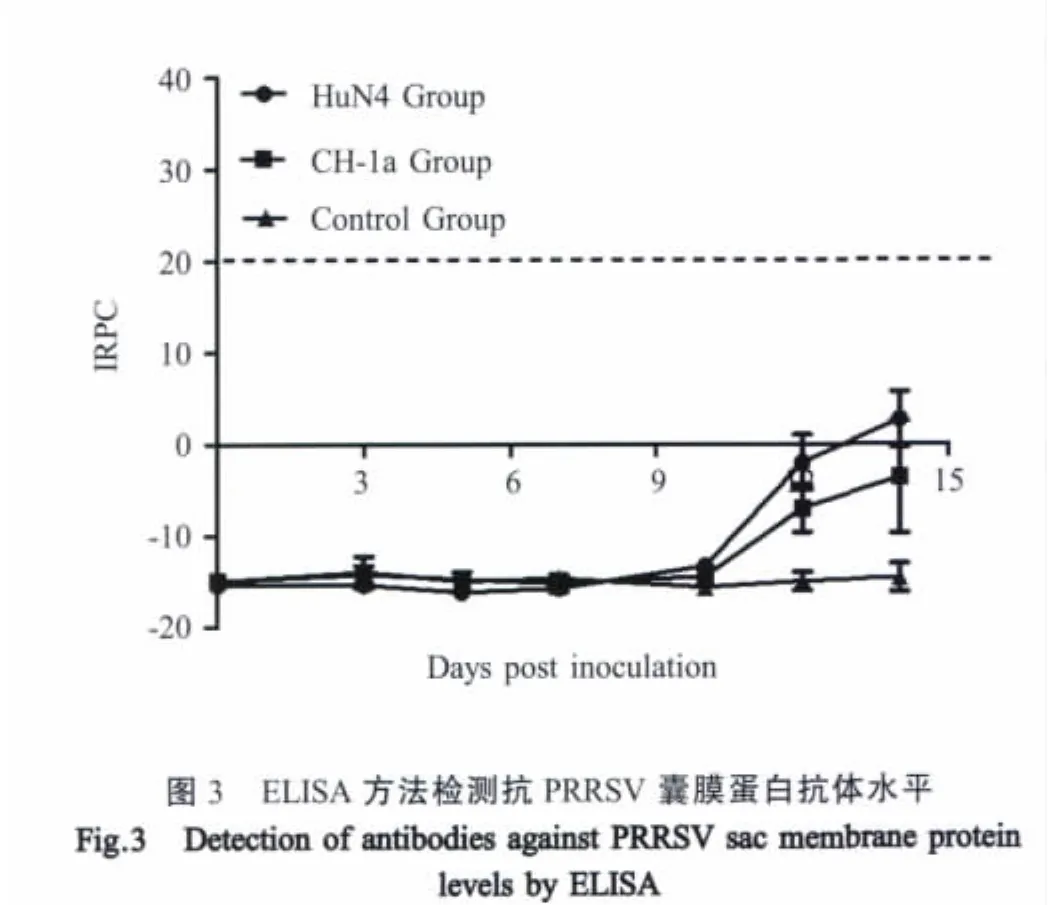

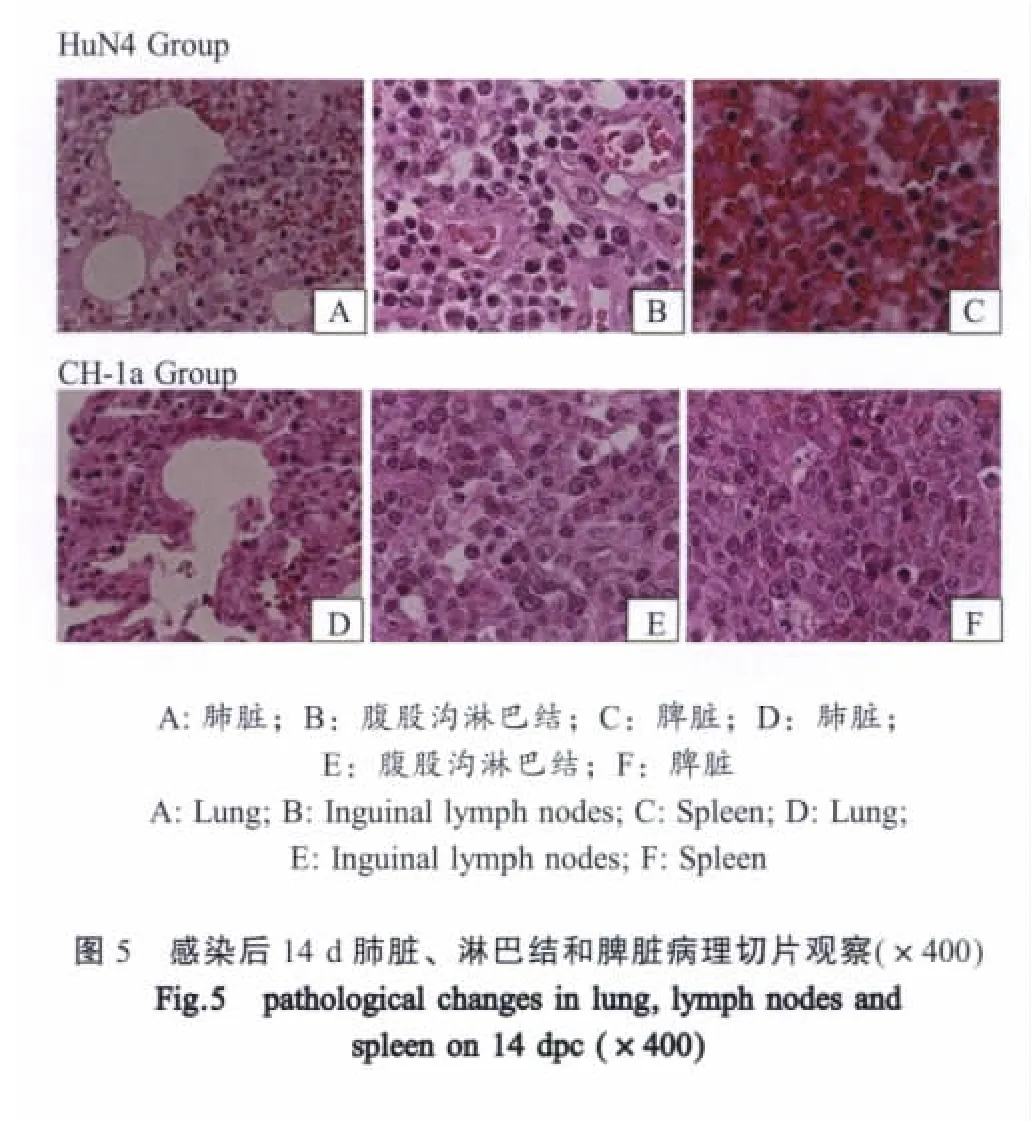
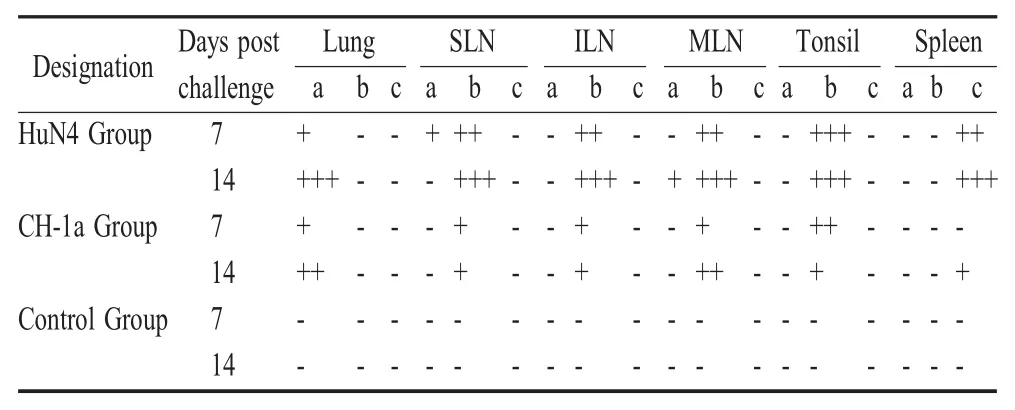
表3 感染后肺脏和免疫器官组织病理学变化Table 3 Histopahological changes in lung and immune organs post infection
3 讨 论
本实验中,HuN4变异病毒株感染的猪群同CH-1a株感染的猪群相比,临床症状明显,病死率较高,病毒在肺脏及淋巴结的复制效率较强,对扁桃体、淋巴结等淋巴组织的病理损伤严重,导致淋巴结实质内淋巴细胞显著减少。HuN4变异病毒株在淋巴结内快速、大量的复制增强了对免疫器官的破坏能力,降低了仔猪的免疫能力,增加了其他病原继发性感染的几率。Mateu等认为当肺脏内易感的巨噬细胞数量被破坏减少时,PRRSV对富含巨噬细胞的淋巴结处感染能力增强[4]。本实验中HuN4组淋巴结内高病毒含量可能是由于该病毒对肺脏肺泡巨噬细胞的大量破坏加剧了对淋巴结内巨噬细胞的感染所致。感染PRRSV的巨噬细胞释放的TNF-α可以促进临近细胞的凋亡[8-9],而且本实验室刘永刚等研究发现,感染HuN4毒株仔猪血清中TNF-α等炎性因子不仅产生时间早而且含量高[7]。本研究中HP-PRRSV感染仔猪淋巴结内淋巴细胞的显著减少可能与HP-PRRSV提高了感染的巨噬细胞释放TNF-α的水平,从而诱导周围淋巴细胞的凋亡有关。ELISA检测结果表明,HuN4组和CH-1a组在感染后的7 d和10 d分别检测到抗N蛋白抗体,虽然整个实验期内均未检测到抗特异性的囊膜蛋白抗体,但是其抗体水平10 d开始有明显的上升趋势,这也与Nelson等报道猪感染PRRSV后N蛋白抗体产生早于囊膜蛋白抗体相一致[10],机体对PRRSV感染后各个蛋白的免疫机理尚需研究。
本实验从临床症状、病毒载量、病理损伤几方面观察表明,HuN4变异毒株的致病能力明显强于CH-1a经典毒株,但是具体的致病机理仍然不是十分清楚,须进一步的研究证明。
[1]郭宝清,陈章水,刘文兴等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国预防兽医学报,1996,18(2):1-4.
[2]Tong Guang-zhi,Zhou Yan-jun,Hao Xiao-Fang,et al.Highly pathogenic porcine reproductive and respiratory syndrome,China[J].Emerg Infect Dis,2007,13(9):1434-1435.
[3]Rowland R R,Steven L,Kurt R,et al.Lymphoid tissue tropism of porcine reproductive and respiratory syndrome virus replication during persistent infection of pigs originally exposed to virus in utero[J].Vet Microbiol,2003,96:219-235.
[4]Mateu E,Diaz I.The challenge of PRRS immunology[J].Vet J,2007,177:345-351.
[5]韦天超,田志军,安同庆,等.猪繁殖与呼吸综合症病毒Taq Man-MGB荧光定量RT-PCR方法的建立和应用[J].中国预防兽医学报,2008,30(12):944-948.
[6]邓治邦,潘荞,袁安文,等.副猪嗜血杆菌血清5型岳阳株对昆明小鼠淋巴器官损伤的研究[J].中国预防兽医学报,2011,33(1):41-44.
[7]Liu Yong-gang,Shi Wen-da,Zhou En-min,et al.Dynamic changes in inflammatory cytokines in pigs infected with highly pathogenic porcine reproductive and respiratory syndrome virus[J].Clin Vaccine Immunol,2010,17:1439-1445.
[8]Sur J H,Doster A R,Osorio1 F A,et al.Apoptosis induced in vivo during acute infection by porcine reproductive and respiratory syndrome virus[J].Vet Pathol,1998,35:506-514.
[9]Choi C,Chae C.Expression of tumour necrosis factor-alpha is associated with apoptosis in lungs of pigs experimentally infected with porcine reproductive and respiratory syndrome virus[J].Res Vet Sci,2002,72:45-49.
[10]Nelson E A,Christopher-Hennings J.Serum immune responses to the proteins of porcine reproductive and respiratory syndrome(PRRS)virus[J].J Vet Diagn Invest,1994,6:410-415.
[11]李丽琴.高致病性猪蓝耳病弱毒苗与灭活苗免疫特性的研究[D].中国农业科学院,2010.

