荧光定量RT-PCR法对犬瘟热病毒PS株感染犬血清和粪便中病毒的检测
许红丽,易 立,王建科,杨 莘,程世鹏
(中国农业科学院特产研究所,吉林吉林132109)
犬瘟热(Canine distemper,CD)是犬科动物最主要的病毒性疾病之一,是由犬瘟热病毒(CDV)感染犬或其他食肉动物引起的高度接触传染性、致死性疾病[1]。CDV为有囊膜的单股负链RNA病毒,编码6种结构蛋白:两种囊膜糖蛋白,融合蛋白(F)和血凝素蛋白(H),基质蛋白(M)、磷蛋白(P)、大蛋白(L)和核蛋白(N)[2]。CD的治愈率极低,早期病例可望治愈,中后期病例治愈困难,因此快速早期诊断CD极其重要。
传统的细胞分离培养方法,所需要的时间长,病毒分离率低;电镜检查法只能观察病毒的形态,不易与同科的病毒区分;免疫荧光技术敏感性较低;酶联免疫吸附实验及其他血清学方法不适合早期诊断[3]。常规PCR技术只能定性检测,敏感性低。而荧光定量RT-PCR可以快速和定量检测CDV,本研究选择NP基因,建立检测CDV的SYBR GreenⅠ荧光定量RT-PCR方法,以期有助于分析CDV感染动物体内的病毒含量变化,对研究CDV的致病性具有重要价值。
1 材料和方法
1.1 病毒株、细胞及主要试剂 CDV PS株、水貂阿留申病毒(ADV)、犬腺病毒(CAV)、犬细小病毒(CPV)均由本实验室分离、鉴定和保存;Vero细胞购自中科院上海细胞库;RNA提取试剂TRIzol LS reagent购自Invitrogen公司;One Step SYBR Prime-Script PLUS RT-PCR试剂盒、pMD18-T均购自TaKaRa公司;DH5α菌株由本实验室保存。
1.2 引物设计与合成 根据GenBank中CDV3株序列(EU726268),设计两对特异性扩增CDV NP基因片段的引物。检测引物上下游分别为5'-AGCTA GTTTCATCTTAACTATCAAGTT-3';5'-TTAACTCT CCAGAAAACTCATGC-3',扩增片段为83 bp。构建重组质粒的标准品上下游引物分别为5'-ATGAACA AAATCTGGCTTGATAT T-3';5'-TGCACTAAATTTG TTCTGAACAGAA-3',扩增片段为364 bp。以CDV PS cDNA作为模板,进行PCR。用1%琼脂糖凝胶电泳鉴定PCR产物。
1.3 阳性重组质粒标准品的制备 回收364 bp的N基因片段,克隆至pMD18-T载体,阳性重组质粒纯化后,由上海英骏生物技术有限公司测序,以序列正确的阳性重组质粒(pCDV-N)作为荧光定量标准品,用紫外分光光度计测定重组质粒浓度,置-20℃备用。
1.4 荧光定量RT-PCR反应体系及条件的优化采用RT-PCR试剂盒进行荧光定量RT-PCR试验。以重组质粒为模板,用矩阵法进行PCR退火温度和模板浓度、引物浓度的优化。反应体系为20 μL,其中,2×One Step SYBRRRT-PCR Buffer 10 μL,ExTaqHS Mix 1.2 μL,上、下游引物各 0.8 μL,cDNA 2 μL,去离子水补至20 μL。优化后的反应条件:95℃30 s,95℃5 s、56℃30 s,40个循环。1.5 标准曲线的建立 将CDV重组质粒标准品10倍倍比稀释,使浓度范围在 6.1×109拷贝 /μL~6.1×101拷贝/μL,每个稀释度设3个重复,以拷贝数对数为X轴,以CT值为Y轴绘制标准曲线。
1.6 特异性及敏感性试验 提取其它犬病毒(ADV、CAV、CPV)的DNA/RNA,采用荧光定量PCR方法进行检测,确定该方法的特异性。将CDV质粒标准品进行10倍系列倍比稀释(6.1×1010拷贝/μL~6.1×10-1拷贝/μL),每个稀释度分别进行3次独立重复试验,确定该方法的敏感性。
1.7 与常规PCR比较试验 从CDV细胞培养物提取病毒RNA,并反转录成cDNA,经10倍系列倍比稀释后用荧光定量PCR和常规PCR进行平行检测,比较两种方法的敏感性。
1.8 人工感染犬及临床样本的检测 选取30日龄的非免疫健康犬4只,分为两组,第一组2只,分别编为1号、2号,各肌肉注射CDV PS株3 mL/只(103.13TCID50/mL),第二组2只为对照,分别编号为3号、4号。隔离饲养,并于接种后6 d、12 d、15 d、17 d、19 d采集血液,于接种后7 d、12 d、13 d、15 d采集眼结膜拭子和粪拭子。采集22份不同地区的宠物医院的临床发病犬的拭子液,按常规方法提取病毒RNA,以CDV PS株细胞分离培养物作为阳性对照,Vero细胞提取物作为阴性对照,按荧光定量PCR进行检测。
2 结 果
2.1 荧光定量PCR标准曲线和熔解曲线 以重组质粒作为阳性标准品,根据OD260nm吸光度计算其拷贝数为6.1×1010拷贝/μL。荧光定量PCR在 6.1×102拷贝 /μL~6.1×109拷贝 /μL 之间具有良好的线性关系,相关系数R2=0.998,扩增效率E=98.3%(图1)。熔解曲线分析表明,引物的特异性较强,只有一个单峰,无非特异性峰出现。
2.2 荧光定量PCR特异性 用荧光定量PCR检测CDV PS株的细胞培养物提取的RNA,结果呈阳性(图2)。其它几种病毒(水貂阿留申病毒、犬腺病毒、犬细小病毒)提取的核酸及Vero细胞检测结果均为阴性,证明该方法具有良好的特异性。

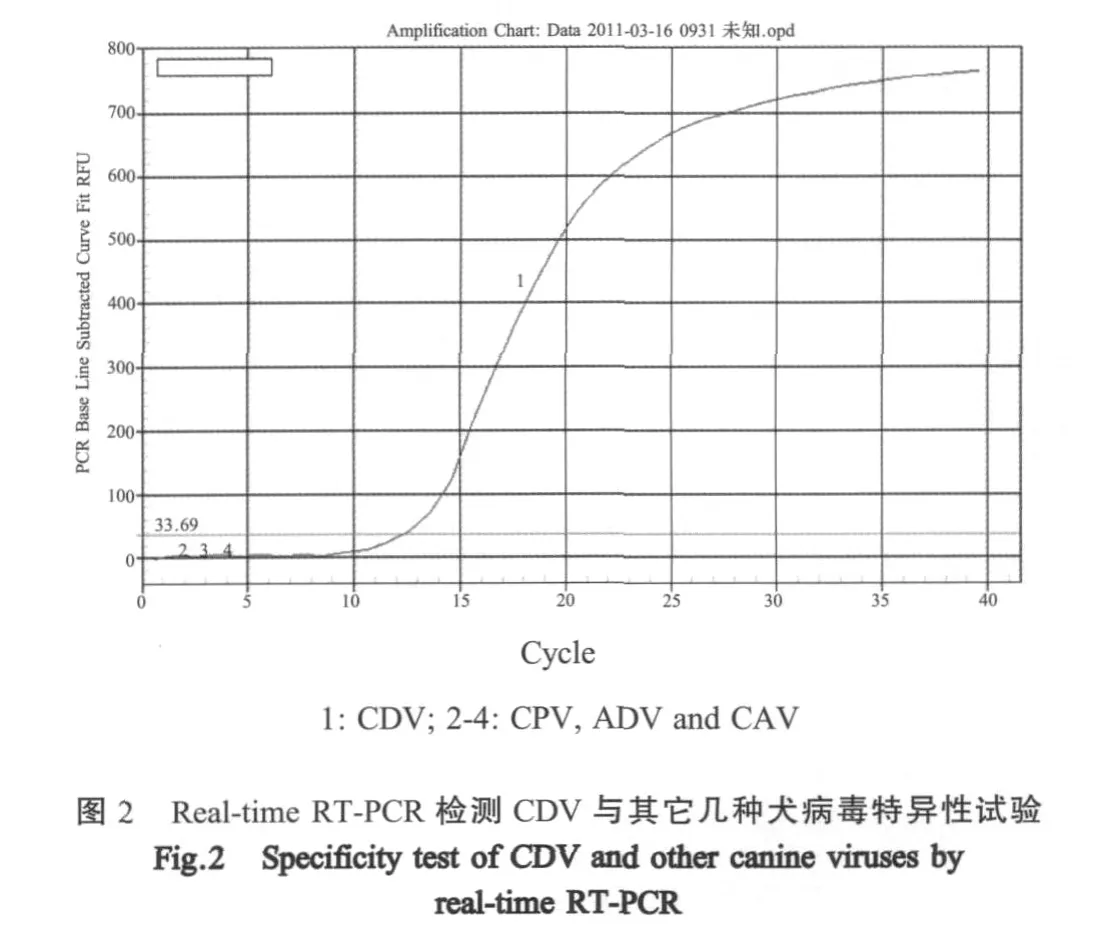
2.3 荧光定量PCR敏感性与重复性 将CDV重组质粒标准品10倍系列稀释进行荧光定量PCR,结果表明,荧光定量PCR最低检测限为6.1拷贝/μL,组内变异系数小于2.62%,表明该方法具有良好的敏感性和重复性(表1)。
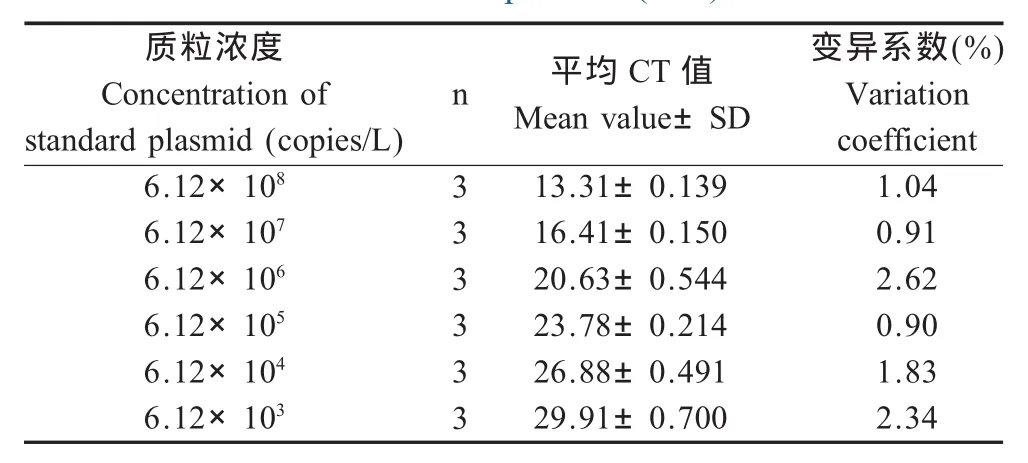
表1 CDV荧光定量RT-PCR重复性试验检测Table 1 Real-time RT-PCR reproducibility test with CDV recombinant plasmid(n=3)
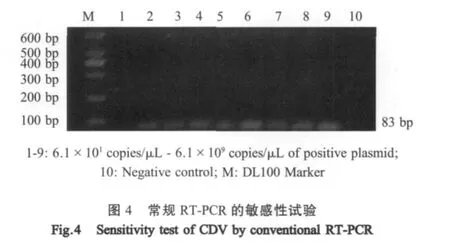
2.4 与常规PCR比较试验 将重组质粒标准品10倍系列稀释,荧光定量RT-PCR检测下限为6.1拷贝/μL,常规RT-PCR检测下限为6.1×102拷贝/μL(图3、图4),表明荧光定量RT-PCR比常规RT-PCR敏感性高102倍。

2.5 病毒感染犬后病毒含量变化 用荧光定量RT-PCR法测定试验组人工感染犬病毒含量(表2、表3),感染犬的血液中病毒含量在2.4×103拷贝/mL~2.4×106拷贝/mL范围内,接种强毒12 d后,1号犬和2号犬的血液中病毒含量均达到高峰期。感染犬的拭子液中病毒含量在2.5×104拷贝/mL~1.6×106拷贝/mL范围内,粪拭子和眼拭子中含量均较高,2号犬在感染后12 d~13 d达到高峰期。
2.6 临床病料样品的检测 对22份CDV临床发病犬的粪拭子浸出液进行荧光定量RT-PCR检测,检测结果均为阳性。对拭子液中少量的病毒也能够检测到(表4),表明荧光定量RT-PCR方法的敏感性高,可以用于CDV的早期诊断。

表2 荧光定量RT-PCR法检测血液中病毒含量Table 2 Detection of virus loads in blood by real-time RT-PCR
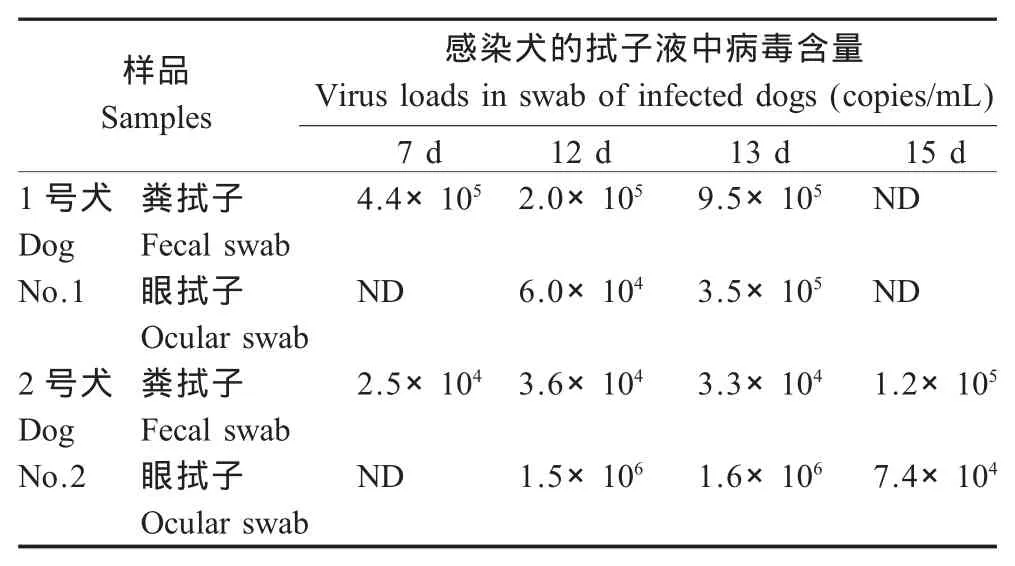
表3 荧光定量RT-PCR法检测拭子液中病毒含量Table 3 Detection of virus loads in swab by real-time RT-PCR
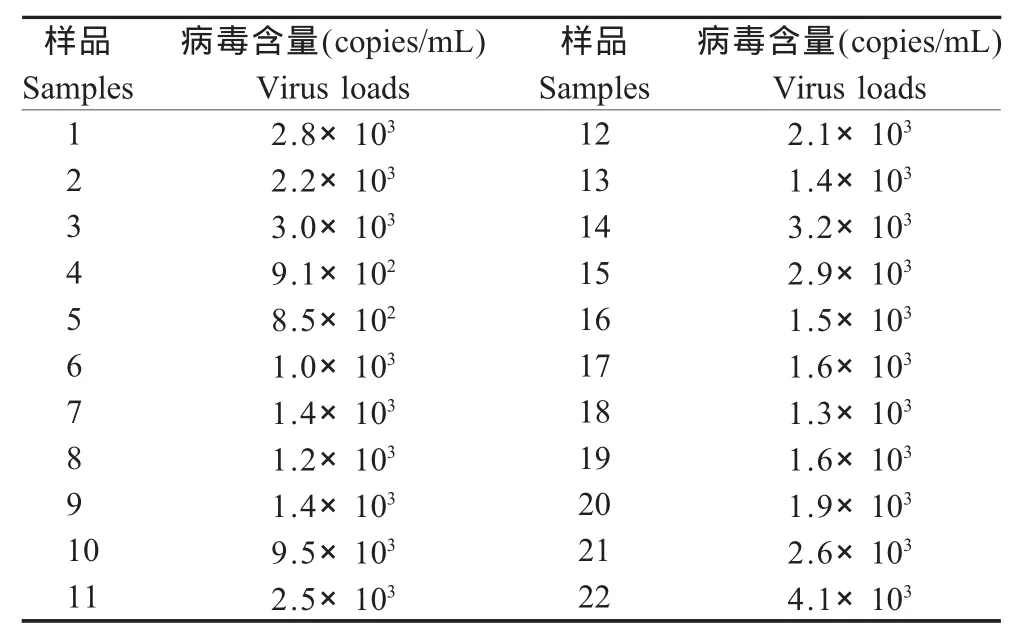
表4 荧光定量RT-PCR检测临床样本的病毒核酸含量Table 4 Virus loads of CDV in clinical samples by real-time RT-PCR
3 讨 论
荧光定量RT-PCR方法对靶基因能够进行准确定量,比常规RT-PCR方法快速,敏感性强,且反应在一个封闭的管内进行,减少了由于PCR污染造成的假阳性问题[4]。目前荧光定量RT-PCR检测方法主要有探针法和染料法两种。TaqMan探针法特异性好,但是价格比较昂贵,染料法也具有敏感性、特异性、重复性好等优点,价格低廉,能够完成CDV的快速定量检测[5],它的特异性可以通过融解曲线来判断。SYBR GreenⅠ法只需要两个保守区域来设计引物,而TaqMan探针法需要3个保守区域来设计引物和探针[6]。因此,SYBR GreenⅠ法更适合检测高度变异的序列。
本研究使用的SYBR GreenⅠ荧光定量RT-PCR方法建立的检测方法具有较高特异性,与其它病毒无交叉反应;该方法具有高度重复性,变异系数较低,并且在102拷贝到109拷贝之间具有良好的线性关系,可以对广泛范围内的RNA病毒含量进行精确的计算。检测敏感性高,比常规RT-PCR高102倍,因此可以用于CD的早期诊断。荧光定量RT-PCR对感染犬的血液和外周分泌物的病毒含量进行检测表明,感染犬的病毒含量在感染后12 d~13 d达到高峰期,临床样本中较低的病毒含量也能够检测到,表明荧光定量RT-PCR方法可以用于CDV的早期诊断。该方法的建立将为研究CD的发病机理及病毒传播途径提供基础,并为CD的诊断提供了一种新方法。
[1]Van Regenmortel M H V,Fauquet C M,Bishop D H L,et al.Virus taxonomy:Seventh report of the international committee on taxonomy of viruses[J].Virus Res,2002,83:221-222.
[2]von Messlingv,Zimmer G,Herrler G,et al.The hemagglutinin of canine distemper virus determines tropism and cytopathogenicity[J].J Virol,2001,75(14):6418-6427.
[3]黎映胜.犬瘟热诊断方法的研究进展[J].综述与专论,2009,39(6):42-45.
[4]Santhosh S R,Parida M M,Dash P K,et al.Development and evaluation of SYBR GreenⅠ-based one-step real-time RT-PCR assay for detection and quantitation of Japanese encephalitis virus[J].J virol methods,2007,143(1):73-80.
[5]邢明伟,曾祥伟,柴洪亮,等.SYBR Green荧光RT-PCR法快速检测毛皮动物源犬瘟热病毒[J].中国兽医学报,2010,30(5):597-601.
[6]Liu Shuo,Hou Guang-yu,Zhuang Qing-ye,et al.A SYBR GreenⅠreal-time RT-PCR assay for detection and differentiation of influenza A(H1N1)virus in swine populations[J].J virol methods,2009,162:184-187.

