CYP4 F2、CYP2 C9和VKORC1基因多态性对中国汉族非瓣膜性房颤患者使用华法林剂量的影响Δ
朱君荣,魏萌,朱余兵,谢渡江,于锋,叶飞,陶宜富#(.南京医科大学附属南京医院,南京0006;.中国药科大学临床药学教研室,南京0009)
非瓣膜性房颤已取代风湿性心脏病引发的瓣膜性房颤成为我国老年人房颤发病的最主要原因,且其发生率随着年龄的增加呈上升趋势[1,2],75岁以上老年人约占非瓣膜性房颤患者的一半[3]。已证实[4,5],房颤是脑卒中的独立危险因素,口服抗凝药华法林可有效减少卒中的发生。华法林能抑制环氧化还原酶的作用而抑制维生素K在肝脏细胞内合成凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ,从而发挥其抗凝作用,因疗效确切奠定了其在非瓣膜性房颤患者抗血栓治疗方案中的基石地位[6,7],但是该药抗凝剂量个体化差异大[8]。已证实[9,10],华法林的代谢酶细胞色素P450(CYP)2 C9和药效靶点酶VKORC1的编码基因存在多态性,这种基因多态性及年龄、体重、药物相互作用等临床特征可解释约50%的华法林剂量个体差异,其他华法林剂量个体差异的相关因素仍需进一步探究[8],这对于规范华法林抗凝治疗有着重要的现实意义。McDonald等[11]发现,肝脏CYP酶4 F2编码基因的多态性会对维生素K的代谢水平产生影响,进而可能导致高加索人群华法林剂量的个体差异[12-14],而CYP4 F2的基因多态性对中国汉族非瓣膜性房颤患者剂量影响的研究尚不多见。本研究旨在结合CYP4 F2以及CYP2 C9、VKORC1的基因多态性和其他临床特征,为中国汉族非瓣膜性房颤患者临床合理使用华法林提供参考。
1 资料与方法
1.1 研究对象
采用回顾性研究方法,收集2009-2011年南京及周边地区非瓣膜性房颤患者260例,均为中国汉族人种。入选标准:确诊为非瓣膜性房颤并服用华法林的患者;稳定服用华法林3个月以上(目标国际化标准比值(INR)为1.5~3.0[15,16])。排除:明确的出血性疾病,如活动性溃疡、支气管扩张等;肝功能不全患者(丙氨酸氨基转移酶(ALT)或者天冬氨酸氨基转移酶(AST)>3倍上限或者胆红素>2倍上限);肾功能不全患者(血清肌酐≥200 μmol·L-1);需长期服用抗血小板药物或非甾体抗炎药者。
1.2 临床资料的收集
从所有纳入研究的患者病例资料中摘录性别、年龄、身高、体重、联合用药等基线信息以及华法林剂量和基因测定结果,并对其进行常规随访。每位患者至少被记录3次以上在目标范围内的华法林用药剂量。华法林平均稳定剂量为患者所测INR值在1.5~3.0之间所记录的华法林总服用量的日平均剂量。体重指数(BMI)=体重(kg)/身高(m)2;体表面积(BSA)=0.0061×100×身高(m)+0.0128×体重(kg)-0.1529。
1.3 基因分型
1.3.1 基因组DNA的提取和聚合酶链式反应(PCR)扩增患者签署知情者同意书后,收集EDTA抗凝的外周静脉全血2 mL。采用AxyPrep-96 Blood基因组提取试剂盒(Axygen Biosciences,美国)提取DNA,严格按照试剂盒说明书操作。CYP2 C9*3、VKORC11173和CYP4 F2基因的引物由上海翼和应用生物技术有限公司设计和合成(见表1)。PCR反应体系体积为20μL,基因组DNA 50ng,上、下游引物各0.4μL,dNTP 2 mmol·L-1,1×PCR缓冲液2 μL,3 mmol·L-1MgCl20.6 μL,Taq聚合酶(1 U·L-1)0.3 μL,1×Q-solution 4 μL。PCR反应条件为95℃预变性2 min,94℃30 s,62℃90 s,72℃1 min,共35个循环,72℃延伸7 min。

表1 SNPs位点的上、下游引物Tab 1 Forward and reverse primers of SNPs
1.3.2 基因多态性检测用连接酶检测反应(LDR)检测CYP2 C9*3、VKORC11173和CYP4 F2的单核苷酸多态性(SNPs)。LDR反应体系体积为10 μL,PCR产物1 μL,各位点探针1 μL,1×LDR缓冲液1 μL,Taq聚合酶(2 U·L-1)0.05 μL。LDR反应条件为95℃预变性1 min,94℃15 s,50℃45 s,共35个循环。在ABI PRISM 3730 DNA测序仪(Applied Biosystems,美国)上完成测序。用Gene Mapper软件(Applied Biosystems,美国)完成数据分析。
1.4 统计学方法
采用SPSS 18.0统计学软件进行统计、分析,计量资料以±s表示,计数资料以频数表示;研究对象Hardy-Weinberg遗传平衡的符合程度采用χ2检验;不同基因型组间华法林口服剂量进行独立样本t检验或单因素方差分析。P<0.05为差异有统计学意义。非参数Spearman等级相关用于分析华法林剂量需求与年龄、体重、身高、联合用药以及基因多态性的关系。采用多元线性回归法(Stepwise筛选法)得到各变量对华法林剂量需求的贡献率以及总影响度。
2 结果
2.1 患者基线信息
患者房颤卒中风险评估(CHADS2)得分范围为2~6分,平均CHADS2得分为(4.2±1.4)分,其他基线信息详见表2。

表2 患者的基线信息(n,%)Tab 2 Baseline characterastics of the patients(n,%)
2.2 基因分型结果
2.2.1 Genemapper数据分析利用Genemapper软件进行数据分析,SNPs位点Genemapper分型图见图1。
2.2.2 基因检测结果CYP4 F2 rs2108622、CYP2 C9 rs1057910和VKORC1 rs9934438基因型检测结果见表3。所有基因分布符合Hardy-Weinberg平衡。基因型频数(%)=(携带某基因型的人数/总人数)×100%;等位基因频数(%)=[(携带某等位基因杂合子的人数+携带某等位基因纯合子人数×2)/(总人数×2)]×100%。
2.3 CYP2 C9*3、VKORC1和CYP4F2基因型与华法林剂量间的关系
CYP2 C9*1/*3携带者所需的华法林日稳定剂量为(1.93±1.14)mg,显著低于CYP2 C9*1/*1携带者[(2.72±0.89)mg,P=0.001]。VKORC11173 TT型携带者所需的华法林日剂量低于CT型携带者[(3.12±1.20)mg·d-1vs.(2.36±0.87)mg·d-1,P=0.047]。CYP4 F2TT基因携带者所需的华法林日剂量为(3.04±0.98)mg,显著高于CT型患者[(2.66±1.02)mg,P=0.037]和CC型患者[(2.60±0.84)mg,P=0.034]。
多元线性回归的结果显示:年龄、体重、血栓史、合并应用β受体阻滞药或胺碘酮、CYP2 C9*3、VKORC11173以及CYP4 F2各项共解释了非瓣膜性房颤患者51.7%的华法林剂量差异。多元线性回归分析扼要结果见表4。其中,CYP4 F2、血栓史以及合并应用β受体阻滞药分别解释了4.8%、2.1%和2.6%的华法林剂量差异。回归方程为Dose=3.47-0.022(年龄)+0.017(体重)+0.189(血栓史)-0.283(β受体阻滞药)-0.471(胺碘酮)-0.586(CYP2 C9*1/*3)-0.296(VKORC1 CT)+0.219(CYP4 F2TT)。其中,年龄以“岁”表示;体重以“kg”表示;有过血栓史、合并使用胺碘酮或β受体阻滞药,出现以上情况则编码为1,否则编码为0;对于CYP2 C9*1/*3、VKORC11173 CT、CYP4 F2 TT基因型,出现以上基因型则编码为1,否则编码为0。
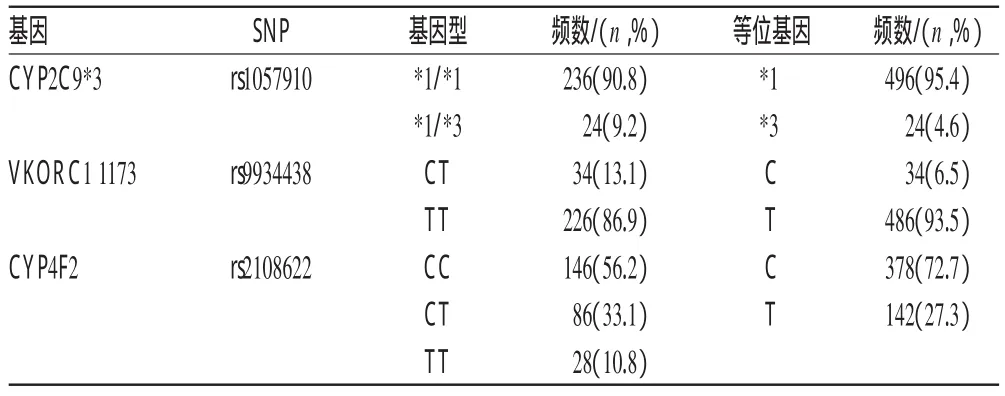
表3 SNPs位点的基因型与等位基因频率Tab 3 Allelic frequency and genotype of SNPs site
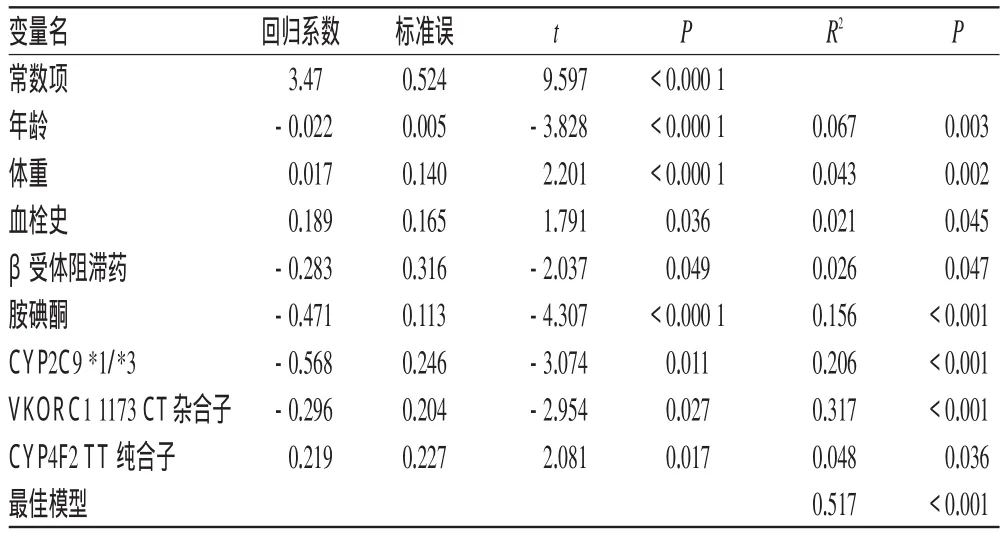
表4 多元线性回归分析扼要结果Tab 4Brief results of stepwise regression analysis
3 讨论
华法林是香豆素类口服抗凝药,通过抑制肝脏维生素K环氧化还原酶,导致无活性的氧化型维生素K无法还原为有活性的还原型维生素K,阻止维生素K的循环应用,干扰维生素K依赖性凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的活化,从而达到抗凝的目的[17]。研究[11]表明,CYP4 F2的编码基因——CYP4 F2 rs2108622的基因多态性会引起还原型维生素K氧化酶活性的个体间差异,进而影响华法林的剂量需求。McDonald等[11]在高加索人群中的研究显示,CYP4 F2野生型(CYP4 F2 CC)携带者还原型维生素K的氧化酶活性最高,CT携带者次之,而TT携带者还原型维生素K的氧化酶活性只有CC携带者的1/4;CYP4 F2 rs2108622 T携带者体内有活性的还原型维生素K水平也高于CYP4 F2CC患者,需要的华法林剂量也相应增加。研究[12,13]已证实,CYP4 F2 rs2108622基因多态性对高加索人种华法林的剂量需求的影响为1.5%~2%,对中国汉族心脏瓣膜置换术后患者的华法林剂量需求影响为3.2%~4%[18,19]。但与心脏瓣膜置换术后患者只需单用华法林抗凝不同,非瓣膜性房颤患者常合并高血压、冠心病等多种疾病,联合用药也相应增加,这些疾病和药物都可能会对华法林的抗凝效果产生一定影响。
中、西方人种CYP2 C9*3和VKORC11173突变频率的巨大差异可以部分解释中、西方患者华法林剂量之间的差异[9,10]。但是本研究结果显示,中国汉族非瓣膜房颤患者CYP4 F2 rs2108622 T的突变频率为27.3%,与中国健康人群中T的突变频率(25%)接近,与高加索人群中的突变频率(28%)差别也不大[20],由此看出CYP4 F2 rs2108622的突变可能不是导致中、西方患者华法林剂量差异的主要因素。
本研究发现,CYP4 F2 rs2108622 T携带者所需的华法林剂量比C携带者高0.4mg·d-1,该位点的基因多态性可以解释4.8%的华法林剂量差异;而在高加索人群中的研究显示,T携带者所需的华法林剂量比C携带者高≥1 mg·d-1[14],但该位点的基因多态性只解释了1.5%~2%的华法林剂量差异[11,13],这种现象提示CYP4 F2 rs2108622的基因多态性可能对中国汉族非瓣膜性房颤患者的华法林剂量的影响大于高加索人群。这可能是因为中国汉族患者对华法林的抗凝作用较为敏感,达到相同的抗凝效果所需要的华法林剂量也低于高加索人种,所以在中国汉族人群中很小的华法林剂量改变却能在较大程度上解释华法林的剂量差异,其具体机制仍需进一步研究。
另外,通过多元线性回归发现,有血栓栓塞史的患者所需的华法林剂量要略高于无栓塞史的患者(2.76 mg·d-1vs 2.43 mg·d-1,P=0.047),这与Gage等[21]的研究结果相似。同时发现,β受体阻滞药(如普萘洛尔)也在一定程度上解释了华法林的剂量差异,Holbrook等[22]也报道了这一现象。但是,β受体阻滞药影响华法林抗凝效果的机制仍需进一步探明。另外,胺碘酮也是影响华法林剂量的重要因素,其影响机制可能是胺碘酮及其代谢产物不仅可以改变华法林肝内代谢的立体选择性,通过抑制CYP2 C9和CYP1 A2活性,影响S-华法林的代谢失活使其血药浓度升高;同时,还可以降低S-和R-华法林的清除率,从代谢和清除两个方面增强华法林的抗凝作用[23,24]。
综上所述,本研究证实CYP4 F2 rs2108622基因多态性可以显著影响中国汉族非瓣膜性房颤患者的华法林剂量。同时,本研究结合年龄、体重、合并疾病、联合用药以及CYP2 C9、VKORC1和CYP4 F2的基因多态性建立了中国汉族非瓣膜性房颤患者的华法林抗凝治疗的剂量预测模型,发现华法林稳定剂量与年龄、合并用胺碘酮或者β受体阻滞药、CYP2 C9*3及VKORC11173位点的基因突变呈负相关,而与体重、合并血栓史及CYP4 F2位点的基因突变呈正相关,希望新模型能为进一步优化非瓣膜性房颤患者的华法林个体给药方案提供一定的理论依据。
[1]中华医学会心血管病分会.中国部分地区心房颤动住院病例回顾性调查[J].中华心血管病杂志,2003,31(12):913.
[2]周自强,胡大一,陈捷,等.中国心房颤动现状的流行病学研究[J].中华内科杂志,2004,43(7):491.
[3]Furnberg CD,Psaty BM,Manolio TA,et al.Prevalence of atrial fibrillation in elderly subjects(The Cardiovascular Health Study)[J].Am J Cardiol,1994,74(3):236.
[4]Hirsh J,Fuster V.Guide to anticoagulant therapy.Part 2:Oral anticoagulants[J].Circulation,1994,89(3):1469.
[5]Hart RG,Benavent O,MeBride R,et al.Antithrombotic therapy to prevent stroke in patients with atrial fibrillation:a meta-analysis[J].Ann Intern Med,1999,131(7):492.
[6]Wann LS,January CT,Lowe JE,et al.2011 ACCF/AHA/HRS focused update on the management of patients with atrial fibrillation(updating the 2006 guideline):a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J].Circulation,2011,123(1):104.
[7]Camm AJ,Kirchhof P,Lip GY,et al.Guidelines for the management of atrial fibrillation:the task force for the management of atrial fibrillation of the European Society of Cardiology(ESC)[J].Eur Heart,2010,31(19):2369.
[8]Daniel E,Howard L.Genetic and clinical factors relating to warfarin dosing[J].Trends Pharmacol Sci,2009,30(7):375.
[9]Rieder MJ,ReinerAP,Gage BF,et al.Effect of VKORC1 haplotypes on transcriptional regulation and warfarin dose[J].N Engl J Med,2005,352(22):2285.
[10]Bodin L,Verstuyft C,Tregouet DA,et al.Cytochrome P4502 C9(CYP2 C9)and vitamin K epoxide reductase(VKORC1)genotypes as determinants of acenocoumarol sensitivity[J].Blood,2005,106(1):135.
[11]McDonald MG,Rieder MJ,Nakano M,et al.CYP4 F2 is a vitamin K1oxidase:an explanation for altered warfarin dose in carriers of the V433 m variant[J].Mol Pharmacol,2009,75(6):1337.
[12]Caldwell MD,Awad T,Johnson JA,et al.CYP4 F2genetic variant alters required warfarin dose[J].Blood,2008,111(8):4106.
[13]Takeuchi F,McGinnis R,Bourgeois S,et al.A genomewide association study confirms VKORC1,CYP2 C9,and CYP4 F2as principal genetic determinants of warfarin dose[J].PLoS Genet,2009,5(3):e1000433.
[14]Borgiani P,Ciccacci C,Forte V,et al.CYP4 F2genetic variant(rs2108622)significantly contributes to warfarin dosing variability in the Italian population[J].Pharmacogenomics2009,10(2):261.
[15]孙艺红,胡大一.华法林对中国人心房颤动患者抗栓的安全性和有效性研究[J].中华内科杂志,2004,43(4):258.
[16]Ridker PM,Goldhaber SZ,DaIIielson E,et al.Longterm,lowintensity warfarin therapy for the prevention of recurrent venous thromboembolism[J].N Engl J Med,2003,348(15):1425.
[17]高菲,宋洪涛,曾志勇,等.CYP2 C9和VKORC1基因多态性对心脏瓣膜置换术后华法林维持剂量和抗凝效果的影响[J].中国药房,2010,21(22):2053.
[18]张海燕,薛领,戚传平,等.基因与临床因素对华法林剂量的影响研究[J].中国药房,2010,21(22):2049.
[19]Cen HJ,Zeng WT,Leng XY,et al.CYP4 F2 rs2108622:a minor significant genetic factor of warfarin dose in Han Chinese patients with mechanical heart valve replacement[J].Br J Clin Pharmacol,2010,70(2):234.
[20]The International HapMap Consortium.The International HapMap Project[J].Nature,2003,426(6968):789.
[21]Gage BF,Eby C,Johnson JA,et al.Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin[J].Clin Pharmacol Ther,2008,84(3):326.
[22]Holbrook AM,Pereira JA,Labiris R,et al.Systematic overview of warfarin and its drug and food interactions[J].Arch Intern Med,2005,165(10):1095.
[23]杨扬,姚均迪,林晓耘.胺碘酮与华法林的相互作用[J].海军医学杂志,2006,27(3):269.
[24]Habib G,Nashashibi M,Khateeb A,et al.Excessive prolongation of prothrombin time among patients treated with warfarin and admitted to the emergency room[J].Eur J Intern Med,2009,19(2):129.

