HPLC法测定人血浆中吉非替尼的浓度
李 翔,刘皈阳,王明媚,王 芳,李 雷(解放军总医院第一附属医院药剂药理科,北京 100037)
吉非替尼是第一个用于肺癌治疗的蛋白激酶抑制药,在体内通过与三磷酸腺苷竞争与表皮生长因子受体结合,产生抗肿瘤活性作用,具有协同化疗药抗癌的效果,临床主要用于治疗局部晚期或转移性非小细胞肺癌[1-2]。目前,吉非替尼在癌症临床治疗中的应用日渐广泛,建立相应的血药浓度测定方法,进行治疗药物监测,可以为临床合理用药提供有益的借鉴和依据,降低不良反应的发生[3-4]。LC-MS/MS测定血浆中吉非替尼浓度的方法报道较多,具有专属性强、灵敏度高等特点,但仪器设备价格昂贵,实验成本较高[5-8]。此外,采用HPLC测定血浆吉非替尼浓度的方法也有报道,但其样品预处理较为繁琐,对精密度和准确度的影响较大[9]。本实验拟使用操作较为简便、成本低廉的乙腈蛋白沉淀样品的预处理方法,减少血浆样品用量,在保证检测灵敏度的前提下,采用HPLC方法建立满足灵敏度、精密度和准确度要求的吉非替尼血药浓度测定方法。
1 仪器与试药
Agilent 1200高效液相色谱仪(包括真空脱气机,四元泵,自动进样器,紫外检测器);METTLER AE200型电子分析天平(瑞士梅特勒);80-2型离心沉淀器(金坛市金南仪器厂);VORTEX-5型涡旋器(海门市其林贝尔仪器制造有限公司);HH-6型数显恒温水浴锅(国华电器有限公司);KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司)。
吉非替尼对照品(南京安格医药化工有限公司,批号20111015);内标:厄洛替尼(南京安格医药化工有限公司,批号 20111208);空白血浆(北京市红十字血液中心);甲醇(色谱纯,Burdick & Jackson);乙腈(分析纯,国药集团化学试剂有限公司);醋酸铵(分析纯,北京化学试剂公司);水为去离子水。
2 方法
2.1 色谱条件
色谱柱:Agilent Eclipse XDB-C18柱(4.6 mm×150 mm,5 μm);流动相:甲醇-10 mmol·L-1醋酸铵溶液(70∶30);检测波长:331 nm;流速:1.0 mL·min-1;进样量:20 μL;柱温:室温;分析时间:12 min。
2.2 溶液的配制
精密称取吉非替尼对照品44.69 mg,置25 mL量瓶中,用乙腈溶解并稀释至刻度,摇匀,即得1.788 mg·mL-1储备液,于4 ℃储存。取储备液,加乙腈稀释,制成893.8 μg·mL-1工作液,同法配制715.0 μg·mL-1质量控制工作液。
精密称取厄洛替尼对照品23.84 mg,置50 mL量瓶中,用乙腈溶解并稀释至刻度,摇匀,即得476.8 μg·mL-1内标储备液,于4 ℃储存。取内标储备液,加乙腈稀释,制成4.768 μg·mL-1内标工作液。
2.3 血浆样品的预处理
将血浆样品于37 ℃水浴解冻,精密吸取100 μL,置1.5 mL离心管中,加入4.768 μg·mL-1厄洛替尼溶液50 μL,混匀,再加入乙腈50 μL沉淀蛋白,混匀,4000 r·min-1离心10 min。取上层清液0.45 μm滤膜滤过,进样。
2.4 标准曲线与质控用血浆的制备
将893.8 μg·mL-1吉非替尼工作液用空白血浆逐级稀释,制成浓度为89.38,178.8,357.5,893.8,1788,3575,8938 ng·mL-1对照品系列血浆。同法,将715.0 μg·mL-1的质量控制工作液用空白血浆逐级稀释制成143.0,715.0,7150 ng·mL-1的低、中、高3种指定浓度的质量控制样品,考察方法学的各项指标。
3 结果
3.1 吉非替尼的色谱分离
按照“2.1”项和“2.3”项所述方法处理并测定,空白血浆、空白血浆加厄洛替尼、空白血浆加吉非替尼对照品及厄洛替尼的样品色谱图见图1。由图可见,在选定的色谱条件下,厄洛替尼与吉非替尼的保留时间分别为4.5 min和9.1 min。血浆中吉非替尼及厄洛替尼出峰处的本底及其他杂质的色谱峰对测定没有任何干扰,具有良好的特异性和分离度。
3.2 线性关系考察

图1 血浆样品的HPLC色谱图A-空白血浆;B-空白血浆加入厄洛替尼;C-空白血浆加入吉非替尼对照品和厄洛替尼;Ⅰ- 厄洛替尼(内标);Ⅱ- 吉非替尼Fig 1 HPLC chromatograms of human plasma samplesA-blank plasma; B-blank plasma spiked with erlotinib; C-blank plasma spiked with gefitinib and erlotinib;Ⅰ- erlotinib (IS); Ⅱ-gefitinib
在89.38~8938 ng·mL-1浓度范围内,血浆中吉非替尼浓度(Y)与吉非替尼峰面积及厄洛替尼峰面积的比值(X)具有良好的线性关系。在精密度与准确度实验中制得的3条标准曲线,r> 0.999。第1天的标准曲线回归方程为Y= 3 516.89X-7.95(r= 0.999 9)。
3.3 日内与日间精密度和准确度
取“2.4”项中配制的低、中、高3种浓度的质控样品各5份,按照“2.3”项和“2.1”项方法处理并测定,考察日内的准确度(RE)和精密度(RSD)(n= 5);同法操作连续测定3 d,考察日间的RE和RSD(n= 3)。按照随行的血浆标准曲线进行定量,计算吉非替尼的浓度,结果见表1。
3.4 定量下限
按“2.4”项下方法配制5份89.38 ng·mL-1的吉非替尼对照品血浆,按照“2.3”项和“2.1”项方法处理并测定。由随行处理的血浆标准曲线进行定量,计算RE和RSD。结果信噪比> 5,表明本法的信噪比良好。最低定量浓度的RE(n= 5)为- 1.81%,RSD(n=5)为3.09%,完全满足此浓度下定量分析的要求。
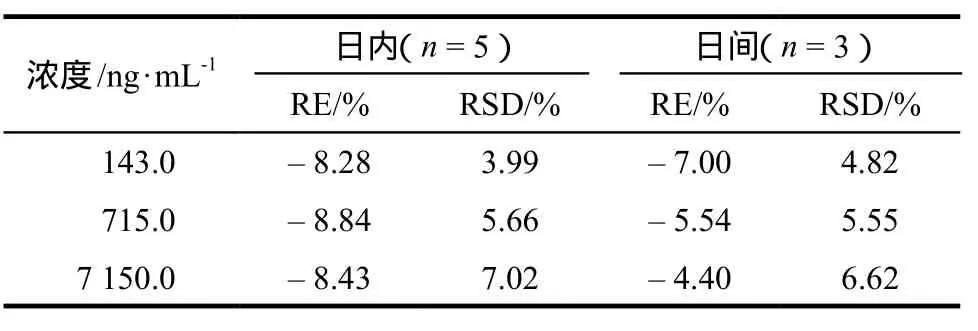
表1 人血浆中吉非替尼的RE与RSDTab 1 REs and RSDs of gefitinib in human plasma samples
3.5 提取回收率
取“2.4”项中配制的低、中、高3种浓度的质控样品各5份,按“2.3”项和“2.1”项方法处理并测定其中吉非替尼的峰面积。另外,取吉非替尼工作液,加乙腈逐级稀释,制成相应浓度的吉非替尼溶液,按“2.1”项方法测定吉非替尼的峰面积。将上述低、中、高3种浓度溶液的对应峰面积值进行比较,计算吉非替尼的提取回收率。血浆中吉非替尼在低、中、高3种浓度的提取回收率(n= 5),结果见表2。

表2 人血浆中吉非替尼的回收率.n = 5Tab 2 Recovery of gefitinib in human plasma samples.n = 5
3.6 样品稳定性
3.6.1 冻融稳定性 取低、中、高3种浓度的质控样品各5份,经过3次反复冻融(- 20~37 ℃)处理后测定吉非替尼的峰面积。利用未经冻融处理,新建立的标准曲线计算浓度,结果测定值与理论值的偏差为- 13.60% ~-10.30%(n= 5)。
3.6.2 低温放置稳定性 取低、中、高3种浓度的质控样品各5份,处理后在低温(4 ℃)冷藏放置24 h后进样测定吉非替尼的峰面积。利用新建立的标准曲线计算浓度,结果测定值与理论值的偏差为- 7.21% ~- 0.75%(n= 5)。
3.6.3 室温放置稳定性 取低、中、高3种浓度的质控样品各5份,在室温下(25 ℃)放置24 h后,进行处理、进样测定吉非替尼的峰面积。利用新建立的标准曲线计算浓度,结果测定值与理论值的偏差为- 12.96% ~-8.97%(n= 5)。
结果显示,在反复冻融3次、低温冷藏、室温放置等3种储存条件下,样品的测定值与理论值的偏差均符合要求,表明样品在这些条件下的稳定性良好。
4 讨论
在确定色谱条件的过程中,我们对流动相的组成和比例进行了系统优化。尝试采用甲醇-水或乙腈-水作为流动相,均无法避免吉非替尼色谱峰的拖尾现象。另外,在流动相中增加冰醋酸的含量,通过改变流动相的pH值对改善色谱峰的拖尾现象仍不理想。最后,采用甲醇-醋酸铵作为流动相体系,可以取得满意的色谱峰形及合适的分离效果。此外,通过比较1,10,20 mmol·L-1等不同浓度醋酸铵对分离的影响,确定甲醇-10 mmol·L-1醋酸铵为最优的流动相体系。
在血浆样品预处理的优化过程中,比较甲醇和乙腈的血浆蛋白沉淀效果。在加入相同体积沉淀试剂的情况下,乙腈的处理效果明显好于甲醇,同时可以保证较高的检测灵敏度,满足人血浆中低浓度吉非替尼的测定。此外,使用乙腈直接沉淀蛋白法处理样品,简便快捷,成本低廉,能够满足分析要求,与其他方法相比,便于操作,易于推广,可满足大批量样品测定的要求。
[1] 徐朝江,王卓,姚远兵.吉非替尼治疗肺癌的研究进展[J].医药导报,2007,26(3):254-257.
[2] 王春敏,李炜,仇缀百.靶向抗肿瘤药物吉非替尼的临床研究进展[J].中国临床药学杂志,2007,16(2):127-130.
[3] 谢吉科,姜德春.治疗药物监测的研究进展[J].中国药物应用与监测,2011,8(6):379-382.
[4] 朱曼,郭代红,刘皈阳,等.临床药师对我院呼吸科药品不良反应监测和处置的影响[J].中国药物应用与监测,2009,6(3):178-180.
[5] Zhao M, Hartke C, Jimeno A,et al.Specific method for determination of gefitinib in human plasma, mouse plasma and tissues using high performance liquid chromatography coupled to tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci, 2005, 819(1): 73-80.
[6] Honeywell R, Yarzadah K, Giovannetti E,et al.Simple and selective method for the determination of various tyrosine kinase inhibitors used in the clinical setting by liquid chromatography tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci, 2010, 878(15-16): 1059-1068.
[7] Wang LZ, Lim MY, Chin TM,et al.Rapid determination of gefitinib and its main metabolite, O-desmethyl gefitinib in human plasma using liquid chromatography-tandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(22): 2155-2161.
[8] Chahbouni A, den Burger JC, Vos RM,et al.Simultaneous quantification of erlotinib, gefitinib, and imatinib in human plasma by liquid chromatography tandem mass spectrometry[J].Ther Drug Monit, 2009, 31(6): 683-687.
[9] Faivre L, Gomo C, Mir O,et al.A simple HPLC-UV method for the simultaneous quantification of gefitinib and erlotinib in human plasma[J].J Chromatogr B Analyt Technol Biomed Life Sci,2011, 879(23): 2345-2350.

