罗格列酮对阻塞性睡眠呼吸暂停综合征小型猪脂肪组织IL-6表达的影响
汤凤莲,周 燕,解培顺 ,于冉冉,于会娜
(1桂林医学院附属医院,广西 541001;2梁山县人民医院)
阻塞性睡眠呼吸暂停综合征(OSAHS)发病率高、具有潜在危险。肥胖和高胰岛素血症是OSAS主要发病因素之一。罗格列酮是噻唑烷二酮类药物,是有效的核转录因子过氧化物酶体增殖物激活受体(PPARγ)的激动剂。作为一种新型的胰岛素增敏剂,具有拮抗胰岛素抵抗、降低高血糖、改善脂代谢紊乱、抗动脉粥样硬化的作用。补充研究时间?,我们观察了罗格列酮对脂肪组织IL-6表达及高胰岛素血症、胰岛素抵抗的影响,探讨其治疗OSAHS的可行性及可能机制。
1 材料与方法
1.1 材料 雌性清洁级中国小型猪18只(购自广西大学动物实验中心),体质量是(25±2.2)kg;医用冰袋(北京中衫金桥生物技术有限公司生产);Trizol RNA提取试剂盒、逆转录试剂盒(大连宝生物公司);TAq酶(北京天根生物公司);IL-6 mRNA引物(上海英骏生物公司);兔抗猪IL-6一抗(博士德公司)。多导睡眠监测仪1台(美国泰科公司生产);Legendmiro 17R型微量台式高速冷冻离心机(Thermo公司);Biometra型PCR扩增仪(德国耶拿分析仪器股份公司);JS-780型全自动凝胶成析系统(上海培清科技);酶标仪(Labsystem MK3,芬兰);EPS 301型SDS-PAGE电泳仪(Amersham Pharmacia Biotech公司);SD转膜仪(BIO-RAD)公司。
1.2 实验方法
1.2.1 模型制备及干预 雌性清洁级中国小型猪18只,随机分为空白对照组、模型组、罗格列酮组各6只。参照徐斌[1]等方法制作OSAHS模型,手术当天禁食、禁水,采用苯巴比妥钠30 mg/kg耳缘静脉注射麻醉,连接多导睡眠仪,采用金属注射器抽取医用冰袋内凝胶状物8 mL和80万U青霉素溶液防止局部感染,于动物双侧咽腭部及舌根部多点进针,缓慢注射,直至动物出现鼾声、多导睡眠监测仪上观察到典型的呼吸暂停图形时即停止注射,以平均呼吸暂停次数(AI)≥30次或睡眠呼吸暂停低通气指数(AHI)≥5次/h为造模成功指标;对照组咽腭部及舌根部注射等量生理盐水。制模成功后治疗组喂服罗格列酮4 mg/(kg·d),对照组与模型组喂服等量生理盐水。每组动物均在术前、术后即刻、术后2周及处死前行多导睡眠仪监测动物的睡眠呼吸暂停低通气指数(AHI)、最低血氧饱和度(SaO2)。干预12周后处死各组动物并取大网膜脂肪组织,分别用DEPC水与无菌冰生理盐水冲洗并剪成0.5 g大小的脂肪块,分装在无菌EP管中密封,迅速液氮冷冻,-80℃保存,DEPC水冲洗过的留做RT-PCR,生理盐水冲洗过的留做蛋白质免疫印迹分析(Western blot方法)。
1.2.2 观察项目
1.2.2.1 睡眠生理指标 采用多导睡眠监测仪监测各组平均呼吸暂停次数(AI)、睡眠呼吸暂停低通气指数(AHI)及最低血氧饱和度(SaO2);
1.2.2.2 血清相关指标 各组麻醉后抽取耳缘静脉血5 mL,5 000 r/min离心10 min分离血清,空腹血糖采用葡萄糖氧化酶法,胰岛素、胰岛素原采用放射免疫(RIA)法,采用HOMA模型公式计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=(胰岛素 ×血糖)/22.5。
1.2.2.3 肪脂组织IL-6mRNA表达 采用RT-PCR法:将超低温冻结的大网膜脂肪组织迅速转移至用液氮预冷的研钵中,用研棒研磨,期间不断加入液氮,直至研磨成粉末状,取研磨成粉末状的样品100 mg加入到含有1 mL RNAiso plus的2 mL EP管中,轻摇混匀,置于冰浴上匀浆5 min,12 000转4℃离心5 min;加入200 μL氯仿,震荡混匀,冰浴上静置5分钟,4℃、12 000 r/min离心15 min;将上清液移至新的1.5 mL EP管中,加入与上清液等体积的异丙醇,冰浴上静置10 min,4℃、12 000 r/min离心10 min;弃上清保留沉淀,加入1 mL 75%乙醇,4℃、12 000 r/min离心5 min;弃上清保留沉淀,干燥;溶解于30~50 μL DEPC处理水中。用紫外分光光度计检测RNA浓度及纯度。总RNA逆转录成cDNA各取1 μg RNA按试剂盒操作说明逆转录为cDNA。取1 μL cDNA为模板,分别以IL-6的引物(上游引物5'-TCCAGACCCTGAGGCAAAAGGGA-3';下游引物5'-TGCCCGTGGACGGCATCAAT-3';扩增片段约220 bp)与内参照 β-action的引物(上游引物5'-GCTAGTCTCCAAGCGACGAA-3';下游引物5'-TACAGTCTAAAACTTTTGCCCTT-3',扩增片段约319 bp)进行PCR扩增。取扩增产物5 μL在含有0.5 μg/mL溴已啶的1.5%琼脂糖凝胶上电泳,产物条带用凝胶成像系统照相并进行灰度分析。目的片段的相对表达量=目的基因的灰度值/β-action的灰度值。
1.2.2.4 脂肪组织IL-6蛋白表达 采用蛋白质免疫印迹法。提取各组脂肪组织总蛋白,用BSA试剂盒测定总蛋白浓度,根据标本蛋白浓度计算上样量,使每孔蛋白上样量一致;行 SDS-PAGE凝胶电泳后电转移至硝酸纤维素滤膜上;将膜用5%的脱脂奶粉封闭后,加入抗IL-6单克隆抗体(稀释度1∶500),室温孵育1 h;洗膜后加入二抗鼠抗兔IgG(稀释度1∶1 000)室温孵育1 h;PBST充分洗涤后,用化学发光显影药盒显影,X线胶片曝光记录影像;凝胶成像分析系统分析胶片,读取各目的条带及β-action的光密度值,计算其比值。
1.3 统计学方法 采用SPSS17.0统计软件,所有数据以±s表示,计量资料比较t检验,多组均数间比较采用方差分析和q检验。P≤0.05为差异有统计学意义。
2 结果
2.1 睡眠生理指标 见表1。
表1 三组睡眠生理指标比较(n=6,±s)

表1 三组睡眠生理指标比较(n=6,±s)
注:与对照组比较,*P <0.01;与模型组比较,△P <0.05
组别 AI(次/h) AHI(次/h) 最低SaO2(%)治疗组 14.33 ±1.37*△ 20.17 ±1.47*△ 78.89 ±1.03*△模型组 17.50 ±1.87* 23.00 ±1.41* 75.69 ±0.58*对照组2.35 ±0.10 3.13 ±0.20 89.60 ±2.75
2.2 血清学指标 见表2。
表2 三组血清学指标比较(n=6,±s)
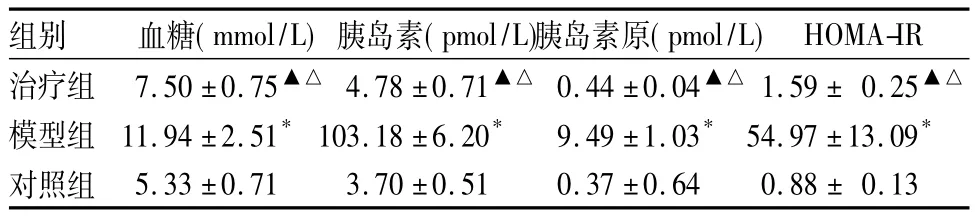
表2 三组血清学指标比较(n=6,±s)
注:与对照组比较,*P <0.01,▲P <0.05;与模型组比较,△P<0.05
组别 血糖(mmol/L)胰岛素(pmol/L)胰岛素原(pmol/L)HOMA-IR治疗组 7.50 ±0.75▲△ 4.78 ±0.71▲△ 0.44 ±0.04▲△ 1.59 ± 0.25▲△模型组 11.94 ±2.51*103.18 ±6.20* 9.49 ±1.03* 54.97 ±13.09*对照组5.33 ±0.71 3.70 ±0.51 0.37 ±0.64 0.88 ± 0.13
2.3 IL-6mRNA及IL-6蛋白表达 见表3及图1、图2。
表3 三组IL-6mRNA及蛋白比较(n=6,±s)
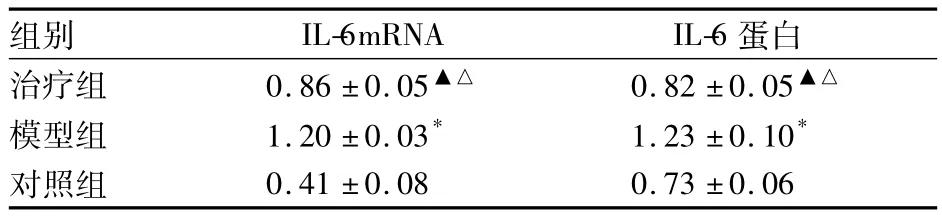
表3 三组IL-6mRNA及蛋白比较(n=6,±s)
注:与对照组比较,*P <0.01,▲P <0.05;与模型组比较,△P <0.05
组别 IL-6mRNA IL-6蛋白治疗组 0.86±0.05▲△ 0.82±0.05▲△模型组 1.20 ±0.03* 1.23 ±0.10*对照组0.41 ±0.08 0.73 ±0.06

图1 各组脂肪组织IL-6 mRNA表达

图2 各组脂肪组织IL-6蛋白表达
3 讨论
OSAHS的病理生理学相当复杂,发病机制尚未完全明确,其有效的治疗方法是当前的研究热点。研究证实,肥胖和高胰岛素血症是OSAHS主要发病环节之一。脂肪细胞因子在胰岛素抵抗以及代谢综合征组分疾病的发生、发展中起重要作用,IL-6是近年研究热门的一种脂肪源性细胞因子,是肥胖与高胰岛素血症、胰岛素抵抗联系的关键[2,3]。是否可通过调节OSAS患者体内IL-6水平而改善OSAS患者 AHI、AI、HI、最低血氧饱和度等指标,从而改善临床症状是本实验的一个思路,目前国内外此方面的探讨很少。
IL-6是一种多功能细胞因子,具有广泛生物学活性,在机体炎症反应、免疫应答、造血调控和肿瘤免疫中起重要作用。它的失调与多种临床疾病有关。IL-6代谢紊乱可能是一个影响OSAHS发生、发展的因素。近几年关于IL-6与OSAHS间关系的研究多集中在IL-6作为炎症介质或氧化应激标记物在体内的变化,IL-6主要由免疫细胞分泌[4]。最近研究表明,脂肪组织等非免疫细胞亦可产生IL-6,在脂质化物代谢中发挥重要作用。IL-6是受激素调节的脂肪细胞因子,肾上腺皮质激素和雌激素可抑制其产生,而儿茶酚胺可刺激其生成。OSAHS患者AHI增加,夜间血氧饱和度下降,进而引起交感神经兴奋、儿茶酚胺类物质升高、血压波动,这些均可导致IL-6水平升高。近来,发现IL-6对生理睡眠有调节作用,可减少动眼睡眠、改变慢波睡眠,使人嗜睡、易疲乏,注意力不集中。王曾等[5]发现OSAHS患者血浆IL-6水平较正常对照组明显升高,且与病情呈正相关。另外,Kopp等[6]发现IL-6与胰岛素抵抗显著相关,可引起肥胖相关的胰岛素抵抗。
我们前期研究发现,噻唑烷二酮类药物可通过调节瘦素、脂联素、抵抗素等脂肪细胞因子的水平而增强胰岛素的敏感性,减轻胰岛素抵抗[7]。本实验在前期研究的基础上对实验动物予罗格列酮干预后观察对脂肪源性细胞因子IL-6 mRNA及蛋白表达的影响,发现模型组与对照组比较AI、AHI升高,最低血氧饱和度SaO2下降,符合OSAHS患者的诊断标准;同时血糖、胰岛素、胰岛素原、HOMA-IR等指标均升高,提示OSAS存在高血糖、高胰岛素血症及胰岛素抵抗等并发症;模型组与对照组比较脂肪组织IL-6 mRNA及蛋白表达灰度值均升高,提示OSAS可导致IL-6水平升高。治疗组与模型组比较IL-6 mRNA及蛋白表达灰度值均降低,血糖、胰岛素、胰岛素原、HOMA-IR、AI、AHI均降低,SaO2升高。提示罗格列酮可能通过减轻胰岛素抵抗,降低脂肪组织IL-6 mRNA及蛋白表达,从而发挥其对OSAS的干预作用,降低OSAS疾病并发症的发生率。
综上所述,罗格列酮对OSAHS有治疗作用,其机制可能为减轻胰岛素抵抗,降低IL-6 mRNA及IL-6蛋白表达。
[1]徐斌,张文丽,尹彤,等.聚丙烯酰胺水凝胶注射法制备中国小型猪睡眠呼吸暂停动物模型的可靠性评价[J].中国临床康复,2004,8(27):5866-5867.
[2]Kershaw EE,Fliter JS.Adipose tissue as an endocrine organ[J].Clin Endocrinol Metab,2004,89(7):2548-2556.
[3]中华医学会呼吸病学分会睡眠呼吸疾病学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(草案)[J].中华内科杂志,2003,42(8):594-597.
[4]罗少华,高兴林,李东风,等.阻塞性睡眠呼吸暂停患者循环内皮细胞与血清肿瘤坏死因子-α、白介素-6浓度的关系[J].实用医学杂志,2010,26(14):2508-2510.
[5]王曾,杜黎明,李京合.阻塞性睡眠呼吸暂停综合征与血浆瘦素和白细胞介素6关系的临床研究[J].中国医师杂志,2006,8(8):1017-1018.
[6]Kopp HP,Kopp CW,Festa A,et al.Impact of weight loss on inflammatory proteins and their association with the insulin resistance syndrome in morbidly obese patients[J].Arterioscler Thromb Vasc Biol,2003,23(6):1042-1047.
[7]苏珂,龙艳,于健,等.吡格列酮对2型糖尿病并发心血管病患者血清脂联素与胰岛素抵抗的影响.中国老年学杂志,2007,27(4):345-346.

