核受体Nurr1表达与鼻咽癌恶性演进的相关性研究
(广东医学院中美肿瘤研究所,广东东莞 523808)
鼻咽癌多发于中国南方及东南亚地区,其致病因素复杂,包括病毒感染、遗传易感及环境因素[1]。近年来,采用放射治疗和新辅助化疗相结合的标准疗法,使鼻咽癌治疗效果得到显著改善[2],但是,其预后仍然不容乐观。鼻咽癌具有高侵袭性,早期即可扩散并出现淋巴道或血道转移,治疗后的5年生存率只有50% ~60%[3]。研究证实,一个细胞核孤儿受体NR4A家族成员Nurr1主要分布在胞核,其具有促进细胞迁移的作用,其与癌症发生发展的相关性日益受到关注[4,5]。2011年,我们采用免疫组织化学方法检测了鼻咽癌中Nurr1表达,探讨其与鼻咽癌各临床特征的的关系,并在细胞水平检测其对鼻咽癌CNE-2Z细胞迁移及侵袭能力的影响,旨在探讨鼻咽癌转移相关的分子机制。
1 材料与方法
1.1 材料 选取2008~2011年收治的首诊鼻咽癌患者癌组织石蜡包埋标本66份(观察组),患者男4 5例,女21例;年龄23 ~74岁,平均49.5岁。按2008年全国鼻咽癌会议分期标准:T1~T2期26例,T3~T4期40例;N0期16例,N1~N3期50例;M0期61例,M1期5例。Ⅰ~Ⅱ期18例,Ⅲ~Ⅳ期48例。另取20例病理活检为鼻咽黏膜慢性炎症的非癌标本作为对照组。细胞与试剂:低分化鼻咽癌细胞CNE-2Z(本研究所保存);siRNA-Nurr1序列(上海吉凯基因化学技术有限公司);转染试剂Lipofectamine2000(Invitrogen公司);兔抗人Nurr1多克隆抗体和鼠抗人β-actin单克隆抗体(Santa Cruz公司);24孔侵袭小室(Corning Costar公司);DyLight 800远红外二抗(KPL公司);其余均为进口或国产分析纯试剂。
1.2 实验方法
1.2.1 肿瘤组织Nurr1表达检测 采用免疫组化SP法:标本脱蜡、水化;PBS洗2~3次各5 min;滴加3%H2O2(80%甲醇)于切片组织上,室温静置10 min;PBS洗2~3次各5 min;抗原修复;PBS洗2~3次各5 min;滴加封闭液(1%BSA),37℃恒温孵育20 min;甩去多余液体;滴加兔抗人Nurr1多克隆抗体50 μL(1∶50),37 ℃恒温孵育1 h;PBS 洗3 次各5 min;滴加生物素标记二抗50 μL(1∶200),37 ℃恒温孵育1 h;PBS洗3次各5 min;DAB显色5~10 min,在显微镜下掌握染色程度;PBS或自来水冲洗10 min;苏木精复染2 min,盐酸酒精分化;自来水冲洗10~15 min;脱水、透明、封片、镜检。观察两组细胞胞质和胞核中Nurr1表达情况;参照Carcangiu的双记分法观察肿瘤组织中Nurr1表达,根据细胞阳性染色强度记为3分(深棕色)、2分(棕色)、1分(淡棕色)和0分(阴性);根据阳性细胞数量多少记为3分(60%以上)、2分(20% ~60%)、1分(20%以下)和0分(阴性)。两积分的乘积≥4分为高表达,≤3分为低表达或阴性。
1.2.2 siRNA-Nurr1转染CNE-2Z细胞及相关指标观察 取CNE-2Z细胞采用含10%胎牛血清的RPMI1640培养液,置于37℃、5%CO2、相对饱和湿度下细胞培养箱内培养,取对数生长期细胞分为三组:A组不处理,B组转染阴性siRNA,C组转染siRNANurr1。转染前调整细胞浓度为1×105/mL,接种于6孔板,每孔2 mL,达50% ~60%汇合时转染。转染过程按试剂盒说明书操作:RNA转染用量为100 pmol/孔,转染试剂 5.0 μL/孔。观察项目:①细胞Nurr1蛋白表达:转染后48 h裂解细胞提取各组细胞蛋白。用酚试剂法进行定量后,将含有等量蛋白的细胞裂解液用5×上样缓冲液稀释,置于SDSPAGE(分离胶10%、浓缩胶5%)电泳分离,湿转至NC膜,室温下用5%脱脂奶粉封闭1 h;加入一抗(1∶1 000),4℃过夜;远红外波长标记的二抗(1∶15 000),4 ℃ 孵育 4 h,扫描成像。以 Nurr1/βactin相对灰度值代表Nurr1蛋白相对表达水平。②细胞迁移与侵袭试验迁移试验:各组细胞用无血清RPMI1640培养基稀释成1×106/mL细胞悬液,100 μL细胞悬液加入Transwell上室,下室加入600 μL条件培养基,培养箱中培养24 h;取出Transwell小室,吸弃上室液体,用棉签擦去膜上表面细胞,PBS漂洗后4%多聚甲醛固定15 min,Giemsa染色30 min;细胞侵袭试验使用基质胶来模拟体内细胞外基质环境,其余过程与迁移试验相同。随机取5个视野在200倍显微镜下计数滤膜下表面的细胞数,用以表示肿瘤细胞的迁移及侵袭能力。
1.3 统计学方法 采用SPSS13.0统计软件进行统计处理。数据以±s表示,显著检验采用方差分析;两因素间差异的比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 肿瘤组织Nurr1表达、亚细胞分布及与鼻咽癌临床病理特征的关系 20例鼻咽黏膜非癌组织中有3例为高表达,高表达率为15%;66例鼻咽癌组织中有48例为高表达,高表达率为73%(P<0.001)。20例鼻咽黏膜非癌组织中只有2例有胞质表达,其余18例均只表达于胞核;66例鼻咽癌组织中有41例可见胞质表达(P<0.001)。Nurr1的表达及亚细胞分布与鼻咽癌临床病理特征的关系见表1。
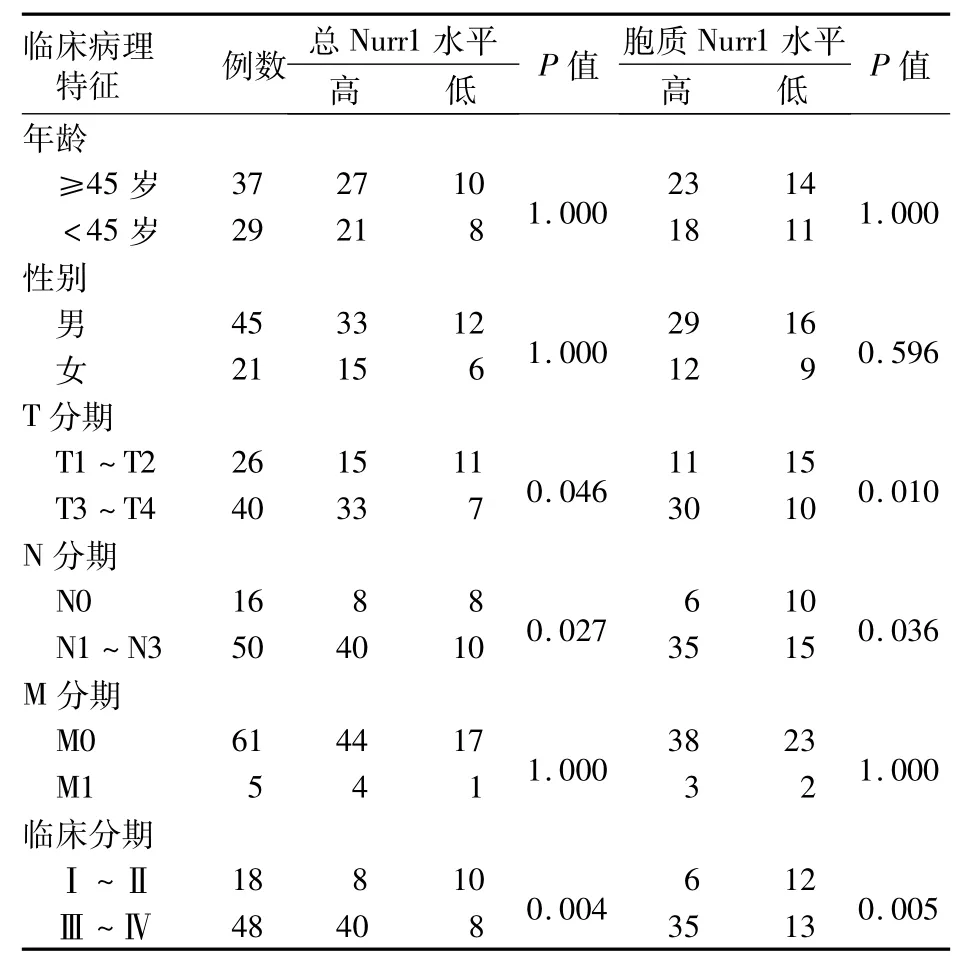
表1 Nurr1表达、亚细胞分布及与鼻咽癌临床病理特征的关系
2.2 CNE-2Z细胞Nurr1蛋白表达及侵袭、迁移能力 见表2。
表2 siRNA-Nurr1转染CNE-2Z后Nurr1蛋白水平及细胞迁移、侵袭能力变化(n=3,±s)

表2 siRNA-Nurr1转染CNE-2Z后Nurr1蛋白水平及细胞迁移、侵袭能力变化(n=3,±s)
注:与 A、B 组比较,*P <0.05
组别 Nurr1蛋白水平 迁移细胞(个) 侵袭细胞(个)A组0.3146 ±0.0188 332 ±21 169 ±12 B 组 0.3208±0.0302 339±24 184±10 C 组 0.1307±0.0180* 285±14* 124±10*
3 讨论
NR4A孤儿核受体家族包括3种高度同源的受体:Nur77(NR4A1,也称 TR3和 NGFI-B)、Nurr1(NR4A2)和Nor1(NR4A3)。这些进化上保守的受体可被环境中的刺激信号快速诱导,并作为非配体依赖的转录因子和早期反应基因行使功能[6]。近年来,Nurr1与恶性肿瘤的关系日益受到关注,其在鼻咽癌中的作用鲜见报道。免疫组化分析显示,T、N分期及临床分期越高,鼻咽癌组织中Nurr1的表达水平也随之升高。且Nurr1的亚细胞定位亦发生显著改变,T、N分期及临床分期越高,Nurr1的胞质表达率越高;细胞侵袭、迁移试验结果显示,siRNANurr1转染后细胞侵袭、迁移能力显著减弱。可见CNE-2Z细胞可能通过升高Nurr1表达及定位改变来促进其恶性演进。
目前Nurr1促进细胞侵袭、迁移的机制尚不清楚。作为一个重要的核转录因子,其本身的表达水平改变可导致其调控的一系列基因的表达变化,进而促进肿瘤的恶性演进。有研究表明,NR4A家族的另一成员Nur77,经MEK-ERK-RSK途径被磷酸化后,由细胞核转位到线粒体,与抗凋亡蛋白Bcl-2结合,使Bcl-2的BH3结构域暴漏,诱发线粒体途径的凋亡[7,8]。我们推测,Nurr1可能有类似的机制,只不过胞质中还存在非线粒体结合的Nurr1,两者互相制约,使平衡趋向于有利于鼻咽癌细胞存活和侵袭的方向发展。
总之,本研究证明了Nurr1是一个崭新的影响鼻咽癌恶性特征的蛋白分子,其表达水平及在胞质的错位分布可能成为判定鼻咽癌恶性程度及预后的分子生物学指标。作为鼻咽癌防治的潜在靶点,有必要对其影响鼻咽癌的分子机制进行更深入的研究。
[1]Chan AT.Nasopharyngeal carcinoma[J].Ann Oncol,2010,21(7):308-312.
[2]Lin JC,Jan JS,Hsu CY,et al.Outpatient weekly neoadjuvant chemotherapy followed by radiotherapy for advanced nasopharyngeal carcinoma:high complete response and low toxicity rates[J].Br J Cancer,2003,88(2):187-94.
[3]Ma BB,Chan AT.Systemic treatment strategies and therapeutic monitoring for advanced nasopharyngeal carcinoma[J].Expert Rev Anticancer Ther,2006,6(3):383-394.
[4]Maijenburg MW,Gilissen C,Melief SM,et al.Nuclear receptors Nur77 and Nurr1 modulate mesenchymal stromal cell migration[J].Stem Cells Dev,2012,21(2):228-238.
[5]Inamoto T,Czerniak BA,Dinney CP,et al.Cytoplasmic mislocalization of the orphan nuclear receptor Nurr1 is a prognostic factor in bladder cancer[J].Cancer,2010,116(2):340-346.
[6]聂鹏,沈玲红,何奔.NR4A孤儿核受体亚家族与动脉粥样硬化[J].心血管病学进展,2011,32(5):640-644.
[7]Wang A,Rud J,Olson CM Jr,et al.Phosphorylation of Nur77 by the MEK-ERK-RSK cascade induces mitochondrial translocation and apoptosis in T cells[J].J Immunol,2009,183(5):3268-3277.
[8]Thompson J,Winoto A.During negative selection,Nur77 family proteins translocate to mitochondria where they associate with Bcl-2 and expose its proapoptotic BH3 domain[J].J Exp Med,2008,205(5):1029-1036.

