吉西他滨的肝脏毒性作用观察
(广西壮族自治区人民医院,南宁 530021)
化疗药物在杀伤肿瘤细胞的同时,对正常组织细胞不可避免地产生损害或毒副作用,大多数化疗药物均可引起一定程度的肝损害。吉西他滨是临床上常用的广谱抗癌药物,骨髓抑制为其主要不良反应[1],其肝脏毒性在不同的文献报道中有较大差异[2~5]。2009年1月 ~2011年6月,我们观察了吉西他滨的肝脏毒性作用,旨在为其临床应用提供依据。
1 材料与方法
1.1 材料 50只昆明种雄性小鼠,体质量(20±2)g,(广西医科大学实验动物中心提供,许可证号:SYKG桂2003-0005)。吉西他滨注射液(江苏豪森药业股份有限公司);丙二醛(MDA)、超氧化歧化酶(SOD)、还原型谷胱甘肽(GSH)试剂盒均由南京建成生物工程研究所提供。数显恒温水浴锅(金坛市医疗仪器厂);Baujahr 2000低温离心机(上海博星基因芯片有限公司);8430紫外—可见分光光度计(美国惠普)。
1.2 动物模型建立 将50只健康昆明种雄性小鼠随机分为观察组40只和对照组10只;观察组静脉注射22.4 mg/mL吉西他滨注射液0.2 mL,对照组静脉注射生理盐水0.2 mL。观察组分别于给药第3、7、11、14 天,对照组在给药第 3 天取血和肝组织进行相关指标检测(取标本前1 d禁食)。
1.3 观察项目
1.3.1 血清生物化学指标 小鼠眼眶采血,3 000 r/min离心10 min,分离血清检测直接胆红素(DBIL)、碱性磷酸酶(ALP)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)水平。
1.3.2 肝组织氧化及抗氧化指标 取小鼠肝组织0.2 g,加4℃生理盐水在冰浴下制成10%肝组织匀浆,将匀浆在4℃离心10 min(4 000 r/min),取上清液,考马斯亮蓝法检测总蛋白含量,按试剂盒方法测定肝组织匀浆MDA、GSH含量和SOD活性。
1.3.3 肝脏组织病理学变化 取同一部位肝组织一小块约10 mm×8 mm×3 mm,用10%甲醛固定,梯度酒精脱水,石蜡包埋、切片5 μm厚,HE染色,光学显微镜下观察。
1.4 统计学方法 采用SPSS13.0统计软件,所得实验数据用±s表示,并进行t检验,组织病理学结果进行秩和检验。P≤0.05为差异有统计学意义。
2 结果
2.1 血清生化指标 两组生化指标比较见表1。
表1 两组生化指标检测结果(n=10,U/L,±s)

表1 两组生化指标检测结果(n=10,U/L,±s)
注:与对照组比较,*P <0.01,△P <0.05
组别D-BIL ALT AST ALP观察组第3 天 0.50 ±0.06* 37.63 ±3.89 101.00 ±6.78△ 289.75 ±11.72*第7 天 0.45 ±0.05△ 35.88 ±4.09 99.00 ±7.60△ 321.50 ±14.73*第11 天 0.49 ±0.07* 38.38 ±2.45 95.00 ±5.55△ 321.88 ±13.03*第14 天 0.53 ±0.04* 32.88 ±2.80 98.88 ±4.67△ 278.88 ± 9.55*对照组0.36 ±0.05 36.88 ±4.07 73.63 ±7.74 91.88 ± 6.85
2.2 肝组织氧化及抗氧化指标 见表2。
表2 两组氧化及抗氧化指标比较(n=10,±s)

表2 两组氧化及抗氧化指标比较(n=10,±s)
注:与对照组比较,*P <0.01,△P<0.05
组别 MDA(nmol/mg) GSH(mg/g) SOD(U/mg)观察组第3 天 243.82 ±15.27* 23.00 ±1.89* 58.63 ±3.97△第7 天 267.66 ±25.76* 28.83 ±2.72* 52.94 ±2.93△第11 天 226.63 ± 7.44* 31.40 ±3.51* 56.88 ±4.84△第14 天 223.10 ±13.37* 25.95 ±5.48* 54.38 ±2.63△对照组124.98 ±10.14 53.95 ±1.76 66.43 ±4.63
2.3 肝脏组织病理学变化 观察组在给药第3天即出现肝细胞病理改变,均出现肝细胞脂肪变性,整个肝小叶弥漫受累,根据肝细胞脂肪变性程度分级[6],大部分为重度脂肪变性;17 例(42.5%)出现肝细胞坏死,点状坏死多见,周围有炎性细胞,极少数可见桥接坏死;11例(27.5%)出现肝细胞瘀胆。观察组病理改变程度与对照组比较,经秩和检验,有显著性差异,详见表3。
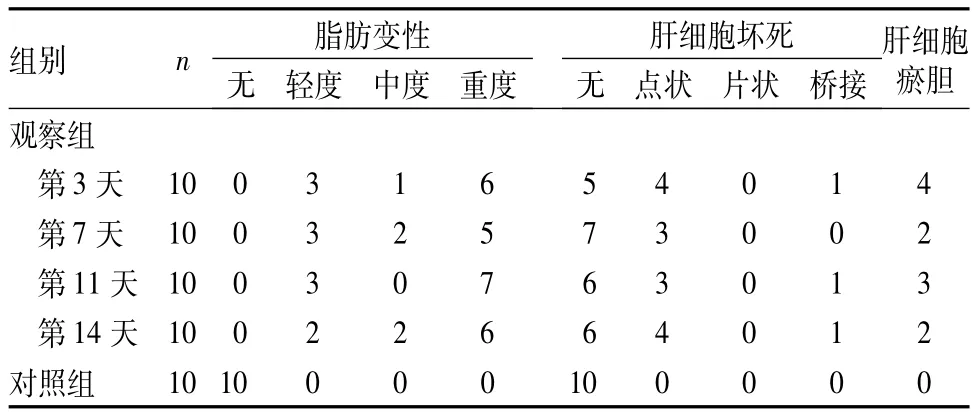
表3 两组病理结果比较(例)
3 讨论
化疗是肿瘤治疗的主要手段之一,抗肿瘤药物大多为细胞毒药物,在杀伤肿瘤细胞的同时,对正常组织细胞不可避免地产生损害或毒副作用,大多数化疗药物在临床应用中出现一定程度的肝损害。吉西他滨是临床上常用的广谱抗癌药物,为肺癌、乳腺癌及卵巢癌等化疗方案中的主要药物,骨髓抑制为其主要不良反应[1]。关于吉西他滨的肝脏毒性近年来报道较多[4,5,7]。本研究结果显示,吉西他滨在给药第3天即出现组织病理改变及相关指标异常。说明无药物防护情况下,临床剂量的吉西他滨在用药第3天即可能引起肝脏细胞损伤。本研究发现,吉西他滨给药第3天肝组织脂质过氧化物MDA较对照组明显升高,抗氧化成分GSH和SOD明显降低,一直延续至实验结束,符合药物诱导肝脏损伤的氧化应激反应机制,即药物诱导的肝脏损伤与药物的代谢异常有密切关系。药物本身含有的及经CYP450酶系代谢产生的自由基、亲电子基、氧基等有害活性物质,通常与GSH结合而解毒,并不产生肝损伤,而某些因导致肝组织抗氧化防御体系(GSH等)功能下降时,引发脂质过氧化,肝组织脂质过氧化链式反应的终产物之一——MDA升高,导致肝脏氧化应激损伤,轻者为脂肪变性(具有可逆性),重者可发生中毒性肝细胞坏死[8,9]。
鉴于氧化应激反应在化疗性肝损伤中的作用,临床使用吉西他滨化疗期间应及早应用抗氧化剂,以减轻肝脏毒行。
[1]孙燕.抗肿瘤药物手册[M].北京:北京大学医学出版社,2007:174-176.
[2]朱巧兰,林能明,程斌.吉西他滨单一化疗200例肿瘤患者不良反应分析[J].中国肿瘤,2002,11(11):677-678.
[3]李苏霞,曾谦,刘洁凡,等.吉西他滨致严重肝功能衰竭二例报告[J].中华肿瘤防治杂志,17(3):237-243.
[4]Robinson K,Lambiase L,Li J,et al.Fatal cholestatic liver failure associated with gemcitabine therapy[J].Dig Dis Sci,2003,48(9):1804-1808.
[5]Matsuda M,Watanabe G,Mine S,et al.Fatal liver failure associ-ated with gemcitabinehydrochloride therapy[J].Gan To Kagaku Ryoho,2008,35(1):157-159.
[6]周晓军,张丽华.肝脏诊断病理学[M].南京:江苏科学技术出版社,2006:15-16.
[7]Tanaka H,Takamori H,Eto S,et al.Acute liver injury with hepatic encephalopathy associated with gemcitabine administration for adjuvant chemotherapy in an HBV carrier with pancreatic cancer[J].Gan To Kagaku Ryoho,2010,37(9):1783-1786.
[8]李钦民,韩真.药物性肝病发病机制的研究进展[J].实用肝脏病杂志2005,2(8):124-126.
[9]Curtis D.卡萨瑞特道尔毒理学:毒物的基础科学[M].北京:人民卫生出版社,2005:419-420.

