吡咯烷二硫代氨基甲酸酯对2型糖尿病大鼠肾脏的保护作用*
张新杰,刘建坤,高冬梅,张怡梅,朱铁年△,赵瑞景
(1白求恩国际和平医院肿瘤科,河北 石家庄 050082;2邯郸市中心医院内分泌科,河北 邯郸 056001;3河北医科大学免疫学教研室,河北 石家庄 050017)
目前,全球糖尿病(diabetes mellitus,DM)患病率不断增加,其慢性并发症是致盲、致残、致死的主要原因。据统计超过1/3的DM患者会发生并发症,而且超过70%DM患者死于糖尿病血管病变[1]。糖尿病肾病(diabetic nephropathy,DN)是糖尿病主要的微血管并发症之一,其发病机制尚未完全阐明,近年来氧化应激在其发病中的作用越来越受到重视。本研究旨在探讨抗氧化剂吡咯烷二硫代氨基甲酸酯(pyrrolidine dithiocarbamate,PDTC)对糖尿病肾脏的保护作用及机制。
材料和方法
1 材料
链脲佐菌素(streptozotocin,STZ)及PDTC均购于Sigma;兔抗诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和鼠抗硝基酪氨酸(nitrotyrosine,NT)抗体购于Santa Cruz;PV6001试剂盒、PV6002试剂盒和DAB显色剂购于北京中杉金桥生物技术有限公司;快速血糖仪购于强生公司;超氧化物歧化酶(superoxide dismutases,SOD)、丙二醛(malondialdehyde,MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒购于南京建成生物科技公司。清洁级雄性Wistar大鼠37只,体重180~210 g,购于河北医科大学动物中心[许可证号(冀)2008-1-003,批号为 901010]。高脂饲料参照Reed等[2]报道的配方自行配制,其中普通饲料热量组成比值为:碳水化合物占65.5%,脂肪占10.3%,蛋白质占24.2%。高脂饲料热量组成比值为:碳水化合物占39%,脂肪占42%,蛋白质占18%,其中脂肪主要为熟猪油和蛋黄粉。
2 方法
2.1 2型糖尿病大鼠模型的建立 参照Reed等[2]方法建立2型糖尿病大鼠模型。所有大鼠经适应性喂养1周后,随机分为2组:正常对照组12只,高脂饮食组25只,分别给予普通饲料和高脂饲料喂养。2组大鼠均自由饮水摄食,昼夜周期12 h,室温控制在(24±4)℃,每周观察大鼠体重、血糖变化。喂养8周后,高脂组按27 mg/kg体重一次性腹腔注射STZ,72 h后测血糖值,以随机血糖≥16.7 mmol/L为2型糖尿病大鼠造模成功,共成模24只。将成模大鼠随机分为2组,糖尿病模型组12只,PDTC治疗组12只。PDTC治疗组大鼠腹腔注射PDTC(50 mg·kg-1·d-1),正常对照组、糖尿病组大鼠每天给予同体积的生理盐水腹腔注射。治疗1周后,禁食12 h,断头处死,留取血浆及肾脏组织进行相关指标检测。
2.2 血糖测定 采用快速血糖仪测定。
2.3 肾皮质匀浆中MDA含量、SOD和 GSH-Px活性的测定 取组织块,称重,放入玻璃匀浆管中,加入预冷的生理盐水,生理盐水的量是组织重量的9倍,充分匀浆10 min左右,低温离心机3000r/min离心10~15 min,留上清弃沉淀,然后严格按照试剂盒说明书分别测定SOD和GSH-Px的活性和MDA含量。
2.4 尿微量白蛋白/肌酐的测定 PDTC治疗结束后,收集尿液,使用国产深圳迈瑞BS-120全自动生化分析仪测定尿微量白蛋白/肌酐比值。
2.5 肾脏HE和Masson染色 取肾皮质用10%中性甲醛固定,常规脱水,石蜡包埋后切片,分别进行HE和Masson染色,光镜下观察肾脏形态学改变。
2.6 电镜观察大鼠肾脏组织超微结构变化 取1 mm×1 mm×1 mm大小肾皮质,经前固定、漂洗、后固定、漂洗、脱水、浸透、包埋、聚合、切片、染色等步骤,于日立H-7500透射电镜下观察并拍照。
2.7 免疫组化观察大鼠肾脏组织iNOS和NT表达石蜡切片常规脱蜡至水,3%过氧化氢封闭内源性过氧化物酶,PBS洗5 min×3次,抗原热修复(120℃、2 min),正常山羊血清封闭,室温15 min,倾去血清,滴加Ⅰ抗(兔抗 iNOS 1∶100,鼠抗 NT 1∶60),湿盒中4℃过夜,PBS洗5 min×3次,滴加山羊抗兔(或小鼠)IgG抗体 -HRP多聚体(PV6001、PV6002),37℃孵育1 h,PBS洗5 min×3次,DAB 显色,显微镜下控制反应时间,蒸馏水终止反应;苏木素复染,脱水,透明中性树胶封片,显微镜下观察,细胞质中棕黄色颗粒为阳性。数据处理:采用专业图像分析软件Image-Pro Plus 6.0进行处理。分别挑选高倍镜视野下各组肾皮质内被染成棕黄色的区域作为测量区域,测得切片上阳性染色区域的吸光度值,每张切片分别随机选取20个视野,测量吸光度,取其平均值,作为平均吸光度值,并以此代表实验所研究肾皮质内iNOS和NT的表达强度进行分析。
3 统计学处理
数据用SPSS 13.0软件处理,计量资料以均数±标准差()表示,数据进行正态性检验及方差齐性检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 各组空腹血糖比较
糖尿病模型(DM)组大鼠空腹血糖(26.55±7.10)mmol/L,与正常对照(NC)组(5.58 ±0.43)mmol/L相比明显增高(P<0.01);PDTC治疗(DM+PDTC)组大鼠空腹血糖(11.55 ±2.89)mmol/L,与DM组相比明显降低(P<0.01)。
2 各组大鼠肾皮质中SOD、GSH-Px活性和MDA含量比较
PDTC治疗1周后,DM组大鼠的SOD和GSHPx活性均明显低于 NC组(P<0.01,P<0.05);PDTC治疗组大鼠的SOD和GSH-Px活性均明显高于DM组,显著差异(均P<0.01)。DM组大鼠的MDA含量明显高于NC组(P<0.01);PDTC治疗组MDA含量明显低于DM组(P<0.01),见表1。
表1 各组大鼠肾皮质MDA含量和SOD、GSH-PX活性比较Table 1.Comparison of MDA content,SOD and GSH - Px activity in the cortex of kidney in each group(.n=6)
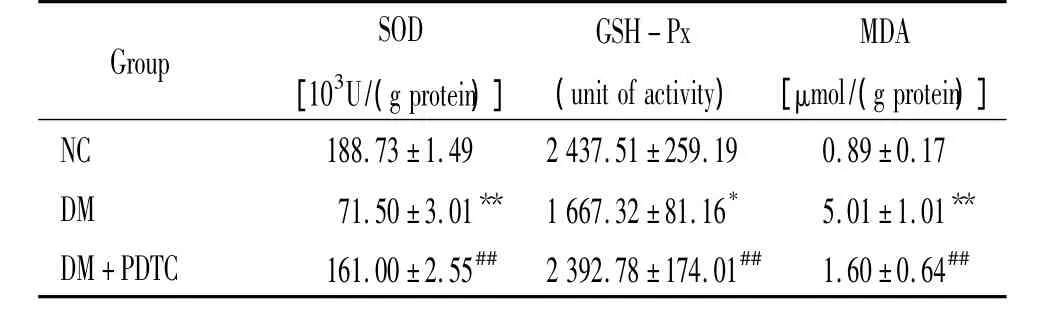
表1 各组大鼠肾皮质MDA含量和SOD、GSH-PX活性比较Table 1.Comparison of MDA content,SOD and GSH - Px activity in the cortex of kidney in each group(.n=6)
NC:normal control group;DM:diabetes group;DM+PDTC:PDTC-treated diabetes group;SOD:superoxide dismutase;GSH- Px:glutathione peroxidase;MDA:malondialdehyde.*P <0.05,**P <0.01 vs NC group;##P <0.01 vs DM group.
Group SOD[103U/(g protein)]GSH-Px(unit of activity)MDA[μmol/(g protein )]NC 188.73±1.49 2437.51±259.19 0.89±0.17 DM 71.50±3.01** 1667.32 ±81.16* 5.01 ±1.01**DM+PDTC 161.00±2.55## 2392.78±174.01## 1.60±0.64##
3 各组大鼠尿微量白蛋白/肌酐的比较
PDTC治疗1周后,DM组大鼠的尿微量白蛋白/肌酐明显高于NC组,显著差异(P<0.01),PDTC治疗组大鼠的尿微量白蛋白/肌酐明显低于DM组,显著差异(P<0.01),见表2。
表2 各组大鼠尿微量白蛋白和尿肌酐的比较Table 2.Comparison of urine microalbumin and urine creatinine in each group(.n=6)
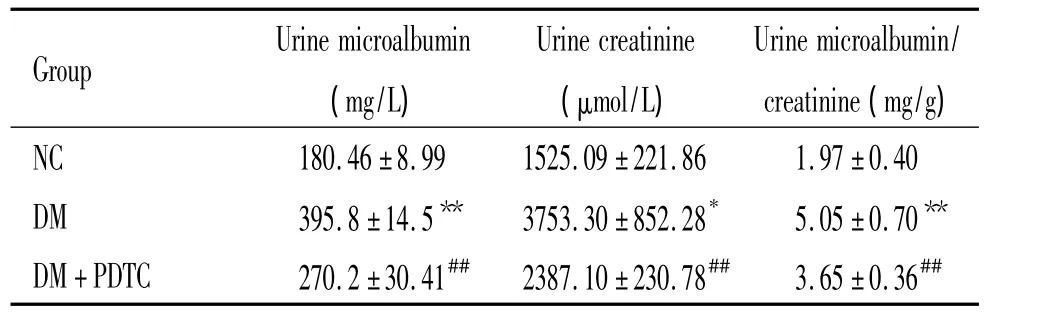
表2 各组大鼠尿微量白蛋白和尿肌酐的比较Table 2.Comparison of urine microalbumin and urine creatinine in each group(.n=6)
*P <0.05,**P <0.01 vs NC group;##P <0.01 vs DM group.
NC 180.46 ±8.99 1525.09±221.86 1.97±0.40 DM 395.8 ±14.5** 3753.30±852.28* 5.05±0.70**DM+PDTC 270.2 ±30.41## 2387.10±230.78## 3.65±0.36##
4 肾脏组织HE及Masson染色(胶原纤维染色)
HE染色光镜下观察,正常对照组肾小球和肾小管结构正常,毛细血管清晰;糖尿病模型组肾小球肥大,肾小球系膜基质增多,可见部分肾小管上皮细胞空泡变性、萎缩、坏死;PDTC治疗组较糖尿病模型组肾小管和肾小球损害减轻,见图1A。Masson染色光镜下观察,糖尿病模型组肾小球肥大,胶原纤维染色绿染面积增多,纤维化明显,球囊扩张明显;PDTC治疗组病理改变较糖尿病模型组明显减轻,见图1B。
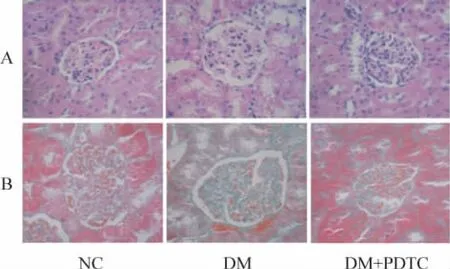
Figure 1.Morphological changes of glomeruli in rat kidneys(×400).A:HE staining;B:Masson staining.图1 大鼠肾脏组织HE和Masson染色观察肾小球形态学变化
5 肾脏组织超微结构改变
透射电镜观察肾皮质超微结构。正常对照组:基底膜正常无增厚,足细胞排列整齐,足突无融合;糖尿病模型组:基底膜高度增厚,厚度不均,有断裂层,足突融合;PDTC治疗组:基底膜轻度增厚,足突有轻度融合,病理改变较糖尿病模型组明显减轻,见图2。

Figure 2.Ultrastrcture of rat kidney cortex observed by transmission eletron microscopy(×20000).Rats in NC group exhibited normal podocyte ultrastructure,including ordered,upright podocyte foot processes(arrows).DM rats exhibited fusion of foot processes,variation of the width of the filtration slits,the broadening of foot processes with a reduction of the number of filtraion processes perunitlength,abd podocyte damage(arrows).PDTC -treated rats exhibited almost normal podocyte ultrastructure(arrows).图2 透射电镜观察大鼠肾脏皮质超微结构
6 各组大鼠肾脏组织iNOS和NT表达情况
iNOS、NT阳性反应物位于胞质中,呈棕黄色。糖尿病模型组iNOS表达水平(0.47±0.08)较正常对照组(0.23±0.02)明显增多(P<0.01);PDTC治疗组iNOS表达水平(0.31±0.05)较糖尿病模型组明显减低(P<0.05),见图3。糖尿病模型组NT表达(0.39 ±0.04)较正常对照组(0.22 ±0.01)明显增多(P <0.01);PDTC 治疗组 NT表达(0.29±0.03)较糖尿病模型组明显减低(P<0.05),见图3。
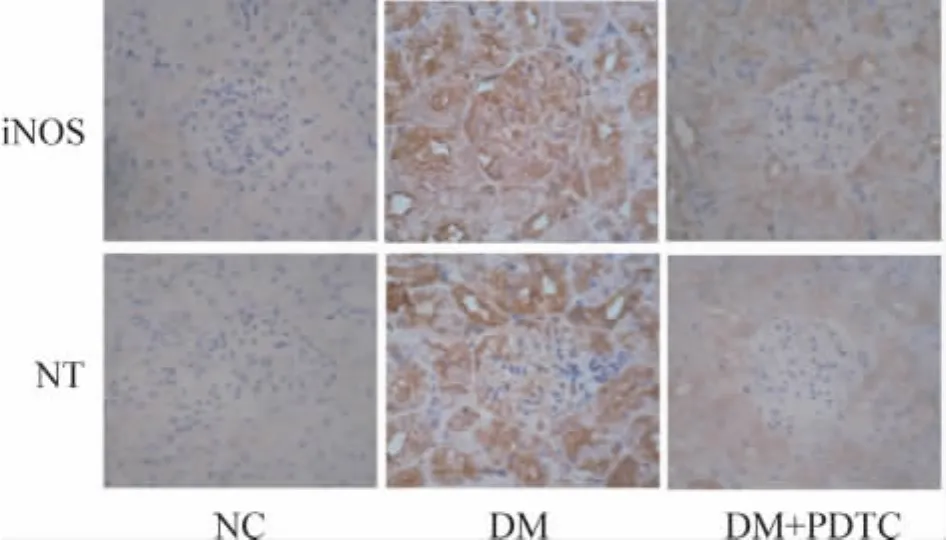
Figure 3.Immunohistochemical staining of iNOS and NT in rat kidneys(×400).图3 免疫组化检测大鼠肾脏组织中iNOS和NT表达
讨 论
DN作为糖尿病的慢性并发症,其发病率随着糖尿病的快速增长而逐年上升,已成为终末期肾病的主要原因。在欧洲发达国家20%~40%的糖尿病患者最终发展为 DN,成为透析治疗患者的首要原因[3],其治疗花费巨大。糖尿病肾病的一个早期指标是尿白蛋白排泄增加,尿微量白蛋白/肌酐是诊断早期糖尿病肾病的一项敏感指标。在本研究中DM组大鼠尿微量白蛋白/肌酐比值明显增高,经PDTC治疗后尿微量白蛋白/肌酐明显减低。DN的主要病理改变是肾小球病变,早期表现为基底膜增厚和系膜基质增多,晚期则表现为硬化性改变,不伴明显细胞增生。目前对其发病机制尚不清楚。最近大量研究发现氧化应激与DN的发生发展密切相关[4]。具有里程碑意义的糖尿病控制和并发症试验(Diabetes Control and Complications Trial,DCCT)和其后续的糖尿病干预和并发症流行病学(Epidemiology of Diabetes Interventions and Complications,EDIC)研究也发现氧化应激和硝化应激在糖尿病并发症的发生发展中起重要作用[5]。
机体进行有氧代谢时,不断地通过非酶促反应和酶促反应产生活性氧簇(reactive oxygen species,ROS),并被胞内、胞外的抗氧化系统有效清除。糖尿病高血糖状态下,以肾组织中糖代谢紊乱为主的多种因素综合造成肾组织中化学性质活泼的ROS产生过多,破坏肾组织正常的清除能力,过多不稳定的ROS将与脂质、蛋白、DNA等分子相互作用导致肾组织学改变和功能异常,造成氧化应激。因此测定体内氧化和抗氧化酶的水平可间接反应肾脏的损伤程度。SOD是超氧阴离子自由基的清除剂,可抑制自由基引起的脂质过氧化反应。GSH-Px是机体内广泛存在的一种重要的催化过氧化氢分解的酶,它特异地催化还原型谷胱甘肽等对过氧化氢的还原反应,可以起到保护细胞膜结构和功能完整的作用。机体通过酶系统与非酶系统产生氧自由基,后者能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化物,如MDA、酮基、羟基或新的氧自由基等。MDA是过氧化脂质降解产物,其含量常可反映机体内脂质过氧化的程度。因而测定MDA的量可反映机体内脂质过氧化程度,间接反映细胞损伤程度[4]。本实验结果显示:DM组大鼠肾皮质中SOD和GSH-PX活性均较NC组明显降低,而MDA含量较NC组明显升高;经PDTC治疗后,SOD和GSH-PX活性明显增加,而MDA含量明显降低。表明在糖尿病大鼠肾脏组织中,氧化与抗氧化系统失衡,抗氧化酶的活性下降,引起系膜细胞损伤。PDTC治疗后,抗氧化酶活性升高,脂质过氧化程度降低,证明PDTC可通过抗氧化来减轻氧化应激对肾脏的损伤。
氧化应激状态下可激活一系列信号通路如NF- κB[6-7]。NF - κB 被活化后上调其下游 iNOS 基因的表达,使NO生成明显增多。NO是一种信息传递分子,容易弥散,半衰期很短,在组织中直接测定非常困难。Kolodziejska等[8]的研究表明,直接检测组织中iNOS可客观反映组织中NO的含量。过量的NO可与超氧阴离子迅速结合生成氧化作用更强的过氧亚硝基阴离子(ONOOˉ),过量产生的ONOOˉ可通过多种机制修饰多种生物分子,导致血管内皮细胞、平滑肌细胞等结构破坏、功能丧失,最终导致糖尿病多种并发症的发生。糖尿病肾病患者肾活检组织和糖尿病动物肾脏组织中ONOOˉ的形成和氧化应激增加[9]。而NT是ONOOˉ在体内生成的特异性标志物,通过检测NT的生成可反映ONOOˉ的产生[10]。
我们课题组和他人的研究已证实,PDTC可降低糖尿病大鼠的血糖水平[11-12]。本研究经 HE及Masson染色发现,糖尿病模型组肾小球肥大,基底膜增厚,系膜间质增多。电镜显示糖尿病模型组基底膜明显增厚,足细胞肿胀,足突融合。免疫组化染色显示糖尿病模型组iNOS和NT表达明显增多,进一步证实糖尿病肾病早期损害与iNOS和NT表达增多有关。经PDTC治疗后肾脏病理改变明显减轻,iNOS和NT表达明显减少。本实验结果提示,PDTC一方面可通过降低血糖控制高糖毒性,另一方面,因PDTC是NF-κB阻断剂,其可能通过阻断NF-κB信号通路,减少iNOS和NT表达,降低氧化应激和硝化应激对肾脏的损害,从而达到对糖尿病肾脏的保护作用。本研究结果为PDTC防治糖尿病肾病提供了实验依据。
[1]Jenkins AJ,Best JD,Klein RL,et al.Lipoproteins,glycoxidation and diabetic angiopathy[J].Diabetes Metab Res Rev,2004,20(5):349-368.
[2]Reed MJ,Meszaros K,Entes LJ,et al.A new rat model of type 2 diabetes:the fat-fed,streptozotocin-treated rat[J].Metabolism,2000,49(11):1390 -1394.
[3]Dronavalli S,Duka I,Bakris GL.The pathogenesis of diabetic nephropathy[J].J Nat Clin Pract Endocrinol Metab,2008,4(8):444-452.
[4]Ha H,Yu MR,Choi YJ,et al.Role of high glucose-induced nuclear factor-κB activation in monocyte chemoattractant protein-1 expression by mesangial cells[J].J Am Soc Nephrol,2002,13(4):894 -902.
[5]Writing Team for the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications and Research Group.Effect of intensive therapy on the microvascular complications of type 1 diabetes mellitus[J].JAMA,2002,287(19):2563-2569.
[6]Kaneto H,Matsuoka TA,Katakami N,et a1.Oxidative stress and the JNK pathway are involved in the development of type l and type 2 diabetes[J].Curr Mol Med,2007,7(7):674-686.
[7]Obrosova IG.Increased sorbitol pathway activity generates oxidative stress in tissue sites for diabetic complications[J].Antioxid Redox Signal,2005,7(11 -12):1543 -1552.
[8]Kolodziejska KE,Burns AR,Moore RH,et al.Regulation of inducible nitric oxide synthase by aggresome formation[J].Proc Natl Acad Sci U S A,2005,102(13):4854-4859.
[9]Ali TK,Matragoon S,Pillai BA,et al.Peroxynitrite mediates retinal neurodegeneration by inhibiting nerve growth factor survival signaling in experimental and human diabetes[J].Diabetes,2008,57(4):889 - 898.
[10]Peluffo G,Radi R.Biochemistry of protein tyrosine nitration in cardiovascular pathology[J].Cardiovasc Res,2007,75(2):291-302.
[11]张利众,赵瑞景,刘建坤,等.吡咯烷二硫代氨基甲酸酯对2型糖尿病大鼠肝糖原合成的影响[J].中国病理生理杂志,2010,26(12):2442 -2446.
[12]Obrosova IG,Julius UA.Role for poly(ADP-ribose)polymerase activation in diabetic nephropathy,neuropathy and retinopathy[J].Curr Vasc Pharmacol,2005,3(3):267-283.

