DC-CIK细胞联合手术治疗原发性肝癌的临床研究
王 郑
重庆市开县人民医院外二科,重庆 405400
原发性肝癌作为一种恶性肿瘤,单纯的肝切除手术治疗不能达到满意的效果。肝癌的发生、发展与机体免疫密切相关[1]。随着免疫分子和细胞生物学的发展,树突状细胞(DC)与细胞因子诱导的杀伤细胞(CIK)联合介导的过继免疫细胞治疗成为手术治疗、化疗、放疗等的重要辅助手段[2-3]。原发性肝癌的治疗手段由单纯手术治疗逐渐向多手段联合治疗发展,成为原发性肝癌治疗发展的新方向。但目前对DC-CIK细胞治疗联合手术治疗的临床研究资料较少,其效果及可靠性尚待进一步研究。本文总结我院DC-CIK细胞治疗联合手术治疗的原发性肝癌患者资料,探讨DC-CIK细胞治疗联合手术治疗原发性肝癌的可行性及适应证。
1 资料与方法
1.1 一般资料
实验组为2007年1月~2009年2月在我院住院治疗的原发性肝癌患者76例,其中,男58例,女18例;平均年龄(48.9±14.7)岁;46例合并乙型肝炎后肝硬化,7例合并门静脉高压;根据肝功能Child-pugh标准分级,患者全部为Child-A 级;甲胎蛋白(AFP)<5 μg/mL 者 4例,AFP<400 μg/mL者39例;AFP≥400 μg/mL者 33例。所有患者或法定代理人知情并签署《知情同意书》,通过医院伦理委员会同意后接受DC-CIK细胞回输治疗。对照组为往年经我院单纯手术治疗的原发性肝癌患者76例,其中,男60例,女16例;平均年龄(49.8±15.3)岁;48例合并乙型肝炎后肝硬化,5例合并门静脉高压;全部为Child-A级患者;AFP<5 μg/mL者5例,AFP<400 μg/mL 者 39例;AFP ≥ 400 μg/mL 者 32例。 对照组与实验组严格按病情、年龄进行1∶1匹配,年龄相差2岁为宜,两组不同病情所占相应比例差异无统计学意义 (P>0.05),两组具有可比性。
1.2 纳入标准
①肝内多发肿瘤病灶≤3个;②主病灶≥5 cm,子病灶≤3 cm且与主病灶分属不同肝段;③无门静脉主干、下腔静脉、肝静脉、肝静脉癌栓,排除肝外转移。肿瘤的数目与位置通过B超和MRI共同定位。
1.3 方法
1.3.1 实验组与对照组治疗方法 实验组患者采用联合手术治疗和自体DC-CIK细胞回输方法治疗,对照组只接受单纯手术治疗。
1.3.2 手术方法 患者病灶均进行右上腹“┙”形切口,按照肝癌切除“左规右不规”原则对主病灶先行切除,然后缝扎创面并止血。术后第3、7、14天定期复查肝功能、AFP,如发现并发症及时对症处理。术后每个月定期复查CT、肝功能和AFP,判断患者与肿瘤的发展及转归情况,根据实际情况行肝动脉栓塞化疗或其他补充治疗。
1.3.3 自体DC-CIK细胞制备方法 DC细胞:采用血细胞分离机分离患者外周血单个核细胞,体积为0.3倍血容量。采用Ficoll淋巴细胞分离液从单个核细胞分离淋巴细胞,用培养液洗涤2次,BIN无血清培养基混悬于培养瓶中,置37℃5%CO2孵育箱中,2 h后将悬浮细胞移出,加入IL-4(500 U/L)、GM-CSF(1 000 U/mL)继续培养,2~3 d换液 1次,第 6 天加入TNF-α(500 U/mL)。CIK细胞培养:分离后加入重组人IFN-γ(1 000 U/mL)和10%AB 型人血清的 RPMI 1640培养液,24 h后更换成含100 ng/mL小鼠抗人CD3单克隆抗体、1 000 U/mL IL-1和IL-2的RPMI 1640完全培养液继续培养,2 d后换含IL-2的完全培养液隔日换液维持培养。DCCIK细胞培养:采集第7天的DC和CIK细胞,按1∶5混合培养,3 d 后开始应用。控制标准:CD3+、CD56+、NKT≥50%,CD3+CD8+≥30%,细胞存活率≥95%,不含细菌和内毒素。
1.3.4 DC-CIK细胞回输方法 静脉输注DC-CIK细胞5×109/L,4次为1个疗程,每例患者至少治疗3个疗程,最多治疗8个疗程。
1.4 疗效评价
疗效评价按照RECIST实体瘤近期疗效评价标准进行,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。总有效=CR+PR+SD。同时随访观察3年生存率。
1.5 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般恢复情况比较
治疗前,实验组与对照组各方面差异均无统计学意义(P>0.05)。治疗后,实验组各方面恢复情况均优于对照组,差异有统计学意义(P<0.05)。两组患者一般情况均较治疗前好转,精神状态、食欲、睡眠及生活质量均有所提高,疼痛减轻患者增多,差异有统计学意义(P<0.05)。见表1。
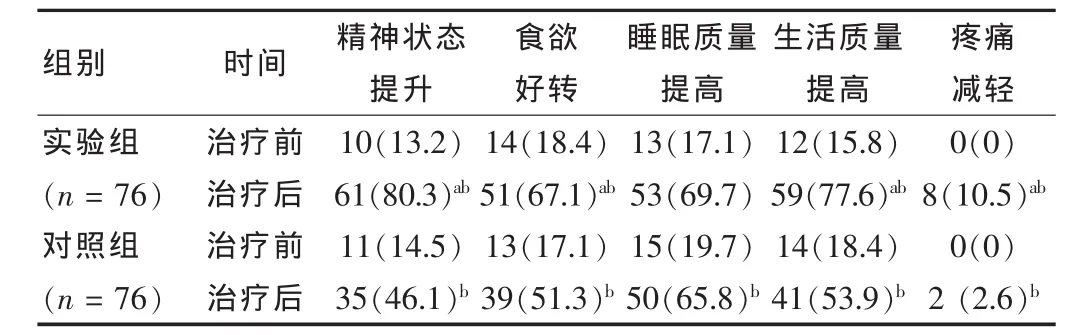
表1 两组患者治疗前后一般恢复情况比较[n(%)]
2.2 两组临床疗效比较
实验组疗效评定:CR 0例,PR 43例,SD 22例,PD 11例,治疗总有效率为85.5%;对照组疗效评定:CR 0例,PR 24例,SD 7例,PD 39例,治疗总有效率为40.8%。实验组总有效率较对照组高,差异有高度统计学意义(P<0.01)。见表2。
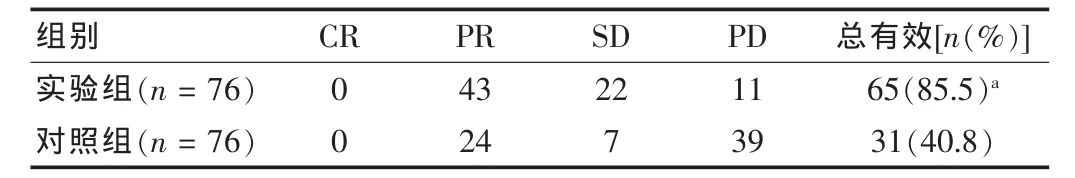
表2 两组临床疗效比较(例)
2.3 两组3年生存率比较
实验组经过手术治疗联合自体DC-CIK细胞回输后,每隔6个月进行随访,生存36个月以上者7例,生存25~36个月者11例,生存13~24个月者19例,生存6~12个月者34例,少于6个月者5例(主要是肝硬化伴腹水病例),3年生存率为9.2%。对照组生存36个月以上者3例,生存25~36个月者3例,生存13~24个月者13例,生存6~12个月者26例,少于6个月者30例,3年生存率为3.9%。两组比较,差异有高度统计学意义(P<0.01)。见表3。

表3 两组3年生存率比较[n(%)]
2.4 不良反应情况
两组均未见有明显心、肝、肾等毒副作用。
3 讨论
随着社会经济水平的飞速发展,人们生活压力加大,环境、饮食也不断受到污染,种种原因导致癌症的发病率不断升高,其中,原发性肝癌是一种常见的恶性肿瘤,其发生率逐年上升,成为严重危害人类身心健康的恶性疾病。我国是肝癌的高发国家之一,其对我国社会经济等造成的损失较为严重,已成为严重影响我国公民生命的危险之一[4]。由于原发性肝癌发病非常隐匿,发病初期患者无任何不适感并且极易忽视相关症状,当患者察觉机体出现病症和不适感时,大都进入晚期,此时再进行手术治疗已经无法阻止疾病的发展。手术时机是手术治疗该病的关键。随着现代科学技术的发展,肝动脉栓塞化疗、放疗等新方法不断产生,但尚无一种有效的治疗方法,手术治疗仍然是主导方法[5-6],其他方法也仅仅作为辅助方法进行治疗。
免疫分子和细胞生物学的发展越来越趋于成熟,DCCIK细胞介导的过继免疫细胞治疗成为手术治疗、化疗、放疗等方法的重要辅助手段[7]。免疫细胞的回输对术后肝癌患者的恢复起到明显的促进作用,笔者研究发现,手术治疗联合DC-CIK细胞回输后,患者的精神状态、睡眠质量,生活质量等均有明显提升,肝区疼痛率明显降低。手术治疗与肿瘤细胞免疫治疗的联合治疗越来越受到重视。本研究发现,手术治疗联合自体DC-CIK细胞回输治疗,除了可以明显提高患者的生活质量外,而且对机体的心、肝、肾等组织基本无毒副作用,可以作为手术的辅助手段进行治疗。经RECIST实体瘤近期疗效评价标准进行评定的结果显示,手术治疗与肿瘤细胞免疫治疗的联合治疗可以明显提高手术患者治疗效果,缓解病情的效果较好,能有效使病情趋于稳定,与单纯进行手术治疗相比,总体治疗有效率明显提高,分析可能与免疫细胞的增强可以通过分泌一些细胞因子发挥重要作用有关[8]。经过3年的随访和对对照组患者资料的回顾,发现患者术后经过DC-CIK细胞回输治疗可以使病情稳定,生存率明显提高,特别是1年以上生存率提高最明显,说明手术联合自体DC-CIK细胞回输治疗可以大大提高患者生存率,治疗效果较单纯手术治疗好。可能机制为 CIK在体内可以黏附并穿过内皮细胞准确定位到血管外的肿瘤组织,进而杀伤肿瘤细胞,改造机体的内免疫环境,在DC细胞的存在下体液免疫也被活化进而可以起到协同作用[9-10],从而起到促进康复、遏制肿瘤的作用。
随着人们对生命质量的重视,疾病治疗势必向高效、无毒副作用的方向发展,单纯的手术治疗已经不能满足患者的需求,但目前尚无方法代替手术治疗,因此,积极寻求术后有效的辅助治疗方法势在必行。笔者对该方面进行了研究,以期寻找较好较可靠的辅助治疗手段。经过笔者的临床研究证实,手术治疗联合自体DC-CIK细胞回输疗法对原发性肝癌的疗效值得肯定,治疗有效率和生存率均有较大提高,但尚有不足之处,有待进一步完善。
[1]陈复兴,刘军权,张南征,等.自身细胞因子的杀伤细胞过继免疫治疗恶性肿瘤的临床研究[J].癌症,2002,21(7):797-801.
[2]Quah B,O'Neill HC.Review:the application of dendritic cell derived exosomes in tumour immunotherapy[J].Cancer Biother Radiop Harm,2000,15(2):185-194.
[3]Meidenbauer N,Andreesen R,Mackensen A.Dendritic cells for specific cancer immunotherapy[J].Biol Chem,2001,382 (4):507-520.
[4]钱明,袁君君,汤艳平.肿瘤标志物AFP、CA125、CA199在原发性肝癌诊断中的应用[J].中外医学研究,2011,9(29):58-59.
[5]栾瑞申,辛建会.151例原发性肝细胞肝癌外科治疗体会[J].中国医药导报,2007,4(20):20-21.
[6] 邱寿庆.原发性肝癌的治疗进展[J].中外医学研究,2010,8(27):194-195.
[7]李艳平,周凡.CIK与DC细胞免疫治疗在恶性肿瘤中的研究进展[J].沈阳部队医药,2011,24(5):350-353.
[8]Marten A,Ziske C,Schottker B,et al.Interactions between dendritic cells and cytokine-induced killer cells lead to an activation of both populations[J].Immunotherapy,2001,24:502-510.
[9]曹雪涛.树突状细胞与肝癌的免疫治疗[J].中华肝脏病杂志,2003,11(3):133.
[10]王国俊,马清涌,张梅,等.树突状细胞介导的T淋巴细胞对肝癌细胞的特异性杀伤效应[J].西安交通大学学报:医学版,2005,26(3):257-259.

