BUT-6010的抗肿瘤活性实验研究
王燕萍 张 宁 沈晓燕 陈海波 胡云雁 谭芬来
浙江贝达药业北京新药研发中心,北京 100176
铂类药物是临床治疗肿瘤应用较多的抗癌药物之一,20世纪60年代顺铂(Cisplatin)抗癌作用的发现拉开了铂类抗肿瘤药物研究的序幕。随着人们对金属配合物的结构和药理作用认识的进一步深入,新的高效、低毒、具有抗癌活性的铂类配合物不断被研制出来[1-2],特别是顺铂和卡铂(Carboplatin)是目前临床上使用最广的抗癌药物之一,是治疗许多肿瘤的首选药物。但是目前临床使用的铂类抗癌药对肿瘤细胞无特异选择,导致用药过程中出现副作用如神经毒性、肾毒性、耳毒性、恶心呕吐等,且容易产生耐药性,这些因素限制了它们在临床上更广泛的应用[2-5]。因此,寻找和设计合成出对肿瘤细胞有选择杀伤作用、使用安全,而不易产生耐药性的新一代铂类抗癌药已显得十分迫切。BUT-6010是以顺铂、卡铂的结构为基础,按照经典的构效关系设计和合成的新铂类配合物,旨在通过改变载体或离子基团来改善铂类抗癌药的药代动力学特性,以提高疗效或降低毒副作用。本文旨在研究BUT-6010的抗肿瘤活性。
1 材料与方法
1.1 细胞系和动物
HepG2、Hep3B、PLC/PRF/5、786-0、Caki-1、MDA-MB-231、HCT-116、NCI-H460、SK-OV-3 共 9 种人癌细胞株,购于中国医学科学院干细胞医学中心;健康ICR小鼠43只,由北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2009-0004。
1.2 药物
BUT-6010,由浙江贝达药业提供,批号:20101227;顺铂,购于南京制药厂有限公司,批号:20081202。
1.3 试剂和仪器
1.4 细胞培养
HepG2细胞和PLC/PRF/5细胞用DMEM培养基,Hep3B细胞用MEM培养基,786-0细胞株和NCI-H460细胞株用RPMI1640培养基,Caki-1细胞株、HCT-116细胞株和SKOV-3细胞株用McCoy's5A培养基,MDA-MB-231细胞株用L15培养基。细胞均在含10%FBS的培养液中37℃,5%CO2,95%湿度条件下培养。
1.5 试验方法
1.5.1 体外对肿瘤细胞生长的抑制作用 肿瘤细胞株分为BUT-6010组、顺铂阳性对照组、细胞对照组、培养基空白对照组。BUT-6010和顺铂稀释成系列浓度100.000 0、31.600 0、10.000 0、3.160 0、1.000 0、0.316 0、0.100 0、0.031 6 μmol/L。取对数生长期细胞,细胞计数器计数,台盼蓝拒染法测定活细胞大于 95%。96 孔板中加 90 μL 细胞悬液,5×103cells/well,各浓度设3个复孔。培养24 h后每孔加入10 μL相应药物溶液。培养48 h后,每孔加20 μL MTS/PMS混合液,总反应体积 120 μL。 继续 37°C、5%CO2培养 4 h,490 nm 处读值[6]。
1.5.2 体内对S180瘤重的影响 选择S180瘤源动物,脱颈处死,置于75%酒精中消毒2 min,剪开并剥去腹部皮肤,用空针吸取腹水10 mL,放入无菌离心管中离心(1 000 r/min),去上清液,加生理盐水吹打细胞使之成为均匀溶液,二次离心,去上清液,再次洗涤,加生理盐水吹打使之成为瘤细胞的均匀溶液,0℃保存。用生理盐水稀释细胞悬液至2×107个/mL,于右侧腋窝皮下接种0.2 mL。接种后第5天小鼠按肿瘤体积分为5组:模型组、顺铂阳性对照组(2.5 mg/kg)、BUT-6010 30 mg/kg组、BUT-6010 20 mg/kg组、BUT-6010 10 mg/kg组。模型组腹腔注射生理盐水,其余各组腹腔注射相对应药物,给药体积为10 mL/kg,隔天给药1次,给药10 d。末次给药48 h后脱颈椎处死小鼠,取肿瘤及各脏器(胸腺、心、肝、脾、肺、肾)称重并记录,统计各组瘤重、脏器系数,计算抑瘤率[7]。
1.6 统计学方法
数据使用SPSS 13.0软件分析,计量资料数据以均数±标准差()表示,采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 体外对肿瘤细胞生长的抑制作用
实验结果显示,BUT-6010 对 HepG2、Hep3B、PLC/PRF/5、786-0、Caki-1、MDA-MB-231、HCT-116、NCI-H460、SKOV-3这9种人癌细胞株的IC50均小于顺铂,见表1。
2.2 体内对S180瘤重的影响
实验结果显示,BUT-6010(30 mg/kg)和顺铂(2.5 mg/kg)均有显著的抑瘤作用,均对动物体重有影响,见图1及表2。
3 讨论
顺铂是目前临床上使用最广的抗癌药物之一,其作用机制是与肿瘤细胞的DNA结合,阻止DNA的合成与复制,抑制细胞分裂,最终杀死肿瘤细胞[7-10]。顺铂因其严重的毒副作用、低溶解性和耐药性,限制了临床应用剂量和疗效。经历了几十年的研究发展,一系列铂类化合物如卡铂、奥沙利铂、奈达铂、庚铂、洛铂等已用于临床治疗癌症[11]。这些铂类化合物扩大了抗癌谱,不同程度减轻了肾毒性、神经毒性、胃肠道反应、骨髓抑制等不良反应。抗肿瘤活性的广谱性带来的非特异性是造成毒副作用的主要原因,因此寻找在保留抗肿瘤活性基础上具有低毒副作用的铂类抗肿瘤药物已成为当前的主要研究方向。本实验改变顺铂或卡铂配位体,设计了新型的顺铂或卡铂类似物BUT-6010,旨在降低铂类药物耐药性和毒性,改善治疗效果。
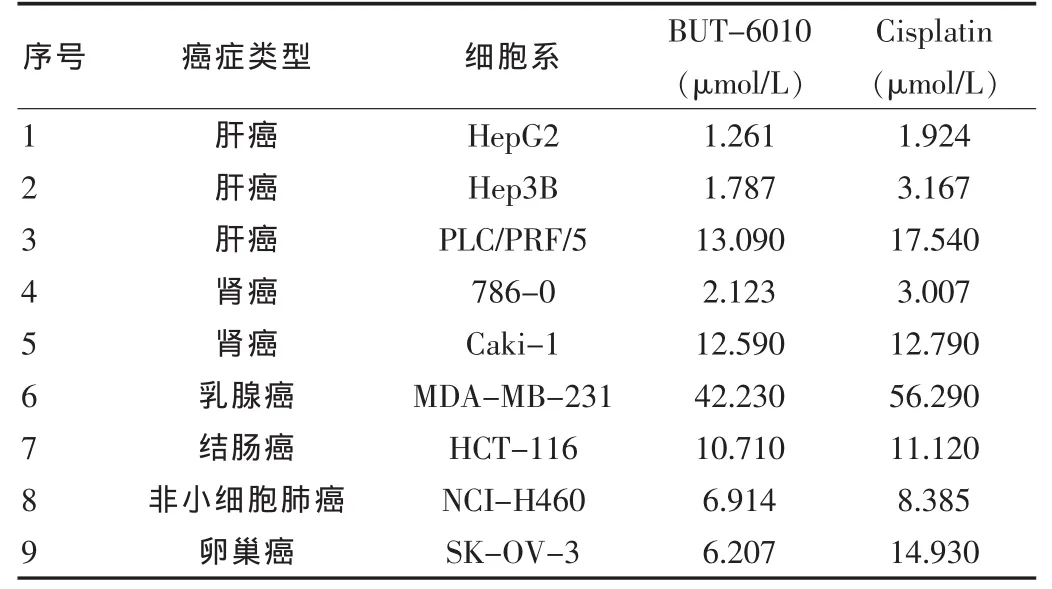
表1 MTS法测BUT-6010对9种人源肿瘤细胞系的IC50
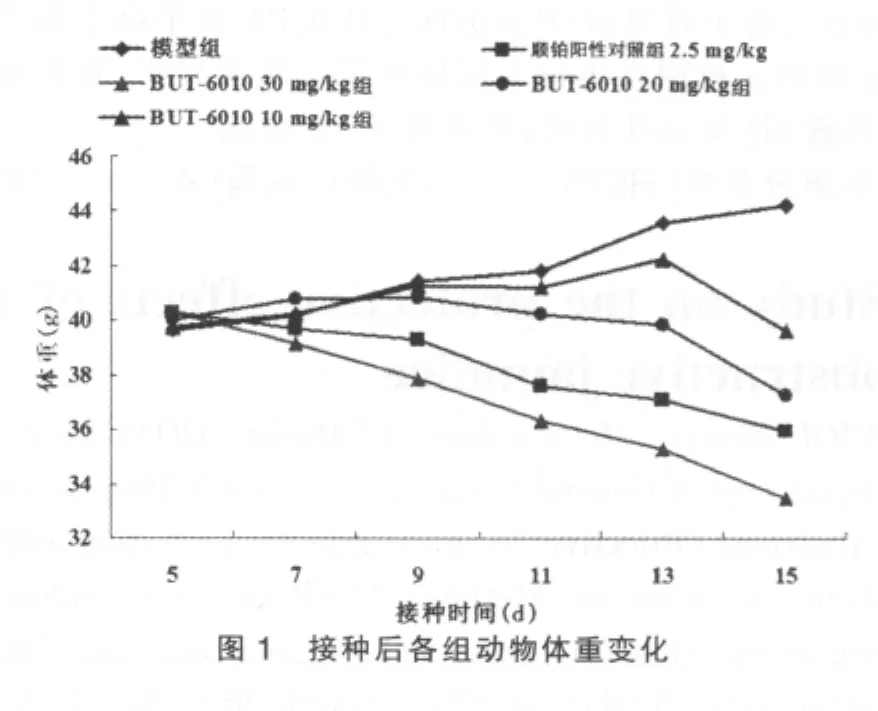
体外 9种人源肿瘤细胞株 HepG2、Hep3B、PLC/PRF/5、786-0、Caki-1、MDA-MB-231、HCT-116、NCI-H460、SKOV-3筛选实验中,BUT-6010的IC50均小于顺铂,表明BUT-6010对在体外有广谱抗肿瘤活性,对肿瘤细胞生长的抑制作用强于顺铂。BUT-6010抑制肿瘤细胞增殖作用的强弱规律也基本类似于顺铂。S180荷瘤小鼠的体内实验中,BUT-6010(30 mg/kg)和顺铂(2.5 mg/kg)均有显著的抑瘤作用,抑瘤率分别为52.8%、51.8%,同时BUT-6010的不良反应导致的小鼠体重下降在高剂量时表现较明显。试验需进一步研究BUT-6010对其他类型动物和人肿瘤模型的抗肿瘤作用,全面评价药物体内作用,逐步揭示抗其肿瘤活性机制,为临床试验研究的开展提供依据。
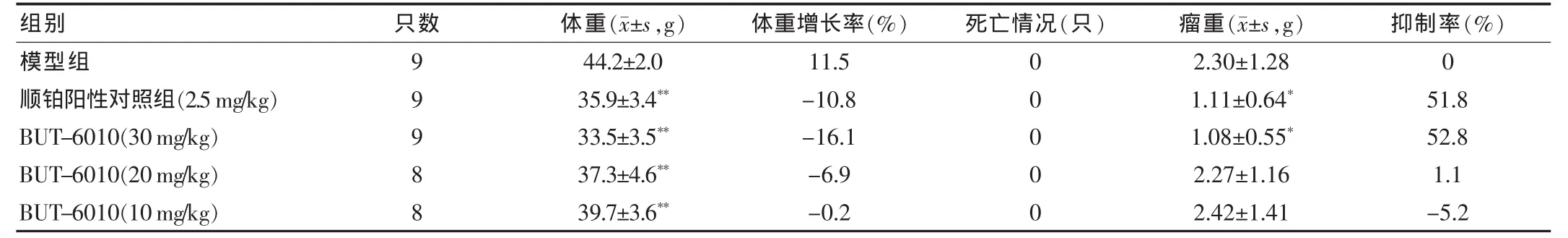
表2 BUT-6010体内对荷S180小鼠瘤重的影响
[1]Komeda S.Drug discovery research on in vivo antitumor-active azolatobridged dinuclear Pt(Ⅱ) complexes[J].Yakugaku Zasshi,2012,132(3):253-259.
[2] 金雪梅.铂类药物的毒性作用与预防措施[J].现代医药卫生,2010,26(21):3294-3295.
[3]Uehara T,Yamate J,Torii M,et al.Comparative Nephrotoxicity of Cisplatin and Nedaplatin:Mechanisms and Histopathological Characteristics[J].J Toxicol Pathol,2011,24(2):87-94.
[4]Amptoulach S,Tsavaris N.Neurotoxicity caused by the treatment with platinum analogues[J].Chemother Res Pract,2011,2011:843019.
[5]Kozubík A,Vaculová A,Soucek K,et al.Novel Anticancer Platinum(IV)Complexes with Adamantylamine:Their Efficiency and Innovative Chemotherapy Strategies Modifying Lipid Metabolism[J].Met Based Drugs,2008,2008:417897.
[6]王洪燕,全康,蒋燕灵,等.木犀草素抗肿瘤细胞增殖及增敏抗肿瘤药物作用研究[J].浙江大学学报,2010,39(1):36-42.
[7]张佳丽,王增,庄蓓蓓,等.二氢青蒿素联合环氧化酶2抑制剂抗S180肉瘤作用机制研究[J].中国药理学通报,2009,25(3):308-312.
[8]宣丽君.吉西他滨联合顺铂治疗晚期乳腺癌的疗效观察[J].中国当代医药,2011,18(5):44-44.
[9]李喜茹.多西紫杉醇联合顺铂同步放疗不可手术胃癌的疗效分析[J].中国当代医药,2011,18(36):66-67.
[10]李静静.顺铂联合多西他赛或吉西他滨治疗晚期非小细胞肺癌的临床对照研究[J].中国当代医药,2011,18(11):54-55,58.
[11]林晓雯,张艳华.铂类抗肿瘤药的进展与临床评价[J].中国医院用药评价与分析,2011,11(1):4-6.

