Caspase抑制剂F1013对刀豆蛋白A诱导小鼠急性肝损伤的治疗作用
邓利娟,李湛军,罗 楹,范慧红
(1.中国食品药品检定研究院,北京 100050;2.上海睿星基因技术有限公司,上海 201203)
急、慢性肝脏疾病是临床上常见病、多发病,严重危害着人类健康。因此寻找高效低毒的抗肝损伤药物一直是新药研究领域的热点之一。F1013为在研一类新药,其化学名称为3-(2-苄氧羰基氨基-3-甲基-丁酰胺基)-5-氟-4-氧代-戊酸,是人工合成的二肽衍生物,体外分子生物学及细胞学研究表明,F1013具有广谱抑制半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)的作用,在D-氨基半乳糖联合脂多糖所致肝损伤模型中,F1013保肝降酶作用明显[1-2]。本研究采用刀豆蛋白A(ConA)诱导的小鼠肝损伤模型,进一步探讨F1013对急性肝损伤的治疗作用及有关机制。
1 材料与方法
1.1 药物 F1013为白色粉末,纯度为98.74%,批号为MC08261-27-2,由上海睿星基因技术有限公司提供。临用时称取150.0 mg F1013加8 ml丙二醇和2 ml pH 4.0的醋酸-醋酸钠缓冲液,置60℃水浴搅拌30 min至完全溶解后,加生理盐水65 ml配成2 g·L-1溶液,再用生理盐水稀释至所需浓度。N-乙酰半胱氨酸(N-acetylcysteine,NAC),原料药,日本Kyowa Hakko Kogyo公司产品,使用前用生理盐水稀释配制。
1.2 试剂和仪器 刀豆蛋白A(concanavalin A,ConA)、碘化丙啶(propidium iodide,PI)、RNase A 和Triton X-100均为美国Sigma公司产品;丙氨酸转氨酶(ALT),天冬氨酸转氨酶(AST)和总胆红素(TBil)(钒酸盐法)试剂盒为中生北控生物科技股份有限公司产品;小鼠TNF-α ELISA试剂盒为北京四正柏生物科技有限公司产品。GS-15R低温离心机(BECKMAN,德国);7060型全自动生化分析仪(HITACHI,日本);流式细胞仪(BD,美国);酶标仪(MD,美国);生物显微镜(OLYMPUS,日本)。
1.3 实验分组及给药 BALB/c小鼠60只,18~20 g,♂,SPF级,由中国食品药品检定研究院实验动物中心提供[SCXK(京)2009-0017]。按体重随机分成6组:对照组、模型组、阳性药组(NAC 155 mg·kg-1)和 F1013 高、中、低剂量组(5、2.5、1.25 mg·kg-1),每组10只。实验前禁食16 h,除对照组外,其他组均尾静脉注射(iv)20 mg·kg-1ConA生理盐水溶液造模。造模后2 h,阳性药组腹腔注射(ip)NAC溶液,F1013给药组和模型组分别皮下注射(sc)不同剂量的F1013溶液和溶媒。造模后8 h,小鼠眼静脉丛取血,断头处死小鼠,留取血清和部分肝组织待检。
1.4 病理学检查 常规HE染色,肝组织病理变化用病理指数评定。评定标准为:“0”记整个肝切片无肝损伤病变;“1”记整个肝切片肝发生损伤病变<1/3肝切片;“2”记整个肝切片肝发生损伤病变1/3~2/3肝切片;“3”记整个肝切片肝发生损伤病变>2/3肝切片;每张切片2个视野评定,每组共20个视野评定,得分相加即为肝损伤的病理指数PI值。
1.5 血清生化指标的测定 用7060型全自动生化分析仪上测定血清ALT、AST和T-Bil。TNF-α的检测采用ELISA法,严格按照试剂盒说明书操作。
1.6 流式细胞仪PI法定量分析大鼠肝细胞凋亡的检测 将体积分数70%酒精固定的肝组织用网搓法制作成单细胞悬液,使每份所含细胞数不少于1×106个,用300目铜网过滤去除细胞团块,收集细胞悬液。取上述细胞悬液0.2 ml,加入碘化丙啶(PI)1 ml,在4℃冰箱染色30 min,采用流式细胞仪进行检测,然后用Modifit LT 3.0分析。
2 结果
2.1 F1013对ConA所致急性肝损伤小鼠肝组织病理变化的影响
2.1.1 肉眼观察 对照组肝脏形态正常,被膜光滑、色泽红润、质地柔软。模型组肝脏明显肿胀,略显苍白,表面可见弥漫性出血点及散在淤斑,质地柔软偏韧。其余各组肝脏表面散在点、片状出血点面积较模型组小。
2.1.2 光镜下观察 对照组小鼠肝小叶结构清晰,肝细胞索以中央静脉为中心呈放射状排列,汇管区未见炎细胞浸润,肝窦无扩张及淤血;模型组可见灶状肝细胞核固缩,有核碎裂,散在凋亡小体,凋亡细胞胞核深染,胞质浓缩,染色质成团块状,细胞胞质染色异常,有空泡变性,细胞界限不清现象;坏死区大小不一,灶状坏死区有出血、肝窦内红细胞聚积;F1013(5,2.5 mg·kg-1)组和 NAC(155 mg·kg-1)组肝细胞损伤程度较模型组明显减轻,但NAC(155 mg·kg-1)组减轻程度不及 F1013(5、2.5 mg·kg-1)组,如 Fig 1。
2.1.3 肝组织病理指数 从Tab 1可见,模型组病理指数明显高于对照组(P<0.01),表明肝损伤程度非常严重,模型成立;F1013(5、2.5 mg·kg-1)组和NAC(155 mg·kg-1)组病理指数明显低于模型组,其中,F1013(5 mg·kg-1)组差异具有显著性(P<0.05)。
2.2 F1013对ConA所致急性肝损伤小鼠肝功能的影响 经ConA造模后,模型组小鼠血清ALT,AST和T-Bil水平较对照组明显升高(P<0.01);F1013(5、2.5 mg·kg-1)组和 NAC(155 mg·kg-1)组小鼠血清ALT和AST水平较模型组明显降低(P<0.01 或 P <0.05);F1013(5、2.5、1.25 mg·kg-1)组小鼠血清 T-Bil水平较模型组降低,其中F1013(5 mg·kg-1)组差异具有显著性(P <0.05),如Tab 2。

Fig 1 Effects of F1013 on hepatic tissue of mice with acute liver injury induced by ConA(HE×200)
Tab 1 Quantitative evaluation of inflammation of hepatic histology in mice(±s,n=10)
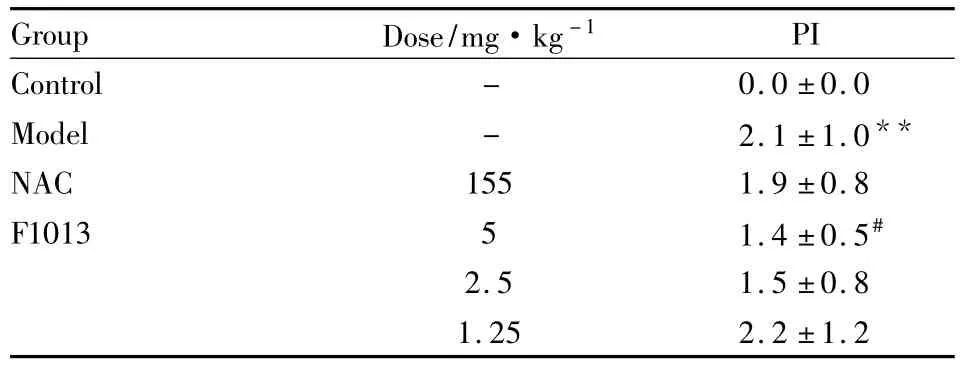
Tab 1 Quantitative evaluation of inflammation of hepatic histology in mice(±s,n=10)
**P<0.01 vs control;#P<0.05 vs model
Group Dose/mg·kg-1PI Control - 0.0 ±0.0 Model - 2.1 ±1.0**NAC 155 1.9 ±0.8 F1013 5 1.4 ±0.5#2.5 1.5 ±0.8 1.25 2.2 ±1.2
2.3 F1013对ConA所致急性肝损伤小鼠血清TNF-α含量的影响 与正常对照组比较,模型组小鼠血清TNF-α水平明显升高(P<0.01);与模型组比较,F1013(5、2.5、1.25 mg·kg-1)组小鼠血清TNF-α水平明显降低,其中 F1013(2.5、1.25 mg·kg-1)组差异具有显著性(P<0.05),如Tab 3。
2.4 流式细胞仪检测小鼠肝组织中细胞凋亡率模型组的肝细胞凋亡率较正常对照组明显升高(P<0.01)。F1013(5、2.5、1.25 mg·kg-1)组和 NAC(155 mg·kg-1)组肝细胞凋亡率较模型组明显降低(P<0.01),呈现良好的剂量依赖性,如Fig 2和Tab 4。

Fig 2 Hepatocellular apoptosis in mice detected by FCM
Tab 2 Effects of F1013 on ALT,AST and T-BIL in serum of mice(±s,n=10)

Tab 2 Effects of F1013 on ALT,AST and T-BIL in serum of mice(±s,n=10)
**P<0.01 vs control;#P<0.05,##P<0.01 vs model
Group Dose/mg·kg-1 ALT/U·L-1 AST/U·L-1 TBil/μmol·L -1 Control 0 47 ±24 121 ±32 2.2 ±0.2 Model 0 6835±4231** 7150±4192** 10.9±4.1**NAC 155 2596 ±1373## 3212 ±1569# 10.6 ±3.7 F1013 5 2138 ±959## 2552 ±1227## 3.4 ±1.4#2.5 2759 ±1951# 3041 ±2095# 7.9 ±2.7 1.25 4968 ±3260 5763 ±3774 9.4 ±3.0
Tab 3 Effects of F1013 on TNF-α in serum of mice(±s,n=10)
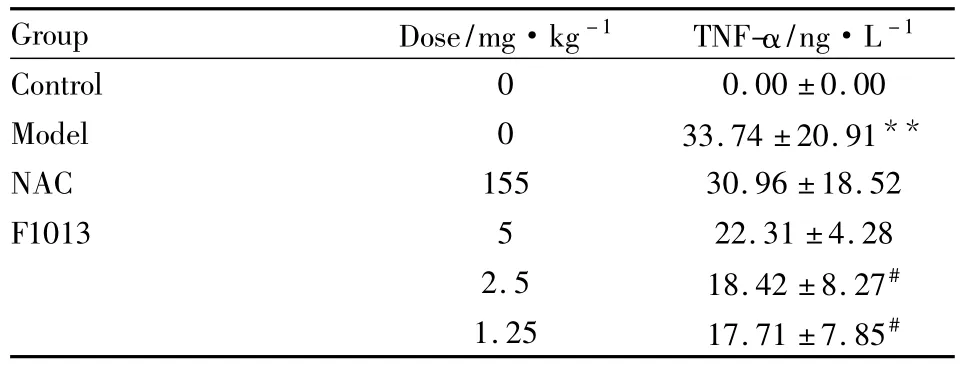
Tab 3 Effects of F1013 on TNF-α in serum of mice(±s,n=10)
**P<0.01 vs control;#P<0.05 vs model
Group Dose/mg·kg-1 TNF-α/ng·L -1 Control 0 0.00 ±0.00 Model 0 33.74 ±20.91**NAC 155 30.96 ±18.52 F1013 5 22.31 ±4.28 2.5 18.42 ±8.27#1.25 17.71 ±7.85#
Tab 4 The result of hepatocellular apoptotic rate in mice detected by FCM(±s,n=10)

Tab 4 The result of hepatocellular apoptotic rate in mice detected by FCM(±s,n=10)
**P<0.01 vs control;##P<0.01 vs model
Group Dose/mg·kg-1Apoptotic rate/%Control 0 1.43 ±0.44 Model 0 12.67 ±1.67**NAC 155 2.28 ±0.33##F1013 5 2.94 ±0.99##2.5 3.15 ±0.76##1.25 3.77 ±0.59##
3 讨论
1992年,Tiegs等[3]成功地应用 ConA 诱发了小鼠急性肝损伤。这一实验模型是近年来新发展起来的由淋巴细胞介导的免疫性肝损伤,很好地模拟了人类病毒性肝炎、自身免疫性肝病等疾病,是筛选急性肝炎和暴发性肝衰竭治疗药物较理想的动物模型。本研究在建立ConA诱导的小鼠急性肝损伤的基础上,造模后2 h给予F1013治疗,可明显减轻肝脏病理损伤;明显抑制ConA引起的肝损伤小鼠血清中ALT、AST和T-Bil水平的升高,说明F1013对ConA诱导的急性肝损伤小鼠具有明显的治疗作用。
TNF-α在ConA诱导的肝损伤中起主要介导作用。急性肝损伤时,血清 TNF-α 含量增高[4-6],其既可通过促进炎症的方式参与肝损伤,又可以通过死亡受体途径激活凋亡程序[7]。TNF-α在通过死亡受体途径激活凋亡程序的过程中,TNF-α先要作为配体与细胞膜上的相应受体结合,将凋亡信号传导入细胞内,激活Caspase,最后导致细胞凋亡的发生。本实验结果显示给予F1013能明显降低模型血清TNF-α水平,提示F1013对TNF-α的抑制作用是保护肝细胞的重要机制。
Con A诱导的肝炎模型中,Fas抗原表达增多[8],肝组织中出现大量的凋亡细胞[9],本实验也发现,Con A可诱导小鼠肝细胞凋亡,给予F1013能明显降低肝细胞凋亡率,其抗肝细胞凋亡作用与F1013广谱抑制Caspase活性有关。
综上所述,F1013对ConA诱导的急性肝损伤小鼠具有较好的治疗作用,其抗急性肝损伤的机制可能与降低血清TNF-α水平和减少肝细胞凋亡有关,为临床治疗急性肝损伤提供新的思路。
[1] 邓利娟,李湛军,罗 楹,等.F1013对Gal N/LPS引起大鼠急性肝损伤的治疗作用[J].中国新药杂志,2011,20(8):716-20.
[1] Deng L J,Li Z J,Luo Y,et al.Therapeutical effect of F1013 on DGal N/LPS-induced acute hepatic injury in rats[J].Chin J New Drugs,2011,20(8):716 -20.
[2] 邓利娟,李湛军,罗 楹,等.Caspase抑制剂F1013对急性肝衰竭大鼠肝细胞凋亡的影响[J].中国临床药理学与治疗学,2010,15(11):1229 -33.
[2] Deng L J,Li Z J,Luo Y,et al.Effect of the caspase selective inhibitor F1013 on hepatocyte apoptosis in rats with fulminant hepatic failure[J].Chin J Clin Pharmacol Ther,2010,15(11):1229 -33.
[3] Tiegs G,Hentschel J,Wendel A.A T-cell dependent experimental liver injury in mice inducible by concanavalin A[J].J Clin Invest,1992,90(1):196 -203.
[4] 谭友文,吴建成.刀豆蛋白A诱导急性肝损伤的模型建立[J].江苏医药,2009,35(6):702 -4.
[4] Tan Y W,Wu J C.Establishment of rats model with actue hepatic injury induced by injection of concanavalin A[J].Jiangsu Med J,2009,35(6):702 -4.
[5] 吕金伟,徐德祥,王 华,等.褪黑素对GalN/LPS引起小鼠急性肝损伤的保护作用[J].中国药理学通报,2007,23(8):1057-8.
[5] Liu J W,Xu D X,Wang H,et al.Melatonin protects against GalN/LPS-induced acute liver injury in mice[J].Chin Pharmacol Bull,2007,23(8):1057 -8.
[6] 李 敏,金晓琨,李卫东.双氢青蒿素保护刀豆蛋白A诱导的小鼠肝损伤及机制探讨[J].中国药理学通报,2009,25(5):630-3.
[6] Li M,Jin X K,Li W D.The protective effect of DQHS on ConA-induced liver injury in mice and its mechanism[J].Chin Pharmacol Bull,2009,25(5):630 -3.
[7] 杨绍杰,孟金萍,屈 袆,等.细胞凋亡信号传导通路的研究进展[J].中国比较医学杂志,2007,17(5):297 -301.
[7] Yang S J,Meng J P,Qu Y,et al.The Progress on the signal transduction pathways of apoptosis[J].Chin J Comp Med,2007,17(5):297-301.
[8] Li M,Liu G T.Inhibition of Fas/FasL mRNA expression and TNF-a release in concanavalin A-induced liver injury in mice by bicyclol[J].World J Gastroenterol,2004,10(12):1775 -9.
[9] 尹洪竹,赵彩彦,刘英辉,等.两种脂肪因子对急性肝损伤小鼠肝细胞凋亡的作用[J].基础医学与临床,2009,29(10):1070-4.
[9] Yin H Z,Zhao C Y,Liu Y H,et al.Role of two kinds of adipokines on hepatocellular apop tosis in mice with acute liver injury[J].Basic & Clin Med,2009,29(10):1070 -4.

