依达拉奉对LPC所致兔胸主动脉内皮功能的影响及机制
邓华菲,何汉江
(湘南学院病理生理学教研室,湖南郴州 423000)
血管内皮细胞不仅是保护血管形态和功能的一层天然屏障,还能分泌一些血管活性物质,如一氧化氮(nitric oxide,NO)、内皮素-1、血管紧张素Ⅱ等。大量研究表明[1-3],NO介导的内皮依赖性血管舒张功能的损伤是许多心血管疾病如动脉粥样硬化、高血压及糖尿病血管并发症的共同病理基础。已知氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)在动脉粥样硬化的发生发展中起重要作用[4]。溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)是ox-LDL的主要成分,也是ox-LDL损伤血管内皮依赖性舒张功能的主要脂质成分[5]。用LPC体外孵育正常血管也能模拟ox-LDL对血管内皮依赖性舒张的损伤作用[6]。因此,阻止LPC对血管内皮的损害是防治动脉粥样硬化的一条有效途径。
依达拉奉(edaravone,Eda)是一种新型的自由基清除剂,主要用于脑缺血的治疗。新近研究表明Eda能对抗异丙肾上腺素对心肌细胞的损伤作用[7]。Takaaki Okabe 等[8]发现 Eda 能抑制载脂蛋白-E缺乏小鼠动脉粥样硬化的发生和发展。徐向辉等[9]研究发现Eda预处理能降低脑缺血/再灌注对大鼠血管内皮功能的损伤。但Eda能否改善LPC诱导的血管内皮损伤尚不清楚。因此,本实验用LPC体外孵育兔胸主动脉环诱导血管内皮损伤,探讨Eda对LPC损伤血管内皮的作用及机制,为Eda用于防治心血管疾病提供实验和理论依据。
1 材料与方法
1.1 药物与试剂 Eda购自南京先声药业有限公司,批号80-091215。溶血磷脂酰胆碱、苯肾上腺素、硝普钠购自Sigma公司。乙酰胆碱(ACh)购自上海三爱思试剂有限公司。丙二醛(malonaldehyde,MDA)、一氧化氮(nitric oxide,NO)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购于南京建成生物工程研究所。BCA蛋白定量试剂盒购自北京百泰克生物技术有限公司。
1.2 实验动物 实验用家兔,体质量1.5~2.2 kg,♀♂各半,每组5只。由湘南学院动物学部提供。
1.3 实验仪器 Pclab-UE生物医学信号采集处理系统(成都泰盟科技有限公司),张力换能器(北京微信斯达科技发展有限责任公司)。低温离心机(美国Beckman公司),荧光分光光度计(日本Hitachi公司),UV755B分光光度计(上海分析仪器总厂)
1.4 离体血管舒张功能检测 将家兔用戊巴比妥钠麻醉(40 mg·kg-1),分离胸主动脉置于 4℃Krebs-Henseleit(K-H)缓冲液(成分:NaCl 118.3,KCl 4.7,CaCl22.5,MgSO41.2,KH2PO41.2,NaHCO325.0,Glucose 11.0 mmol·L-1)中。小心剔除血管周围脂肪和结缔组织,尽量避免损伤血管内皮。截取3~4 mm的血管环悬挂于两个不锈钢挂钩上,一端固定于器官浴槽,另一端连接张力换能器,用Pclab-UE生物医学信号采集处理系统记录血管张力变化。血管环置于盛有5 ml克氏液的器官浴槽中(37℃恒温),并持续充以95%O2和5%CO2的混合气体,加静息张力6 g,每隔15 min更换浴槽中的克氏液1次,平衡90 min。血管环先用60 mmol·L-1KCl使血管环平滑肌去极化,重复2~3次至血管环收缩达坪值;冲洗后重新平衡血管环,再用0.1 μmol·L-1苯肾上腺素预收缩血管,待张力上升并稳定后,加入 0.03 ~3 μmol·L-1累积浓度的乙酰胆碱舒张血管,计算不同浓度ACh诱导的血管舒张值占苯肾上腺素引起的最大收缩值的百分数表示血管环的舒张百分比。最大舒张反应大于80%的血管环被认为内皮完整,可用于实验。
1.5 实验分组 实验分为4大组,即正常对照组:血管环用克氏液平衡45 min;LPC损伤组:用5 mg·L-1的LPC孵育家兔胸主动脉环30 min;Eda+LPC 组:分别用25、50 和100 μmol·L-1的 Eda 预处理胸主动脉环15 min后,加入5 mg·L-1的LPC共同孵育 30 min。Eda 单独处理组:100 μmol·L-1的Eda单独孵育胸主动脉环45 min。血管环经上述处理后,再加入 0.1 μmol·L-1苯肾上腺素预收缩血管并加入累积浓度的ACh再次检测内皮依赖性舒张反应。实验结束前,检测血管环对10 μmol·L-1硝普钠诱导的内皮非依赖性舒张反应,并计算各种浓度ACh和10 μmol·L-1硝普钠诱导血管舒张的百分比。
1.6 血管组织中NO和MDA含量及SOD活性的测定 血管环舒张功能检测完成后,将血管环快速保存于-70℃超低温冰箱中待检测。解冻血管环,用滤纸吸干水份,称重,用小手术剪将其剪碎,加入预冷的生理盐水;在冰浴上用匀浆器制成10%的组织匀浆,4℃离心10 min后,取上清液,按试剂盒说明和相关要求操作,检测血管组织中NO、MDA含量及SOD活性,并用BCA蛋白定量试剂盒检测血管组织中蛋白含量,计算单位蛋白中所含NO、MDA及SOD。
2 结果
2.1 Eda对LPC抑制兔血管内皮依赖性舒张的作用 经上述药物处理后,各组血管环对0.1 μmol·L-1苯肾上腺素均能产生相似的收缩反应(数据未显示),当收缩达坪值后,加入累积浓度的ACh可诱导正常对照组血管环产生内皮依赖性和剂量依赖性的舒张反应;而用5 mg·L-1LPC孵育离体胸主动脉30 min后,明显地降低了ACh诱导的内皮依赖性舒张反应(Fig 1)。但未影响其非内皮依赖性舒张反应(数据未显示)。与正常对照组相比,LPC处理组最大舒张百分比(maximal relaxation rate,Emax)降低而半数有效浓度(half maximum effective concentration,EC50:指引起最大舒张百分比的50%时所需的 ACh 浓度)升高(Tab 1)。用 25 ~100 μmol·L-1的Eda预孵育兔离体胸主动脉环15 min,然后与5 mg·L-1的LPC共同孵育血管环30 min,明显降低LPC对兔胸主动脉环内皮依赖性舒张反应的抑制作用;使血管环对ACh诱导的内皮依赖性舒张增加(Fig 1)。与LPC组比较,Eda处理组血管环的Emax明显增加而EC50则明显降低(Tab 1)。与正常对照组相比,Eda单独处理组没有改变兔胸主动脉环的内皮依赖性和非内皮依赖性舒张反应(数据未显示)。
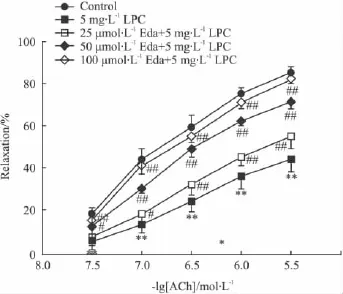
Fig 1 Effect of edaravone(Eda)on the impaired endothelium-dependent relaxation of rabbit aortas induced by LPC(±s,n=5)
2.2 Eda对离体血管组织中NO和MDA含量以及SOD活性的影响 与正常对照组相比,LPC处理组血管组织中MDA含量增加,SOD活性下降,NO释放减少。Eda(25 ~100 μmol·L-1)处理后,MDA含量下降,SOD活性升高,NO释放增多。与正常对照组比较,Eda单独处理组MDA含量、SOD活性、NO的释放无明显改变(Tab 2)。
Tab 1 Effects of LPC and edaravone(Eda)on the Emaxand EC50values for acetylcholine-induced relaxation of rabbit aortic rings(±s,n=5)
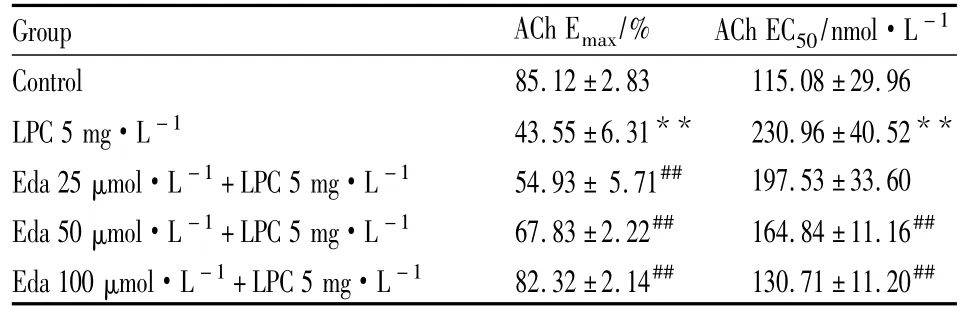
Tab 1 Effects of LPC and edaravone(Eda)on the Emaxand EC50values for acetylcholine-induced relaxation of rabbit aortic rings(±s,n=5)
The maximal relaxation(Emax)response to 3 μmol·L -1acetylcholine(ACh)of rabbit aortic rings is expressed as percentage of contraction elicited by phenylephrine 0.1 μmol·L -1.The half-maximum effective concentration(EC50)response to ACh is calculated by linear regression from log concentration-effect curves of ACh.**P<0.01 vs control group;##P<0.01 vs 5 mg·L-1LPC group
Group ACh Emax/% ACh EC50/nmol·L -1 Control 85.12 ±2.83 115.08 ±29.96 LPC 5 mg·L -1 43.55±6.31** 230.96±40.52**Eda 25 μmol·L -1+LPC 5 mg·L -1 54.93± 5.71## 197.53±33.60 Eda 50 μmol·L -1+LPC 5 mg·L -1 67.83±2.22## 164.84±11.16##Eda 100 μmol·L -1+LPC 5 mg·L -1 82.32±2.14## 130.71±11.20##
Tab 2 Effects of LPC and edaravone(Eda)on the content of NO and MDA and the activity of SOD in isolated vascular tissues(±s,n=5)
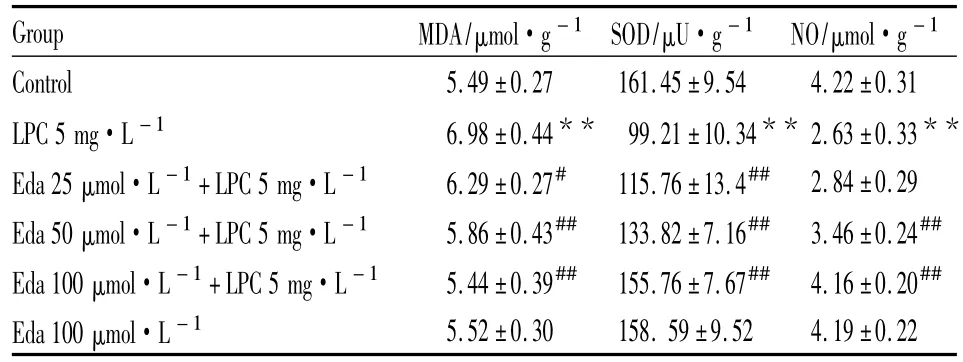
Tab 2 Effects of LPC and edaravone(Eda)on the content of NO and MDA and the activity of SOD in isolated vascular tissues(±s,n=5)
**P<0.01 vs control group;#P<0.05,##P<0.01 vs 5 mg·L-1LPC group
Group MDA/μmol·g-1 SOD/μU·g-1 NO/μmol·g -1 Control 5.49±0.27 161.45±9.54 4.22±0.31 LPC 5 mg·L-1 6.98±0.44** 99.21±10.34** 2.63±0.33**Eda 25 μmol·L -1+LPC 5 mg·L -1 6.29±0.27# 115.76±13.4## 2.84±0.29 Eda 50 μmol·L -1+LPC 5 mg·L -1 5.86±0.43## 133.82±7.16## 3.46±0.24##Eda 100 μmol·L -1+LPC 5 mg·L -1 5.44±0.39## 155.76±7.67## 4.16±0.20##Eda 100 μmol·L - 15.52±0.30 158.59±9.52 4.19±0.22
3 讨论
NO介导的内皮依赖性血管舒张功能降低是动脉粥样硬化的特征性病变。大量动物实验和临床研究表明,ox-LDL是动脉粥样硬化的独立危险因子,而LPC是ox-LDL产生氧自由基和致血管内皮损伤的主要成分[4-5]。在本实验中我们用 5 mg·L-1LPC孵育家兔离体胸主动脉环,观察血管环的内皮依赖性舒张反应、血管组织中NO含量及血管组织中的脂质过氧化代谢产物MDA和氧自由基清除剂SOD的活性。结果显示,LPC降低了血管内皮依赖性舒张反应,但没有影响非内皮依赖性血管舒张反应。这和我们以前在大鼠离体胸主动脉环[6]、以及其他学者在新西兰兔胸主动脉[10]和猪冠状动脉[11]的研究结果相似。LPC降低血管内皮依赖性舒张功能的机制尚不完全清楚。大量研究表明,LPC可以激活蛋白激酶C,促进超氧阴离子的产生[11],后者使NO氧化灭活增加。此外,LPC还能降低内皮细胞一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)mRNA的表达,减少NO合成[5]。本实验研究发现LPC孵育的血管组织中MDA含量升高而NO水平和SOD活性下降。这些结果表明,增加NO灭活和减少NO合成,从而降低NO的生物利用度是LPC导致血管内皮依赖性舒张功能降低的主要原因。
Eda的化学名为3-甲基-1-苯基-2-吡唑啉-5-酮,是一种具有捕获羟自由基活性的自由基清除剂,表现为抗氧化的细胞保护效应,因而最先用于防治脑缺血/再灌注中的氧化损伤,减轻脑水肿,抑制迟发性神经细胞死亡,具有较明显的神经保护功能。现在越来越多的证据表明氧自由基在动脉粥样硬化发生发展中具有十分重要的作用,这为氧自由基清除剂Eda防治动脉粥样硬化提供了理论依据。本实验发现Eda孵育家兔离体胸主动脉可明显改善LPC诱导的血管内皮依赖性舒张功能的损害,降低了血管组织中MDA的水平和增加了NO含量以及SOD的活性。徐向辉等[9]研究发现Eda预处理明显改善大鼠脑缺血/再灌注后血管内皮功能,其机制与降低MDA和增加SOD活性有关,周红杰等[12]报道,Eda降低脑出血大鼠脑组织MDA含量并增加SOD活性;Yoshida等[13]研究发现Eda能逆转ox-LDL对eNOS的抑制效应;Jitsuiki等[14]给吸烟者注射依达拉奉后,其前臂血管对ACh的舒张反应增加,应用eNOS抑制剂——N-甲基-L-精氨酸取消了Eda的作用。这些研究表明,Eda具有清除氧自由基及促进内皮细胞NO合成的作用,该作用可能与其对抗LPC所致的血管内皮功能损害有关。
综上所述,Eda改善了LPC对血管内皮依赖性舒张功能的损伤,其机制可能与其清除LPC产生的氧自由基,增加NO的生物利用度等抗氧化特性有关。
[1] 李 磊,戴 敏.动脉粥样硬化血管内皮分泌功能失调与平滑肌细胞增殖[J].中国药理学通报,2010,26(2):155 -8.
[1] Li L,Dai M.The cause of atherosclerosis secretory dysfunction in vascular endothelial cells and proliferation of smooth muscle cells[J].Chin Pharmacol Bull,2010,26(2):155 -8.
[2] 王现珍,蒋嘉烨,陆家凤,等.SHR高血压进程中不同类型血管内皮功能损伤及药物修复研究[J].中国药理学通报,2010,26(2):163-8.
[2] Wang X Z,Jiang J Y,Lu J F,et al.Study in the damage of endothelial function and administration recovery among different arteries during the developing progress of SHR[J].Chin Pharmacol Bull,2010,26(2):163 -8.
[3] Tziomalos K,Athyros V G,Karagiannis A,Mikhailidis D P.Endothelial dysfunction in metabolic syndrome:Prevalence,pathogene-sis and management[J].Nutr Metab Cardiovasc Dis,2010,20(2):140-6.
[4] Mitra S,Deshmukh A,Sachdeva R,et al.Oxidized low-density lipoprotein and atherosclerosis implications in antioxidant therapy[J].Am J Med Sci,2011,342(2):135 - 42.
[5] Min Z,Kang L,Lin L,et al.Resveratrol restores lysophosphatidylcholine-inhibition of extracellular-signal-regulated protein kinase activation[J].Phytother Res,2010,24(12):1762 - 8.
[6] Deng H F,Xiong Y.Effect of pravastatin on impaired endotheliumdependent relaxation induced by lysophosphatidylcholine in rat aorta[J].Acta Pharmacol Sin,2005,26(2):92 - 8.
[7] 黄 涌,阮经文,杨春涛,等.依达拉奉保护H9c2心肌细胞对抗异丙肾上腺素诱导的氧化应激及内质网应激反应[J].中国药理学通报,2011,27(3):410 -5.
[7] Huang Y,Ruan J W,Yang C T,et al.Myocardial protection of edaravone against isoprenaline-induced oxidative stress and endoplasmic reticulum stress in H9c2 cells[J].Chin Pharmacol Bull,2011,27(3):410 -5.
[8] Okabe T A,Kishimoto C,Shimada K,et al.Effects of MCI-186(edaravone),a novel free radical scavenger,upon experimental atherosclerosis in apolipoprotein E-deficient mice[J].Circ J,2006,70(9):1216 -9.
[9] 徐向辉,常业恬,李 李,等.依达拉奉预处理对大鼠脑缺血再灌注后血管内皮功能的影响[J].实用医学杂志,2008,24(24):4205-7.
[9] Xu X H,Chang Y T,Li L,et al.Effects of edaravone preprocession on vascular endotheloial function of brain in rats after ischemic reperfusion injury[J].J Practic Med,2008,24(24):4205 -7.
[10] Mangin EL Jr,Kugiyama K,Nguy J H,et al.Effects of lysolipids and oxidatively modified low density lipoprotein on relaxation of rabbit aorta[J].Circ Res,1993,72(1):161 -6.
[11] Murohara T,Kugiyama K,Ota Y,et al.Effects of atrial and brain natriuretic peptides on lysophosphatidylcholine-mediated endothelial dysfunction[J].J Cardiovasc Pharmacol,1999,34:870 -8.
[12]周红杰,朱 洁,王景周,蒋晓江.依达拉奉对脑出血大鼠脑组织丙二醛含量、超氧化物歧化酶活力及脑水含量的影响[J].临床神经病学杂志,2008,21(5):365 -7.
[12] Zhou H J,Zhu J,Wang J Z,Jiang X J.Effects of edaravone on levels of malonaldehyde,superoxide dismutase and water content of cerebral tissue in intracerebral hemorrhage rats[J].J Clin Neurol,2008,21(5):365 -7.
[13] Yoshida H,Sasaki K,Namiki Y,et al.Edaravone,a novel radical scavenger,inhibits oxidative modification of low-density lipoprotein(LDL)and reverses oxidized LDL-mediated reduction in the expression of endothelial nitric oxide synthase[J].Atherosclerosis,2005,179(1):97 -102.
[14] Jitsuiki D,Higashi Y,Goto C,et al.Effect of edaravone,a novel free radical scavenger,on endothelium-dependent vasodilation in smokers[J].Am J Cardiol,2004,94(8):1070 -3.

