显色底物大豆磷脂酰肌醇的分离纯化与检测方法研究进展
吴清平,李 琳,2,3,张菊梅,郭伟鹏
(1.广东省微生物研究所 广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室广东省华南应用微生物重点实验室-省部共建国家重点实验室培育基地,广东 广州 510070;2.中国科学院广州化学研究所,广东 广州 510301;3.中国科学院研究生院,北京 100049)
随着人们对食品安全问题的日益关注,简便、快速、高效的检测手段已成为目前微生物食品安全检测的研究热点。磷脂酰肌醇(Phosphtidylinositol,PI)作为常见食源性致病菌中的单核细胞增生性李斯特菌(Listeriamonocytogenes,LM)特异性显色培养基底物,可与LM中特有的磷脂酰肌醇特异性磷脂酶C(Phosphatidylinositol phospholipase C,PI-PLC)发生特异性反应[1],在LM显色培养基上形成不透明的白色晕圈,从而达到特异性检测LM的目的。显色培养基技术解决了传统检测手段耗时长、特异性低、操作繁琐等缺陷,具有可观的应用价值。
由于大豆中含有丰富的PI,且原料易得、成本低廉,因此,分离纯化大豆磷脂酰肌醇对于其生物机理研究及其微生物安全检测意义重大。鉴于此,作者综述了大豆磷脂酰肌醇的分离纯化与检测方法研究进展,并介绍了其在LM显色培养基方面的重要应用。
1 PI的结构及性质
1.1 结构
PI是一种甘油磷脂,具有甘油磷脂的通性,不同生物体内的PI因甘油所连接脂肪酸链的不同而具有不同的结构。PI分子含有甘油、磷酸、脂肪酸及肌醇,其结构式如图1所示。
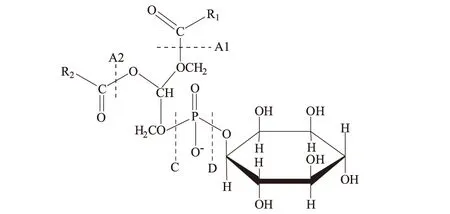
虚线A1、A2、C、D分别为磷脂酶A1、A2、C、D的酶解部位
其中R1、R2为脂肪酸,常见的有软脂酸、硬脂酸、亚油酸、亚麻酸、油酸、花生四烯酸等,α位(R1CO-)的脂肪酸一般是饱和脂肪酸,而β位(R2CO-)的脂肪酸常为不饱和脂肪酸[2]。
PI所含的肌醇都是myo-肌醇,myo-肌醇是肌醇的一种异构体,是由6个碳原子组成的环己六醇,C1,2,3,5上连接的羟基位于肌醇分子平面的一方,C4,6上连接的羟基位于另一方;C5和C2是对称碳原子[3],而C1和C3、C2和C6分别具有手性关系[4],游离状态的肌醇分子为内消旋分子。在PI分子中,被磷酸取代而衍生出的具有旋光性的手性分子,除生物体内C1位取代的L-myo-肌醇-l-磷酸是L型外,其余都是D型分子。
1.2 理化性质
PI的纯净物为白色蜡状固体,其中含有的不饱和脂肪酸在空气中易被氧化而变成黄褐色或黑色。PI通常以钠盐的形式存在,为白色晶体,且易潮解和氧化。PI的熔点约为60 ℃,不耐高温,100 ℃以上会发生氧化分解反应[5],280 ℃时会生成黑色的沉淀。PI可以与碘酸发生氧化反应而生成醛类。PI与Schiff试剂反应生成紫红色化合物,可作为区别于其它磷脂的特性反应。
PI易溶于氯仿、正己烷、乙醚、甲苯,微溶于甲醇、石油醚,不溶于丙酮、乙醇。PI在弱碱性溶液中的溶解度较大。由于磷脂类分子既含有亲水性的磷酸酯基,又含有疏水性的脂肪烃基,因此,可作为两性表面活性剂包裹在油滴的表面,大幅降低油水间的界面张力,从而形成均匀稳定的乳化液。
从结构上看,PI具有脂肪酸、酯键、烷基以及肌醇上的取代基,可发生特异性化学反应,如水解反应、加成反应、氧化反应、乙酰化反应、羟基化反应、硫酸化反应及络合反应等[6]。
2 PI的分离纯化方法
大豆磷脂中的主要成分为PI、磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE),通常利用它们之间极性的差异进行分离。目前常用的分离方法主要有柱层析法、溶剂萃取法、酶法等。
2.1 柱层析法
用于分离PI的柱层析法主要有硅胶柱层析、离子交换柱层析以及氧化铝柱层析等,常用的溶剂主要有氯仿和低级醇等溶剂混合物。采用梯度洗脱的方法可以提高PI纯度,也可采用低压制备色谱柱在等度洗脱条件下分离,得到纯度高达90%以上的PI。
宋华等[7]采用100 mm×26 mm色谱柱,以氯仿-甲醇(2∶1,体积比,下同)为流动相,在流速为3.0 mL·min-1的条件下分离,PI纯度达到90%以上、PE纯度80%以上、PC纯度95%以上。姜波等[8]以氯仿-甲醇(1.8∶1)为流动相,在上样量为1.0 g·(100 g)-1的条件下得到的PI纯度可达91.5%。
将混合磷脂溶解在CHCl3-CH3OH(1∶1)中,经Al2O3柱层析洗脱,得到含有PC、糖脂以及溶血磷脂的混合液,继续用CHCl3-1% CH3OH-COONH4(1∶1∶0.3)溶液洗提,再用硅胶柱层析分离,可得到高纯度的PI。另外,先加入洗脱液CHCl3得到中性脂质,再加入CHCl3-CH3OH(4∶1)洗脱糖脂和部分PE,最后加入CHCl3-CH3OH-25%NH3(80∶20∶5或65∶25∶5)洗提PI,蒸发干燥,PI纯度达98%~99%[9]。
2.2 溶剂萃取法
溶剂萃取法是根据所分离组分在不同有机溶剂中溶解性的差异来进行分离的。常用的溶剂有甲醇、丙酮、正己烷、异丙醇、三氯甲烷及其混合溶剂等。溶剂萃取法技术成熟、操作简便、溶剂能回收利用、容易放大且能连续化生产,是传统的分离PI的方法之一。
陈志强等[10]采用乙醇和正己烷萃取大豆PI,效果较佳。吴平等[11]进一步对分离条件进行了优化,PI的纯度从26%提高到73.89%。
溶剂萃取法结合柱层析法可以显著提高PI的产率。柳叶[12]在溶剂萃取法分离PI的基础上,将醇溶液用Al2O3处理,以甲醇-氨水(20∶1)为洗脱剂,PE的洗脱率达到32.3%。刘代成等[13]首先用碱性乙醇抽提去除混合大豆磷脂中的PE和PC;将得到的粗品溶于非极性溶剂中,加入含碱性物质的极性溶剂,调pH值至8.0~10.0;液液萃取后,再加入金属盐纯化,PI纯度可达87.8%。
将溶剂萃取法与一些化学反应相结合可得更高纯度的PI。如将混合磷脂溶在有机溶剂(如无水吡啶、乙腈、DMF、DMSO)中,加入氯化三甲基硅、氯化二甲基叔丁基硅或烯丙基溴保护羟基,再用丙酮或乙醇将产物从反应体系中萃取出来,加入酸性物质水解,去除保护基团,恢复羟基,PI纯度可达98%以上。
2.3 酶法
目前发现的主要有4种磷脂酶,即磷脂酶A1、A2、C和D,它们可以水解不同的酯键(见图1)。
磷脂酶D作用于混合磷脂中,可以水解去除含氨基团,在特定条件下,能催化各种含羟基底物结合到磷脂的碱基上,从而形成新的磷脂,这一特性称为磷脂酶D的磷脂转移特性[14](Transphosphatidylation)或碱基交换反应(Base exchange reaction)。Nakazato在磷脂酶D存在下得到纯度为70%的PI[15];McGuigan[16]在醇和肌醇存在下制备PI;Juneja等[17]在L-或D-丝氨酸存在下,将PC转化为磷脂酰丝氨酸(Phosphatidylserine,PS),转化率分别为98.5%和100%。
由于磷脂酶D不会水解PI,而是选择性地水解其它的磷脂成分(如PC和PE),因此,将乙醇处理后的混合磷脂(含少量的PC)用磷脂酶D处理,然后用碱性或酸性磷脂酶处理,PI的纯度可达60%~70%[18]。
3 PI的检测方法
3.1 高效液相色谱法
高效液相色谱法分离混合磷脂常用的固定相为硅胶;常用的流动相为乙腈-甲醇-水体系和正己烷-异丙醇-水体系[19,20];检测器一般采用紫外检测,在205 nm处有较强吸收。
大豆磷脂中主要组分PC、PE以及PI的测定可依照国家标准GB/T 21493-2008进行。采用Si-60色谱柱(250 mm×2.6 mm),填充物粒度5 μm,以正己烷-异丙醇-1%冰醋酸(8∶8∶1)为流动相,流速1 mL·min-1,柱温30 ℃,采用梯度洗脱可达到更好的分离效果。
3.2 薄层层析法
郭勃等[21]采用10 cm×10 cm、10 cm×20 cm薄层展开板,采用双向展开剂[展开剂A:氯仿-甲醇-冰醋酸-丙酮-水(35∶25∶4∶14∶2),展开剂B:正己烷-乙醚(4∶1)],用磷钼酸乙醇溶液(5%~10%)或Dittmer试剂显色对PI进行检测。
商宗一等[22]将溶有PI的有机提取液通过2根阴阳离子交换树脂分离柱后,再用氯仿-甲醇洗脱来分离PI。
3.3 其它检测方法
利用超临界色谱(SFC)[23]对PI进行分离。采用Spherisorb C18色谱柱(250 mm×4.6 mm,不锈钢柱),流动相为CO2改性剂(10∶1),流速1.1~1.3 mL·min-1,柱温30~60 ℃,压力20 MPa,检测波长214 nm,用外标峰面积定量法测定PI含量[24],不仅分离效率高,且环保无污染,是一种理想的分离手段,但由于成本及技术要求高尚未得到广泛应用。
20世纪90年代后发展成熟的磷原子核磁共振效应可用于分析各磷脂组分的含量,Thomas用30 mL甲醇-氯仿溶解,再用0.2 mol EDTA沉淀金属离子,在202.4 MHz下用核磁共振分析了富集PI的磷脂组分,PI的31PNMR的化学位移为-0.37 ppm[25]。
4 PI在LM显色培养基方面的应用
近年来显色培养基方法[26]相对于传统检测方法省时省力且准确度高、操作简便,得到了普遍认可和越来越广泛的应用。
目前应用最广泛的CHROMagar Listeria显色培养基、ALOA培养基以及OCLA培养基[27]等都是以PI和5-溴-4-氯-3-吲哚吡喃糖苷为底物进行检测的。而国内对PI作为底物的研究及应用鲜有报道。
作者所在研究团队近年来对常见食源性致病菌显色培养基进行了深入研究,已成功研制出一系列特异性显色培养基并已经得到商品化应用。为了进一步提高显色培养基的检测效果并降低底物成本,进行了显色底物的自主合成研究,其中结合溶剂萃取和柱层析分离的PI纯度达97%以上,与进口PI产品的显色效果无明显差异。目前,正开发特异性更高的底物以及使用多种复合底物,以进一步提高包括LM在内的特异性底物显色培养基的检测特异性和灵敏度。
5 结语
由于大豆磷脂中含有性质相似的多种磷脂类物质,包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)等,且市售的混合磷脂中PI的含量一般只有10%左右,不能直接应用到显色培养基中;同时大豆磷脂原料中的几种组成成分都具有磷脂类化合物的通性且结构具有相似部分,因此,采用常规方法难以得到纯度较高的单一磷脂;另外,磷脂类化合物PI含有的肌醇结构以及不饱和脂肪键等使其具有容易氧化、不耐高温等缺点,在分离制备过程中容易变性,从而更增加了分离难度。
溶剂法具有操作简便、便于工业化的优点,但是溶剂消耗量大、生产成本高;柱层析法分离效率高,但负载量小、可重复性差;高效液相色谱法虽可制备少量PI纯品,但成本较高、操作复杂、产量很少,还停留在实验室少量分析阶段。因此寻找可行的高效分离手段成为目前亟待解决的问题。
国内LM显色底物制备方面的研究相对落后,直接制约了其在LM检测显色培养基方面的应用。随着研究的深入,将两种以上的分离方法相结合来提高分离纯度及酶解法制备PI均具有一定的发展潜力。随着PI需求的增加,开发简便可行的高纯度制备工艺将成为未来研究的发展方向。
[1] Aurora R,Prakash A,Prakash S,et al.Comparison of PI-PLC bas-ed assays and PCR along withinvivopathogenicity tests for rapid detection of pathogenicListeriamonocytogenes[J].Food Control,2008,19(7):641-647.
[2] Gerelli Y,Di Bari M T,Deriu A,et al.Structure and organization of phospholipid/polysaccharide nanoparticles[J].Journal of Physics:Condensed Matter,2008,20(10):104-211.
[3] de Meyer F,Smit B.Effect of cholesterol on the structure of a phospholipid bilayer[J].PNAS,2009,106(10):3654-3658.
[4] Anderson R J,Groundwater P W,Huang Y,et al.Synthesis and evaluation of novel chromogenic peptidase substrates based on 9-(4′-aminophenyl)-10-methylacridinium salts as diagnostic tools in clinical bacteriology[J].Bioorganic & Medicinal Chemistry Letters,2008,18(2):832-835.
[6] Liu Y C,Mihai C,Kubiak R J,et al.Phosphorothiolate analogues of phosphatidylinositols as assay substrates for phospholipase C[J].ChemBioChem,2007,8(12):1430-1439.
[7] 宋华,陈福明.柱层析法分离大豆磷脂[J].中国油脂,2005,30(2):41-43.
[8] 姜波,胡志雄,张维农,等.柱色谱法制备高纯大豆肌醇磷脂研究[J].粮油加工,2009,(7):77-80.
[9] 邓启刚,齐乐,安红.大豆肌醇磷脂的分离技术研究[J].化学工程师,2003,(6):14-16.
[10] 陈志强,安红,何锡凤.溶剂法分离制备大豆肌醇磷脂[J].齐齐哈尔大学学报,2005,21(2):1-4.
[11] 吴平,安红,何锡凤,等.大豆肌醇磷脂制备优化条件的研究[J].中国油脂,2006,31(6):87-89.
[12] 柳叶.氧化铝柱层析分离纯化磷脂的工艺优化[D].杭州:浙江大学,2006.
[13] 刘代成,安立国,陶务端,等.高纯度磷脂酰肌醇的制备方法[P].CN 1 560 057,2005-01-05.
[14] Shashidhar M S,Volwerk J J,Griffith O H,et al.A chromogenic substrate for phosphatidylinositol-specific phospholipase C:4-Nitrophenyl myo-inositol-1-phosphate[J].Chemistry and Physics of Lipids,1991,60(2):101-110.
[15] Row K H,Kang D H.Normal-phase high-performance liquid ch-romatography of phospholipids from soybean with evaporative light scattering detection[J].American Biotechnology Laboartory,2003,21(9):40-42.
[16] McGuigan C.A new and rapid synthesis of phospholipids[J].J Chem Soc Chem Commun,1986,(7):533-534.
[17] Juneja L R,Kazuoka T,Goto N,et al.Studies on the enzymic conversion of phospholipids(Ⅵ).Conversion of phosphatidylcholine to phosphatidylserine by various phospholipase D in the presence of L- or D-serine[J].Biochem Biophys Acta(BBA)-Lipids and Lipid Metabolism,1989,1003(3):277-283.
[18] Van der Meeren P,Vanderdeelen J,Huys M,et al.Simple and ra-pid method for high-performance liquid chromatographic separation and quantification of soybean phospholipids[J].J Chromatogr A,1988,447(2):436-442.
[19] Olsson P,Holmbäck J,Herslöf B.Separation of lipid classes by HPLC on a cyanopropyl column[J].Lipids,2012,47(1):93-99.
[20] Chen C B,Yang L Q,Zhou J.Trace bensulfuron-methyl analysis in tap water,soil,and soybean samples by a combination of molecularly imprinted stir bar sorption extraction and HPLC-UV[J].Journal of Applied Polymer Science,2011,122(2):1198-1205.
[21] 郭勃,徐桂云,常理文.大豆磷脂组成的薄层色谱分析[J].分析化学,1998,26(1):81-84.
[22] 商宗一,张金红.树脂法分离纯化植物磷脂酰肌醇的新工艺[P].CN 86 101 623,1987-09-23.
[23] 阳东升,陈良才,刘根凡,等.用超临界二氧化碳萃取技术制备蛋黄卵磷脂的几种工艺探讨[J].现代化工,2003,23(10):46-53.
[24] Wadud S,Leon-Velarde C G,Larson N,et al.Evaluation of immunomagnetic separation in combination with ALOAListeriachromogenic agar for the isolation and identification ofListeriamonocytogenesin ready-to-eat foods[J].Journal of Microbiological Methods,2010,81(2):153-159.
[25] 王学军,赵锁奇,王仁安.超临界流体色谱法分析大豆磷脂[J].色谱,2001,19(4):344-346.
[26] Aragonalegro L,Aragon D,Martinez E,et al.Performance of a chromogenic medium for the isolation ofListeriamonocytogenesin food[J].Food Control,2008,19(5):483-486.
[27] Becker B,Schuler S,Lohneis M,et al.Comparison of two chromogenic media for the detection ofListeriamonocytogeneswith the plating media recommended by EN/DIN 11290-1[J].International Journal of Food Microbiology,2006,109(1-2):127-131.

