健脾祛瘀法对血脂异常小鼠视网膜色素上皮-玻璃膜-脉络膜毛细血管复合体的影响
谢礼丹 曾庆华 莫 亚 唐春艳 刘小虎
年龄相关性黄斑变性(age-related macular degeneration,AMD)是一种与年龄相关的变性类疾病,以视网膜色素上皮层及脉络膜的玻璃膜疣沉积(干性AMD),继而引发病理性脉络膜新生血管(choroidal neovascularization,CNV)(湿性 AMD)为临床特征,可导致严重的中心视力损害〔1〕。该病的发病机制仍不十分清楚,与多种因素有关,比如动脉粥样硬化,尽管二者之间的关系并不很清晰,但有研究认为这些多因素的复杂疾病可能有共同的通路,推测高血脂与AMD的发生有一定的联系。我们的前期实验证明,血脂异常可使载脂蛋白E缺乏(apolipoprotein E-deficient,ApoE-/-)小鼠的视网膜光感受器细胞、视网膜色素上皮(retinal pigment epithelium,RPE)细胞及玻璃膜(Bruch’s membrane,BM)发生类似于早期年龄相关性黄斑变性的病理改变〔2〕(像动脉粥样硬化病变一样,BM脂质的来源并不是完全来自血液〔3-5〕)。 血管内皮生长因子(vascularendothelialgrowth factor,VEGF)是在AMD进展过程具有重要作用的物质〔6〕,可通过刺激其 R2 受体(vascular endothelial growth factor receptor 2,VEGFR2)介导血管内皮细胞DNA合成和增殖,VEGFR2还参与由VEGF介导的血管通透性改变〔7-9〕。本课题拟观察健脾祛瘀中药对实验性血脂异常小鼠的视网膜色素上皮-玻璃膜-脉络膜毛细血管复合体(retinal pigment epithelium-Bruch’s membrane-choriocapillaris complex,RBCC)结构及VEGF、VEGFR2表达的影响,以探讨中医药防治CNV的作用机理。
1 材料与方法
1.1 实验动物
8周龄ApoE-/-雄性小鼠,体质量25.9~34.5 g,由北京大学实验动物学中心提供(美国Jackson实验室引进),动物合格证:川实动管质第09号。普通饲料及高脂饲料由成都达硕动物实验有限公司提供,于四川省人民医院清洁实验室中采用独立通风笼盒(independent ventilation cage,IVC)饲养。 所有实验根据赫尔辛基宣言保护和运用动物的指导原则来进行。
1.2 造模与分组
8周龄小鼠予高脂饲料喂养至6月龄后,查总胆固醇(total cholesterol, TC)>6.5 mmol/L 及三酰甘油(triacylglycerol,TAG)>1.86 mmol/L 者为血脂异常模型造模成功,改予普通饲料饲养。将模型小鼠随机分为低、中、高浓度给药组及阴性对照组,每组12只。另设普食组小鼠12只,始终予普通饲料喂养至7月龄。
1.3 给药方法
健脾祛瘀中药主要由生蒲黄、丹参、牡丹皮、郁金、川芎等组成(四川绿色药业科技发展股份有限公司)。按照动物与人的折算系数换算用药剂量(成人体质量按60 kg计算),并以中剂量作为等效剂量,低、中、高剂量按照 1∶3∶9的比例计算,分别配制成0.06 g/ml、0.18 g/ml、0.54 g/ml的混悬液,按 1 ml/100 g灌胃给药,每日2次;阴性对照组予等体积的生理盐水灌胃,各组小鼠用药1个月后处死。
1.4 观测指标及测试方法
1.4.1 一般状态观察:观察小鼠食欲、神态、反应能力、被毛、肌肉情况,每周进行小鼠体质量检查。
1.4.2 小鼠血液生化检测方法:禁食12 h后,在动物宰杀前注射镇静剂戊巴比妥钠后股静脉采血,采用日立7170全自动生化分析TC和TAG;R-80A血液黏度仪检测全血黏度、红细胞压积。
1.4.3 组织形态学观察:(1)光镜观察方法:处死动物后沿眼球颞侧角巩膜缘处剪开眼眶,摘除眼球,每组10只,共50只,保留约2~3 mm长度的视神经组织,放入4%多聚甲醛(PBS溶解)固定,常规乙醇脱水,石蜡包埋,于后极部视神经周围切片,制成4~5μm组织切片,常规脱蜡脱水行Masson三色染色。奥林巴斯BX50彩色数码摄像头连续摄取切片彩色图像,每个标本随机选择10幅图像,采用Mias-2000型图像分析系统进行分析,测量RPE厚度、Bruch’s膜厚度。每一标本均为100次测量(每幅图像10次)的平均值。(2)电镜观察方法:摘除眼球方法同前,经30 ml/L戊二醛预固定,10 g/L四氧化锇再固定,丙酮逐级脱水,Epon812包埋,半薄切片光学定位,超薄切片,醋酸铀及枸酸铅染色,日本H-600IV型透射电镜观察。
1.4.4 RBCC中VEGF、VEGFR2表达的检测:采用免疫组化方法。每组取10只左眼(与Masson三色染色为同一只眼球),于眼球后极部切成7μm厚的组织切片,涂上多聚-L-赖氨酸,经脱蜡和100%乙醇处理后,用3%过氧化氢液浸泡切片20 min去除内源性过氧化物酶活性,然后用70%乙醇再水合和PBS液清洗。标本经正常兔血清处理30 min以阻滞黏附的非特定抗体,再用鼠抗人VEGF及VEGFR2单克隆抗体在4℃温度下孵育12 h。每张切片在视网膜后极部连续取5个视野,在奥林巴斯BX50光学显微镜200倍下观察,运用Mias-2000型图形图像分析系统,测量RBCC层VEGF及VEGFR2的阳性表达总面积及积分光密度。
1.5 统计学分析
2 结果
2.1 一般情况
阴性对照组:进食减少,体胖懒动,被毛枯槁,无光泽,白毛丛生,肌肉松弛。药物治疗组:被毛渐生光泽,较治疗前活泼好动,且体质量明显低于阴性对照组(P<0.05)(表 1)。
2.2 血脂及血液流变学
表1 载脂蛋白E缺乏小鼠治疗后与其他各组的体质量比较()

表1 载脂蛋白E缺乏小鼠治疗后与其他各组的体质量比较()
注:与阴性对照组比较,①P<0.05;与普食组比较,②P<0.05(单因素方差分析,LSD法)
组别 样本量 体质量/g低浓度给药组 12 31.96±1.16①中浓度给药组 12 31.57±1.51①高浓度给药组 12 31.726±1.27①阴性对照组 12 34.27±1.16②普食组 12 32.18±1.59
2.2.1 血脂:普食组及各药物治疗组的TC、TAG浓度均明显低于阴性对照组(P<0.05)(表 2)。
表2 载脂蛋白E缺乏小鼠治疗后与其他各组的血脂浓度比较(,mmol/L)
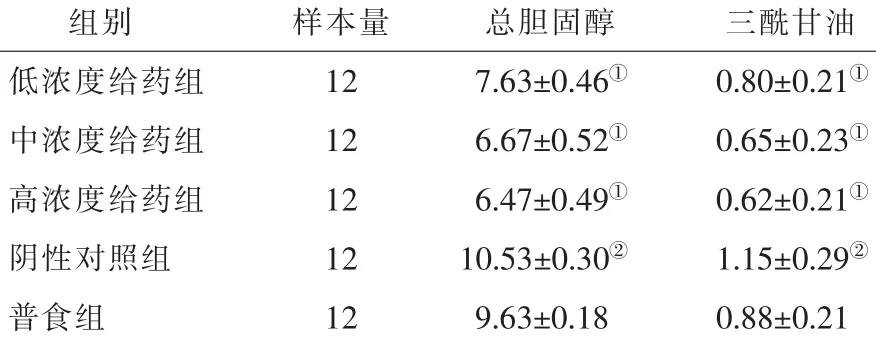
表2 载脂蛋白E缺乏小鼠治疗后与其他各组的血脂浓度比较(,mmol/L)
注:与阴性对照组比较,①P<0.05;与普食组比较,②P<0.05(单因素方差分析,LSD法)
组别 样本量 总胆固醇 三酰甘油低浓度给药组 12 7.63±0.46① 0.80±0.21①中浓度给药组 12 6.67±0.52① 0.65±0.23①高浓度给药组 12 6.47±0.49① 0.62±0.21①阴性对照组 12 10.53±0.30② 1.15±0.29②普食组 12 9.63±0.18 0.88±0.21
2.2.2 血液流变学:阴性对照组的血浆黏度、红细胞压积、全血低切黏度、全血高切黏度明显高于普食组(P<0.05);中浓度给药组血浆黏度明显低于阴性对照组(P<0.05),中浓度给药组、高浓度给药组红细胞压积、全血低切黏度、全血高切黏度明显低于阴性对照组(P<0.05)(表 3)。
表3 载脂蛋白E缺乏小鼠治疗后与其他各组的血液流变学指标比较()

表3 载脂蛋白E缺乏小鼠治疗后与其他各组的血液流变学指标比较()
注:与阴性对照组比较,①P<0.05;与普食组比较,②P<0.05(单因素方差分析,LSD法)
组别 样本量 血浆黏度/mPa·s 红细胞压积 全血低切黏度/mPa·s 全血高切黏度/mPa·s低浓度给药组 12 1.81±0.10 54.17±3.71 33.27±3.07 33.27±3.07中浓度给药组 12 1.72±0.08① 52.17±2.86① 29.05±2.75① 5.06±0.24①高浓度给药组 12 1.74±0.11 52.00±3.41① 30.08±3.98① 5.13±0.19①阴性对照组 12 1.85±0.11② 56.17±3.06② 34.61±3.66② 5.64±0.24②普食组 12 1.74±0.13 51.83±3.19 26.76±3.86 5.18±0.30
2.3 光学显微镜镜观察
RPE厚度:阴性对照组明显低于普食组(P<0.05),药物治疗组略高于阴性对照组,但差异无统计学意义(P>0.05)。 Bruch’s膜厚度:阴性对照组明显高于治疗组及普食组(P<0.05)(表 4,图 1)。
2.4 RBCC中VEGF、VEGFR2的表达
普食组及各药物治疗组VEGF、VEGFR2的阳性表达总面积和积分光密度均明显低于阴性对照组(P<0.05);中浓度给药组的 VEGF、VEGFR2 表达明显低于低、 高浓度给药组 (P<0.05)(表5~表6,图 2~图3)。
表4 载脂蛋白E缺乏小鼠治疗后与其他各组RPE厚度、Bruch’s膜厚度比较()

表4 载脂蛋白E缺乏小鼠治疗后与其他各组RPE厚度、Bruch’s膜厚度比较()
注:与普食组比较,①P<0.05;与阴性对照组比较,②P<0.05(单因素方差分析,LSD法)。RPE:视网膜色素上皮
组别 样本量 RPE厚度/μm Bruch’s膜厚度/μm低浓度给药组 10 5.08±0.34① 0.89±0.09②中浓度给药组 10 5.09±0.40① 0.90±0.09②高浓度给药组 10 5.10±0.46① 0.90±0.05②阴性对照组 10 4.98±0.50① 1.02±0.13①普食组 10 7.53±0.99 0.89±0.11
表5 各组载脂蛋白E缺乏小鼠实验结束时RBCC中VEGF 的表达情况()

表5 各组载脂蛋白E缺乏小鼠实验结束时RBCC中VEGF 的表达情况()
注:与阴性对照组比较,①P<0.05;与普食组比较,②P<0.05;与中浓度给药组比较,③P<0.05(单因素方差分析,LSD法)。RBCC:视网膜色素上皮-玻璃膜-脉络膜毛细血管复合体;VEGF:血管内皮生长因子
VEGF阳性表达积分光密度低浓度给药组 10 71270±7115①③ 39368±5514①③中浓度给药组 10 59945±3981① 33078±4519①高浓度给药组 10 70137±5981①③ 39243±6106①③阴性对照组 10 81439±13732② 45811±7439②普食组 10 64032±11300 33493±5911组别 样本量VEGF阳性表达总面积/μm2
表6 各组载脂蛋白E缺乏小鼠实验结束时RBCC中VEGFR2 的表达情况()

表6 各组载脂蛋白E缺乏小鼠实验结束时RBCC中VEGFR2 的表达情况()
注:与阴性对照组比较,①P<0.05;与普食组比较,②P<0.05;与中浓度给药组比较,③P<0.05(单因素方差分析,LSD法)。RBCC:视网膜色素上皮-玻璃膜-脉络膜毛细血管复合体;VEGFR2:血管内皮生长因子的R2受体
VEGFR2阳性表达积分光密度低浓度给药组 10 71977±8201①③ 39613±6436①③中浓度给药组 10 61279±8778① 32731±4398①高浓度给药组 10 71890±5873①③ 39434±4812①③阴性对照组 10 82782±14968② 46415±8844②普食组 10 64855±8358 35077±6665组别 样本量VEGFR2阳性表达总面积/μm2

图1 各组载脂蛋白E缺乏小鼠视网膜光学显微镜下所见(Masson三色染色×200)。1A.阴性对照组;1B.普食组;1C.低浓度给药组;1D.高浓度给药组;1E.中浓度给药组。RPE厚度:阴性对照组明显低于普食组;Bruch's膜厚度:阴性对照组明显高于治疗组及普食组图2 各组载脂蛋白E缺乏小鼠视网膜VEGF表达情况(×200)。2A.阴性对照组;2B.普食组;2C:低浓度给药组;2D.高浓度给药组;2E.中浓度给药组。普食组及各药物治疗组VEGF的阳性表达均明显低于阴性对照组;中浓度给药组的VEGF表达明显低于低、高浓度给药组。VEGF:血管内皮生长因子图3 各组载脂蛋白E缺乏小鼠视网膜VEGFR2表达情况(×200)。3A.阴性对照组;3B.普食组;3C.低浓度给药组;3D.高浓度给药组;3E.中浓度给药组。普食组及各药物治疗组VEGFR2的阳性表达均明显低于阴性对照组;中浓度给药组的VEGFR2表达明显低于低、高浓度给药组。VEGFR2:血管内皮生长因子的R2受体
2.5 RBCC的超微结构(图4~图6)
2.5.1 RPE:阴性对照组基底膜皱褶变短且减少,胞质内线粒体肿胀,可见核边集及核固缩,以及次级溶酶体。胞浆内可见大量白色空泡(△所示)。普食组可见基底膜皱稀疏,胞质内个别线粒体肿胀,可见次级溶酶体,胞浆内少量白色空泡。低浓度给药组基底皱褶排列整齐,胞质内线粒体结构清晰,可见次级溶酶体,大量色素颗粒,少量白色空泡。高浓度给药组基底皱褶排列整齐,胞质内线粒体结构清晰,可见次级溶酶体,色素颗粒较少,少许白色空泡。中浓度给药组基底皱褶排列整齐,胞质内线粒体结构清晰,可见次级溶酶体,色素颗粒明显减少,未见白色空泡。
2.5.2 Bruch’s膜:阴性对照组较其它组增厚,可见大量半透明物沉积(☆所示),纤维结构减少,弹力层断裂。普食组Bruch’s膜结构清晰,较为均匀,见少许半透明物沉积,纤维结构连续;低浓度给药组Bruch’s膜结构清晰,较为均匀,少许半透明物沉积,纤维结构较连续。高浓度给药组Bruch’s膜结构清晰,较为均匀,少许半透明物沉积,纤维结构较连续。中浓度给药组Bruch’s膜结构清晰,较为均匀,未见半透明物沉积,纤维结构连续,厚度明显较阴性对照组变薄。
2.5.3 脉络膜毛细血管:阴性对照组见内皮细胞肿胀、变形,细胞核形态极不规则,异染色质边集,内皮细胞间连接破坏,基底膜阶段性增厚,管腔变窄。普食组的血管由一层连续的有窗孔的内皮细胞构成(箭头所示),内皮细胞形态正常,线粒体轻度肿胀。各药物治疗组内皮细胞结构形态正常,基底膜规则,管腔正常,线粒体结构正常。

图4 各组载脂蛋白E缺乏小鼠视网膜色素上皮(RPE)透射电子显微镜所见。4A.阴性对照组,胞浆内可见大量白色空泡;4B.普食组;4C.低浓度给药组;4D.高浓度给药组;4E.中浓度给药组。BM:Bruch’s膜;△代表胞浆内空泡

图5 各组载脂蛋白E缺乏小鼠Brush’s膜(BM)透射电子显微镜所见。5A.阴性对照组,可见大量半透明物沉积;5B.普食组;5C.低浓度给药组;5D.高浓度给药组;5E.中浓度给药组。☆代表半透明物沉积

图6 各组载脂蛋白E缺乏小鼠脉络膜毛细血管层(CC)透射电子显微镜所见。6A.阴性对照组;6B.普食组,血管由一层连续的有窗孔的内皮细胞构成(→所示);6C.低浓度给药组;6D.高浓度给药组;6E.中浓度给药组。☆代表半透明物沉积
3 讨论
AMD属于黄斑疾病,根据陈达夫黄斑属足太阴脾经的理论,本病的发病与脾脏的功能异常有关。曾庆华等〔10〕对本病的病位和脏腑归属进行了更为深入的分析,认为本病“标”在黄斑属脾胃,“本”在黄斑之下的脉络膜属少阴心肾,病位在脉络膜毛细血管复合体等组织。该组织既富有心所主的血脉,又富有肾所主的色素,而黄斑色黄属脾,故本病与脾肾心三脏密切相关。就病机特点而言,AMD证属本虚标实,虚为脾肾虚衰、气血不足,实为痰瘀同病、痰瘀互结;病机关键是痰瘀同病,故在施治时应重视化痰祛瘀,这也是中医治疗AMD痰瘀互结致病的必要手段,但治疗痰瘀胶结的着眼点仍是辨证,以便能更精确地把握机体某一阶段的病理,达到事半功倍的效果〔11〕。本课题吸收陈达夫及曾庆华教授的理论,以健脾祛瘀法循经选药拟定黄斑康方来治疗AMD,该方由生蒲黄、川芎、丹参、牡丹皮、郁金等中药组成,化痰祛瘀,并具有改善血脂、血液流变学指标,以及抗氧自由基的综合作用〔12〕。
本实验中,血脂异常模型小鼠经健脾祛瘀药物治疗后,其体质量、血脂、血液流变学指标均较阴性对照组明显降低,RBCC的病理改变也轻于阴性对照组。治疗组RPE基底皱褶排列整齐,线粒体结构清晰,可见次级溶酶体,未见大量空泡出现;Bruch’s膜结构清晰;脉络膜毛细血管内皮细胞结构形态正常,基底膜规则,管腔正常。这可能与药物清除了血液中的脂质,阻止脂类物质进入细胞线粒体,减少氧自由基数量,并改善Bruch’s膜代谢产物转运有关。但因RPE不可再生,治疗组的RPE虽较阴性对照组稍厚,其差异却无统计学意义。
Katrina Spilsbury〔13〕等实验发现,大鼠 RPE 细胞VEGF的暂时性高表达会引起脉络膜新生血管的形成。VEGF是内皮细胞特异性的有丝分裂因子,可诱导内皮细胞的增殖、移迁,刺激VEGFR2介导新生血管内皮细胞DNA合成和增殖。VEGFR2是VEGF的主要功能受体,它作为一种酪氨酸激酶受体与VEGF结合,形成二聚体及酪氨酸发生自身磷酸化,激活并将细胞膜/细胞质激酶级联反应信号传递到细胞核,引发内皮细胞的一系列变化,促进新生血管形成并维持其完整性。VEGFR2还参与由VEGF介导的血管通透性改变〔7-9〕,下调VEGF的表达可以阻断VEGF/VEGFR2信号传导通路。本实验通过免疫组化方法检测小鼠RBCC中VEGF、VEGFR2的表达,结果药物治疗组的VEGF及VEGFR2表达较阴性对照组明显减少,中浓度给药组的VEGF、VEGFR2表达较低、高浓度给药组低,说明中剂量的健脾祛瘀方在一定程度上抑制了血脂异常小鼠RBCC上VEGF及VEGFR2表达。
综上所述,健脾祛瘀中药可减轻实验性血脂异常小鼠RBCC的病理性损害,一定程度上下调RBCC中VEGF、VEGFR2的表达,并可改善模型动物体质量、血脂和血液流变学指标,这可能是其预防和治疗CNV的作用机制。
[1]张承芬.眼底病学[M].北京:人民卫生出版社,1998:339-348.
[2]莫 亚,曾庆华,谢礼丹,等.血脂异常对APOE基因缺失小鼠视网膜及 Bruch 膜的影响[J].国际眼科杂志,2011,11(9):1518-1520.
[3]Sivaprasad S, Bailey TA, Chong VNH.Bruch’s membrane and the vascular intima:is there a common basis for age-related changes and disease?[J].Clin Exp Ophthalmologic, 2005,33(5): 518-523.
[4]Curcio CA,Millican C,Bailey T,et al.Accumulation of cholesterol with age in human Bruch’s membrane[J].Invest Ophthalmology Vis Sci,2001,42(1):265-274.
[5]Haimovici R,Gantz DL,Rumelt S,et al.The lipid composition of drusen, Bruch’s membrane, and sclera by hot stage polarizing light microscopy[J].Invest Ophthalmologic Vis Sci,2001,42(7):1592-1599.
[6]赵世红,何守志,史雪辉.血管内皮生长因子及其受体在实验性脉络膜新生血管中的表达[J].中华眼科杂志,2004,40(8):522-527.
[7]Li B,Fuh G,Meng G,et al.Receptor-selective variants of human vascular endothelial growth factor.Generation and cha racterization[J].J Biof Chem,2000,275(38):29823-29828.
[8]Gille H,Kowalski J,Li B,et al.Analysis of biology effects and signaling properties of Flt-1(VEGFR1 ) and KDR(VEGFR2 ).Areassessment using novel receptor-specific vascular endothelial growth factor mutants[J].Biof Chem,2001,276(5):3222-3230.
[9]Larrivée B, Karsan A.Signaling pathways induced by vascular endothelial growth facto r(review)[J].Int J Mol Med,2000,5(5):447-456.
[10]曾庆华,莫 亚,陈 丽.年龄相关性黄斑变性115例中医证侯分型[J].中国中医眼科杂志,2009,19(5):274-277.
[11]陈丽,张敬卫,曾庆华.年龄相关性黄斑变性痰瘀病机探析[J].中国中医眼科杂志,2010,20(6):351-352.
[12]沈映君.中药药理学[M].北京:人民卫生出版社,2000:606,632,2811.
[13]Spilsbury K,Garrett KL,Shen WY,et al.Overexpression of vascular endothelial growth factor (VEGF)in the retinal pigment epithelium leads to the development of choroidal neovascularization[J].Am J Pathol,2000,157(1): 135-144.

