破骨细胞核因子κB受体活化因子配基和骨保护因子在种植体周围软组织及骨组织的表达
周文娟 柳忠豪 许胜 郝鹏杰 许丰伟 孙爱杰 卢志山
(1.烟台市口腔医院 种植中心;2.滨州医学院 口腔学院,烟台 264008)
口腔种植学现已成为当今口腔医学领域中发展最快、影响力最大的一个分支,种植义齿已被越来越多的牙医和缺牙患者所接受。1977年Brånemark等[1]提出种植体“骨结合”的概念,并将其作为种植成功的评价标准。种植体周围的骨吸收是影响种植体长期稳定性和成功率的主要因素。近来发现的破骨细胞核因子κB受体活化因子配基(receptor activator nuclear factor kappa B ligand,RANKL)及其伪受体骨保护因子(osteoprotegerin,OPG)属于新的肿瘤坏死因子(tumor necrosis factor,TNF)配体和受体家族成员,是细胞外调节骨吸收的关键因子,在骨吸收复杂的调控网络中处于中心地位。初步研究认为RANKL和OPG可能在种植体周围的骨吸收中起着重要作用[2-3]。为进一步了解RANKL和OPG在种植体周围牙槽骨改建中可能发挥的作用,本研究采用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)法和免疫组化染色,探讨RANKL和OPG在非负荷期种植体周围软组织和骨组织中的表达变化和时间分布特点。
1 材料和方法
1.1 建模和分组
选取购自山东省天然药物工程技术研究中心的雄性健康成年Beagle犬6只,1~2岁龄,体重10.85~12.30 kg,适应性喂养1周。选取Beagle犬的下颌左右第二前磨牙和第四前磨牙共计24个牙位,按照完全随机化的原则将牙位分为2组,即实验组(12个牙位)和对照组(采用对侧同名牙齿,12个牙位)。对照组和实验组分别于实验当天、第30、60、75、83、87天6个时间点随机完整拔除各2颗前磨牙。实验组在对照组拔牙的同时,拔除动物对照组的对侧同名牙齿,每个拔牙创选取2个牙槽窝常规预备种植窝,参照文献[4]在犬左侧下颌各拔牙位点即刻植入ITI螺纹柱形纯钛种植体,各时间段分别植入种植体4颗,共计24颗。本实验在建模过程中采用了时间上的倒叙,即将6只Beagle犬在同一时间处死,在实验第90天,分别取种植体植入后3、7、15、30、60、90 d共6个时间点分别处死动物并制取标本。对实验组种植体周围和对照组拔牙创周围约2mm的软组织进行实时荧光定量PCR检测。同期处死动物,取下颌骨进行大体标本观察,拍摄X线片,取种植体周围约5mm的骨组织行免疫组化检测。
1.2 实验方法
将Beagle犬3.5%戊巴比妥钠(1mL·kg-1体重)经静脉推注进行全身麻醉,仰卧固定于手术台上,微创拔除Beagle犬的下颌左右第二前磨牙和第四前磨牙,在各犬左侧下颌拔牙位点近远中根区即刻植入ITI螺纹柱形纯钛种植体(SLAR,Straumann公司,瑞士),直径3.3mm,长度10mm,埋入式缝合创口,术后庆大霉素抗感染治疗。整个实验过程各组均无炎症出现。在深度麻醉下迅速切取实验组种植体周围和对照组拔牙创周围约2mm的软组织后,以4%甲醛灌流固定方法处死动物,制取标本。
1.3 观察指标
1.3.1 大体标本观察和X线片观察 术后检查种植体周软组织有无红肿、破溃、溢脓,种植体有无松动。处死动物后,取下颌骨,拍大体照片,行X线数字成像检查,观察种植体与骨组织间间隙、种植体周骨密度以及种植体周骨质吸收状况。
1.3.2 实时荧光定量PCR检测OPG和RANKL mRNA的表达 分别在种植体植入后3、7、15、30、60、90 d,深度麻醉下迅速切取实验组种植体周围软组织和对照组拔牙创周围软组织约2mm,放入液氮内备用。随后取出放于玻璃研磨器内,加入1 000μL Trizol(Invitrogen公司,美国)溶液匀浆化后,分离、沉淀、洗脱及再溶解提取总RNA,测定样品核酸浓度和纯度(A260nm/A280nm)3次,取均值。总RNA经DNA处理,2μg用于逆转录合成cDNA。将正义及反义引物各0.1μL、模板cDNA 0.5μL混合于反应管,添加荧光物质SYBR Green PCR Master Mix(Takara)5μL,无核酸酶水4.1μL,共计10μL进行实时荧光定量PCR反应。合成OPG和RANKL引物序列(由上海生工生物工程技术服务有限公司提供)见表1。

表1 合成OPG和RANKL引物序列及PCR产物长度估计Tab 1 Synthesis of OPG and RANKL primer sequences and estimated product length of PCR
每一扩增目的基因做3个复孔,将所有反应管放入热循环仪中,94℃ 30 s,94℃变性5 s,60℃ 34 s。最后2个步骤共40个循环,在1min时收集信号。存储荧光信号,分析DNA的扩增曲线。在实时荧光定量PCR仪上应用相对定量分析软件进行分析,显示扩增和溶解曲线,比较各组基因的表达水平。
1.3.3 免疫组化检测OPG和RANKL的表达 带种植体的下颌骨标本经固定、脱钙后顺利将种植体旋出,取种植体周围约5mm的骨组织,经脱水、透明及包埋后,沿近远中向连续切片,厚度为5μm,严格按照试剂说明书采用免疫组化SP法,检测OPG和RANKL蛋白的表达。
1.4 统计学处理
采用SPSS 13.0统计软件对实验数据进行单因素方差分析(One-way ANOVA),组内两两比较进行t检验,P≤0.05为差异有统计学意义。
2 结果
2.1 一般情况
实验动物均保持良好的状态,无一患病或死亡。种植体周围软组织无感染、红肿、破溃等现象发生。处死动物后,取下颌骨标本检查种植体动度,发现种植体无明显动度,金属杆叩击音清脆。
2.2 X线片观察
各时间段种植体与骨组织间均无明显间隙,种植体周骨密度随时间增加而增加,种植体周骨质无明显的吸收状况(图1)。

2.3 OPG和RANKL mRNA水平的表达变化
2.3.1 实时荧光定量PCR检测OPG和RANKL mRNA各组OPG mRNA和RANKL mRNA随时间的表达变化曲线见图2、3。
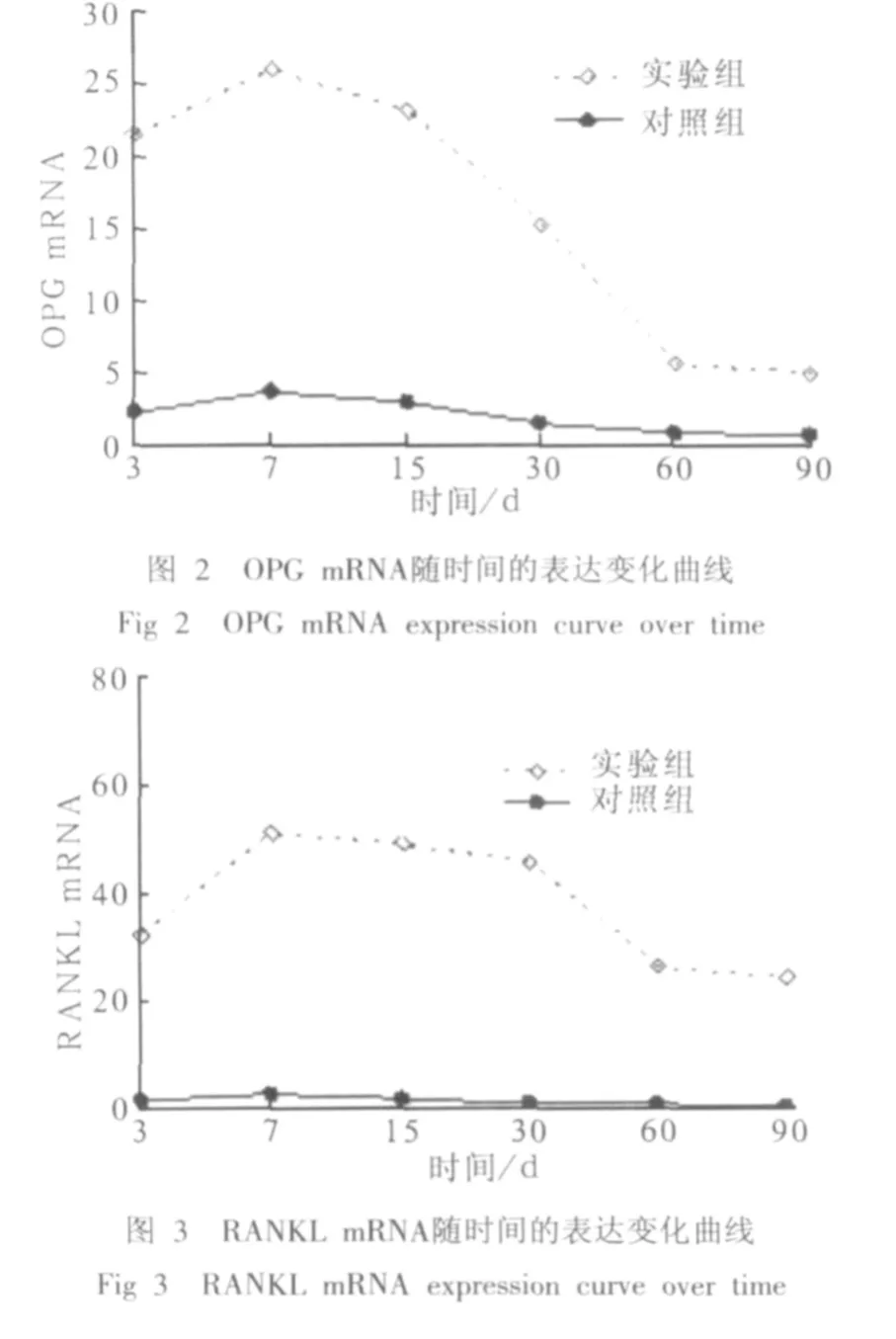
对照组与实验组OPG mRNA和RANKL mRNA表达水平均随时间的增加而增加,第7天达高峰,而后逐渐降低。
2.3.2 实时荧光定量PCR检测OPG/RANKL mRNA比值的表达 各组OPG/RANKL mRNA比值随时间的表达变化曲线见图4。对照组与实验组OPG/RANKL mRNA比值前7 d随时间的增加而减小,之后逐渐升高趋于平衡。

2.4 OPG和RANKL的免疫组化染色
免疫组化染色可见OPG和RANKL表达在骨基质、成骨细胞及骨髓基质细胞中,阳性表达呈棕色。种植体植入后第3天,对照组和实验组的OPG和RANKL棕色信号呈弱阳性表达,第7天棕色明显加深,第15天以后各组表达呈减弱趋势(表2、3)。
表2 不同时间段OPG表达的平均光密度值Tab 2 Average optical density of OPG in different times ±s

表2 不同时间段OPG表达的平均光密度值Tab 2 Average optical density of OPG in different times ±s
注:*为实验组采用单因素方差分析与对照组比较,P<0.05。
表3 不同时间段RANKL表达的平均光密度值Tab 3 Average optical density of RANKL in different times ±s

表3 不同时间段RANKL表达的平均光密度值Tab 3 Average optical density of RANKL in different times ±s
注:*为实验组采用单因素方差分析与对照组比较,P<0.05。
3 讨论
随着种植体骨结合理论被广泛应用于缺失牙患者的修复,种植体周围的骨吸收成为影响种植体长期稳定性和成功率的主要因素,而破骨细胞则是引起骨吸收的主要功能细胞。众多的研究资料表明:牙种植体植入后第一年骨丧失最多,且主要发生在非负荷期[5-6]。体内及体外实验研究证实,OPG/RANKL/RANK之间的比例在破骨细胞的成熟和功能上起着重要的调节作用[7-8]。骨髓基质干细胞向成骨细胞分化的过程中,RANKL/OPG的值是不断变化的,随着成骨细胞的分化成熟,比值逐渐减小,最后失去对破骨细胞的分化和激活作用[9],以确保骨吸收和骨形成两个过程紧密相连并达到平衡。一旦OPG/RANKL之间的平衡被破坏,便会导致骨质疏松、类风湿性关节炎、牙周炎等各种骨破坏疾病的发生[10-11]。
在本研究建立的种植义齿动物模型中,牙槽骨改建的最活跃期为种植体植入后的第7天,种植体周围骨组织的RANKL和OPG随种植体植入时间的增加而增加,第7天达高峰,而后逐渐降低。种植体周围软组织的RANKL和OPG mRNA表达水平均随时间的增加而增加,第7天达高峰,而后均逐渐降低,且与未植入种植体组相比,种植体植入后的表达水平明显增高,提示种植体的植入能有效地延缓牙槽骨的吸收。另外,研究发现RANKL和OPG在种植体周围软组织的表达变化不仅与骨改建过程一致,而且也与其在种植体周围骨组织的表达变化一致,说明RANKL和OPG可以同时表达在种植体周围软组织和骨组织中,对种植体植入后骨改建过程起重要调节作用。
到目前为止,未对非负荷期种植体周围RANKL和OPG的表达进行相关评估。本实验采用实时荧光定量PCR方法对种植体周围软组织中的RANKL和OPG mRNA进行检测,采用免疫组化染色检测RANKL和OPG在种植体周围骨组织中的表达,得出非负荷期种植体周围骨改建过程中RANKL和OPG的表达变化规律,有利于了解种植体植入后周围牙槽骨的改建情况,并可以尝试通过在破骨细胞活跃期采取某种相关干预措施调节RANKL/OPG的比值,从而达到抑制骨吸收的目的。
本实验研究表明:OPG和RANKL在种植体周围软组织中的变化规律与种植体周围骨组织改建过程一致,种植体周围组织可以通过OPG/RANKL系统参与破骨细胞的形成,调节骨质吸收,影响骨组织代谢微环境。
[1]Brånemark PI,Hansson BO,Adell R,et al.Osseointegrated implants in the treatment of the edentulous jaw.Experience from a 10-year period[J].Scand J Plast Reconstr Surg,1977,16(Suppl):1-132.
[2]Monov G,Strbac GD,Baron M,et al.Soluble RANKL in crevicular fluid of dental implants:A pilot study[J].Clin Implant Dent Relat Res,2006,8(3):135-141.
[3]Duarte PM,de Mendonça AC,Máximo MB,et al.Differential cytokine expressions affect the severity of peri-implant disease[J].Clin Oral Implants Res,2009,20(5):514-520.
[4]卢丙仑,刘宝林,陈小文,等.即刻种植动物模型的建立及意义[J]. 华西口腔医学杂志,1997,15(4):319-320.Lu Binglun,Liu Baolin,Chen Xiaowen,et al.The establishment and significance of animalmodel of dental implants[J].West China J Stomatol,1997,15(4):319-320.
[5]Manz MC.Factors associated with radiographic vertical bone loss around implants placed in a clinical study[J].Ann Periodontol,2000,5(1):137-151.
[6]Eriksson C,Ohlson K,Richter K,et al.Callus formation and remodeling at titanium implants[J].J Biomed Mater Res A,2007,83(4):1062-1069.
[7]Hofbauer LC,Lacey DL,Dunstan CR,et al.Interleukin-1beta and tumor necrosis factor-alpha,but not interleukin-6,stimulate osteoprotegerin ligand gene expression in human osteoblastic cells[J].Bone,1999,25(3):255-259.
[8]Zou W,Hakim I,Tschoep K,et al.Tumor necrosis factor-alpha mediates RANK ligand stimulation of osteoclast differentiation by an autocrine mechanism[J].J Cell Biochem,2001,83(1):70-83.
[9]Kostenuik PJ.Osteoprotegerin and RANKL regulate bone resorption,density,geometry and strength[J].Curr Opin Pharmacol,2005,5(6):618-625.
[10]Bostanci N,Ilgenli T,Emingil G,et al.Gingival crevicular fluid levels of RANKL and OPG in periodontal diseases:Implications of their relative ratio[J].JClin Periodontol,2007,34(5):370-376.
[11]Kearns AE,Khosla S,Kostenuik PJ.Receptor activator of nuclear factor kappa B ligand and osteoprotegerin regulation of bone remodeling in health and disease[J].Endocr Rev,2008,29(2):155-192.

