一株石油烃降解菌D2-1解烃性能研究
包木太,王丽娜,李一鸣,孙培艳,杨晓飞,曹丽歆
1)海洋化学理论与工程技术教育部重点实验室,中国海洋大学,山东青岛266100;2)国家海洋局海洋溢油鉴别与损害评估技术重点实验室,国家海洋局北海环境监测中心,山东青岛266033
随着海洋运输和海洋石油开采业的迅猛发展,海上溢油污染日益增多.溢油污染经物理方法 (如机械回收等)可清除部分表面溢油,剩余的溢油在风、浪和洋流的作用下,会漂移至滩涂或沉降海底,对海洋生态系统及人体健康造成巨大潜在风险和危害[1-2].2010年美国墨西哥湾深海地平线平台爆炸造成的溢油被称作“生态9·11”,据专家估计,墨西哥湾的生态恢复,大概需要数十年甚至上百年时间.2010年7月16日,中石油大连新港石油储备库输油管道发生爆炸,导致大量原油泄漏进入海洋,造成建国以来最严重的海洋石油污染.2011年6月,渤海湾的蓬莱19-3油田发生漏油事故,引起国内外高度关注.
微生物治理技术[3-5]是基于微生物能适应各种复杂的生态环境,从而快速降解石油中各种有毒物质的溢油处理技术.具有廉价、环保、对人畜无害等优点,在一些大型油污染事故的治理方面做了试验性应用,取得了一定的应用效果.
本研究从东营长期受原油污染的土壤中筛选得到一株高效石油烃降解菌D2-1,并对其理化性质进行测定.结果证明,菌株D2-1在低温偏碱性的水体环境中同样具有较好的解烃能力,具有在海洋原油污染环境中应用的潜能.本文在室内模拟实验基础上,优化了微生物对原油的降解条件,研究了石油烃降解菌Stenotrophomonas sp.D2-1对石油烃的指纹降解规律,探讨了微生物修复菌剂在海洋环境中对原油的动力学降解机理,为后续应用研究奠定了基础.
1 实验材料
1.1 原油与土样来源
实验所用原油取自胜利油田,其物性参数为:黏度22.2 mPa·s(50℃,50 r/min),凝固点23.0℃,密度0.855 2 g/cm3,无蜡蒸出.石油污染土壤取自山东东营长期被石油污染区域地表及地下15 cm.
1.2 培养基
牛肉膏蛋白胨培养基:牛肉膏3.0 g、蛋白胨10 g、NaCl 5.0 g、蒸馏水1 000 mL,pH值7.2~7.4,在121℃灭菌30 min后备用.油培养基:在无机盐培养基[3]中加入2 g/L的原油与1 mL的微量元素溶液.油平板:由无机盐培养基加入20 g/L琼脂制成,且表面均匀涂布一层灭菌后的原油.
2 实验方法
2.1 菌种的富集和分离
取10 g原油污染土壤加入到100 mL人工海水培养基中,充分振摇后静置,用无菌注射器取上清液,接种到100 mL的油培养基中 (体积分数为2.0%),在温度30℃,130 r/min条件下培养7 d.然后取油培养基中培养液3 mL,接入100 mL新鲜的油培养基中,相同培养条件下,对烃降解菌进行3次富集.取最终富集的培养液,稀释涂布后利用油平板反复分离和纯化,将不同颜色不同形态的单菌落挑出保存于斜面培养基上[6],于4℃冷藏备用.
2.2 优势烃降解菌株的筛选和制备
相同培养条件下,将菌株在含5 g/L原油的油培养基中培养7 d,选原油降解率最高的菌株作为研究对象.将其种子液离心,弃上清液,用磷酸缓冲溶液清洗3次,然后用无菌水制成菌悬液,调节菌悬液光密度值 D(600 nm)为0.9 备用[3,7].
2.3 优势烃降解菌的16S rDNA鉴定
利用DNA提取试剂盒 (天根生化科技 (北京)有限公司)提取菌株D2-1的总DNA,通过细菌通用引物进行PCR扩增[8],将菌株D2-1的测序结果提交至GenBank注册.获得基因序列号后,将序列结果与基因库中已登录的16S rDNA序列进行同源性比较,对获得的同源序列进行分析,采用MEGA 4.0软件构建菌株D2-1的系统发育树.
2.4 优势菌株对原油最适降解条件的考察
对菌株D2-1进行一系列单因子条件优化实验.分别考察底物浓度、初始pH值、温度和盐浓度对原油降解过程的影响,利用平板菌落计数法统计分析实验过程中的细菌浓度 (单位:mL-1),确定了该菌降解原油的最佳环境条件.
2.5 石油烃降解率的测定
原油降解率测定.摇瓶过程中,经一定时间培养,给100 mL培养液中分两次加入40 mL石油醚,充分萃取1 h后取上层有机相,通过紫外分光光度法在λ=225 nm处测定培养基中残余油组分[9].以单位生物量单位时间内原油质量浓度变化[10]表征微生物对原油的降解率η(单位:mg·L-1·d-1)

其中,ρi为原油的初始质量浓度 (单位:mg/L);ρf为微生物降解后培养基中原油的质量浓度 (单位:mg/L);n为培养基中微生物菌株数量;t为培养时间 (单位:d).
原油中烃组分测定.用气相色谱 (岛津GC-2010)分析原油中正构烷烃,毛细管色谱柱30 m×0.32 mm;载气为高纯氮气;进样口温度290℃,检测器温度300℃;升温程序为50℃保持2 min,然后以6℃/min升到300℃,在300℃保持16 min;进样量为1 μL,采用不分流自动进样方式,进样1 min.
2.6 优势烃降解菌降解过程研究
将优势烃降解菌接入原油培养基中,测定原油降解率随时间变化情况,分析优势菌株的烃降解动力学过程.
3 结果与讨论
3.1 石油烃降解菌的分离和筛选
经油培养基富集,分离纯化以原油为唯一碳源的菌株,获得具有烃降解性能的菌株11株,培养7 d后,测定其对原油的去除率,结果如图1.其中,共有4株菌对原油的去除率超过40%,菌株D2-1对原油的去除率最高,达到58%.

图1 分离得到的烃降解菌对原油的去除率Fig.1 Oil removal rates of isolated bacteria
3.2 优势烃降解菌株D2-1的鉴定
对菌株D2-1进行形态观察和生理生化鉴定.结果发现,菌株D2-1呈杆状,革兰氏阴性,无芽孢,在平板上呈规则的浅黄色圆形菌落分布,菌落表面光滑湿润;为葡萄糖氧化型菌株,接触酶实验和甲基红实验为阳性,V-P实验为阴性;菌株代谢能使明胶液化且使淀粉水解,但不能水解纤维素.
将菌株 D2-1大小约1 409碱基对(base pair,bp)的16S rDNA片段提交至GenBank注册后,获得基因序列号为HQ731042.将序列结果与基因库中已登录的16S rDNA序列进行同源性比较,结果表明,菌株D2-1与寡养食单胞菌(Stenotrophomonas sp.)的同源性达到100%.采用MEGA 4.0软件构建菌株D2-1的系统发育树,结果如图2.鉴于以上结果,将优势烃降解菌D2-1命名为寡养食单胞菌(Stenotrophomonas sp.)D2-1.

图2 优势烃降解菌D2-1的系统发育树Fig.2 Phylogenetic tree of petroleum-degrading strain Stenotrophomonas sp.D2-1
3.3 菌株D2-1降解原油的最佳条件
底物浓度的影响.本研究考察了菌株D2-1在含有不同质量浓度原油的人工海水培养基中的去除率和微生物菌株生长对数log n,结果如图3.由图3可见,随原油质量浓度增大,菌株D2-1对原油的去除率渐减,菌株总数也明显下降.培养基中烃对菌体的毒性作用在一定程度上影响了微生物的新陈代谢[11-12].由于在原油质量浓度5.0~20 g/L范围内,多数菌株对原油的去除率无显著影响,烃组分对菌体的毒性作用较低[13-14],由此推测,当原油质量浓度小于2.0 g/L时,菌株D2-1对原油的去除率应该更高.在原油质量浓度达到20 g/L时,菌株D2-1仍能降解20%以上的原油,细菌浓度为1.66×108/mL,说明优势烃降解菌D2-1具有较宽的原油耐受范围,有利于将来在现场修复环境中应用.
初始pH值的影响.本研究考察了菌株D2-1在不同pH值条件下培养7 d后,对原油的降解效果,如图4.由图4可见,随pH值增大,菌株D2-1对原油的降解率渐增,在pH=8.0时降解率最高,此时,细菌浓度为2.69×109/mL,数量级保持在9以上;pH值继续增大时,原油的降解率渐减.可见,菌株D2-1在偏碱性的环境中对原油的降解率明显高于中性偏酸性的环境,其最适pH值为8.0.

图3 不同质量浓度条件下的原油去除率Fig.3 Oil degradation rates under different concentration of substrate
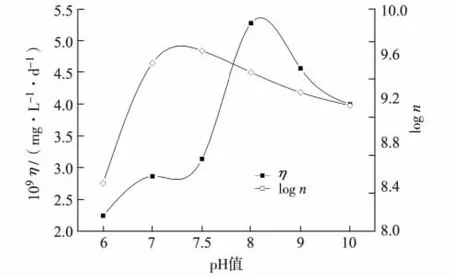
图4 不同初始pH值条件下原油的降解率Fig.4 Oil degradation rates under different initial pH
温度的影响.温度对微生物新陈代谢过程中酶的活性具有较强的影响.不同温度条件下菌株D2-1的降解效率如图5.由图5可知,随着温度的升高,酶的活性增强,微生物的生物量渐增.25℃时原油的降解率达到最高,细菌浓度为4.92×109/mL.温度继续升高时,原油的降解率明显下降,而细菌浓度虽略有降低,但数量级仍维持在9的水平.与其他具有高效烃降解性能的菌株相比[6],D2-1在中低温环境中仍保持有效的解烃性能,为海洋溢油环境的现场修复提供了可能.

图5 不同初始温度条件下原油的降解率Fig.5 Oil degradation rates under different temperature
盐质量浓度影响.盐质量浓度对微生物生长中细胞的渗透压具有较明显的影响.在菌株耐盐性考察过程中,利用NaCl调节培养基的盐质量浓度,结果如图6.

图6 不同盐质量浓度条件下原油的降解率Fig.6 Oil degradation rates under different concentration of NaCl
随着NaCl质量浓度的逐渐升高,菌株D2-1对原油的降解率渐增,细菌总数虽略有升高,但在盐质量浓度大于15 g/L时保持在一定范围内做窄幅波动,相比底物浓度对微生物生长的影响,菌株对盐度变化并不敏感.在30 g/L NaCl条件下,D2-1对石油烃组分的去除率最高,降解率最大,细菌浓度为3.10×109/mL.含盐量继续增大时,石油烃的降解率逐渐下降.由实验结果可知,烃降解菌D2-1具有良好的耐盐性,适合菌体生长的盐质量浓度与海洋环境的盐质量浓度相近,具有很强的在海水环境中进行应用的潜力.
3.4 菌株D2-1降解前后的烃组分分析
将培养14 d后的培养基中油组分全部萃取进行GC-FID检测,结果如图7.从油指纹结果可见,经14 d的生物降解,菌株D2-1对原油中正构烷烃具有较好的去除作用,培养基中C9~C38都有很大程度降解.其中,短链的烃组分C9~C14基本完全消失;C15~C22对D2-1的生物降解作用较敏感,降解率在16% ~65%;长链烷烃C23~C38的降解率在33% ~80%.采用C17和姥鲛烷(pristane,Pr)峰面积比及 C18和植烷(phytane,Ph)峰面积比[15]表征生物降解程度,发现经菌株D2-1降解,由处理前的2.45和2.92分别降至1.37和1.93,进一步证明石油烃降解菌D2-1对原油中烷烃组分具备有效降解作用,原油中烃组分都能够被D2-1有效代谢.

图7 原油中各烃组分的GC-FID色谱图Fig.7 GC-FID chromatograms of petroleum components in oil samples
3.5 微生物降解动力学过程的考察
优势烃降解菌D2-1对原油去除率随时间的变化如图8.随培养时间延长,菌株对原油的去除率逐渐提高.13 d后,原油的降解率提高缓慢并趋于稳定.
文献[16]指出,微生物对原油的降解符合一级动力学过程.张秀霞等[6]对石油烃降解菌Y-16的研究也证实,细菌对原油培养基适应期过后,在2~7d,菌株对石油烃的去除率符合一级反应动力学,

图8 菌株D2-1对原油去除率随时间的变化Fig.8 Curve of crude oil removal rates with time

其中,ρ0为培养基中烃组分初始质量浓度;ρ为检测时刻培养基中烃组分的质量浓度;t为时间;k为速度常数 (底物去除常数).
将菌株D2-1降解原油过程的实验点进行线性回归,结果如图9.石油烃降解的动力学过程可表示为y=0.071 1x-0.043 1,R2=0.980 3.从烃降解菌D2-1接入原油培养基开始,至培养13 d原油的降解率趋于稳定,菌株D2-1对原油的去除率符合一级动力学过程.

图9 微生物对原油降解的动力学曲线Fig.9 Kinetic curve of crude oil degradationby microorganism D2-1
结 语
本研究从山东东营长期受原油污染的土壤中筛选得到一株能以原油为唯一碳源的微生物菌株D2-1,考察其在海洋环境中的烃降解能力,研究表明:①革兰氏阴性菌D2-1在质量浓度为2 g/L的原油培养基中,对原油的去除率达58%,环境的改变对菌株烃降解能力的影响较小;②菌株D2-1对底物的耐受范围较宽,适宜在中性偏碱性的环境中代谢生长,在低温、NaCl质量浓度为30 g/L环境中仍保持较好的解烃活性;③ 通过对特征烃组分的检测及特征比值的计算,菌株D2-1对原油中轻质组分的去除率较高;④分析了菌株在海洋环境中降解原油的机制,通过动力学研究发现,菌株D2-1对原油的降解较好的符合了一级动力学过程.
/References:
[1]LIU B,Romaire R P,Delaune R D,et al.Field investigation on the toxicity of Alaska North Slope crude oil(ANSC)and dispersed ANSC crude to Gulf killifish,Eastern oyster and white shrimp[J].Chemosphere,2006,62(4):520-526
[2]Paul D B,Jerry M N,David S P.Assessment of polycyclic aromatic hydrocarbon exposure in the waters of Prince William Sound after the Exxon Valdez oil spill:1989-2005[J].Marine Pollution Bulletin,2007,54(3):339-367.
[3]Liu C W,Chang W N,Liu H S.Bioremediation of n-alkanes and the formation of biofloccules by Rhodococcus erythropolis NTU-1 under various saline conditions and sea water[J].Biochemical Engineering Journal,2009,45(1):69-75.
[4]Uad I,Silva-Castro G A,Pozo C,et al.Biodegradative potential and characterization of bioemulsifiers of marine bacteria isolated from samples of seawater,sediment and fuel extracted at 4 000 m of depth(Prestige Wreck)[J].International Biodeterioration& Biodegradation,2010,64(6):511-518.
[5]WANG Xing-biao,CHI Chang-qiao,NIE Yong,et al.Degradation of petroleum hydrocarbons(C6-C40)and crude oil by a novel Dietzia strain[J].Bioresource Technology,2011,102(17):7755-7761.
[6]ZHANG Xiu-xia,ZHENG Mao-sheng,WANG Rong-jing,et al.Screening of efficient hydrocarbon degrading bacteria Y-16 from petroleum contaminated soil and its degradation characteristics[J].Chinese Journal of Environmental Engineering,2010,4(8):1916-1920.(in Chinese)张秀霞,郑茂盛,王荣靖,等.石油污染土壤中高效石油烃降解菌Y-16的筛选及其降解性能[J].环境工程学报,2010,4(8):1916-1920.
[7]SHEN Ping,FAN Xiu-rong,LI Guang-wu.Microbiology Experiment(3rd ed.)[M].Beijing:Higher Education Press,1999:28-32.(in Chinese)沈 萍,范秀容,李广武.微生物学实验[M]3版.北京:高等教育出版社,1999:28-32.
[8]WANG Hai-feng,BAO Mu-tai,HAN Hong,et al.Isolation and identification of a Bacillus subtilis and its characterization in degrading heavy oil[J].Journal of Shenzhen University Science and Engineering,2009,26(3):221-227.(in Chinese)王海峰,包木太,韩 红,等.一株枯草芽孢杆菌分离鉴定及其降解稠油特性[J].深圳大学学报理工版,2009,26(3):221-227.
[9]SY/T 0530-93.Oil content determination method in oil field sewage treatment-spectrophotometry[S].(in Chinese)中华人民共和国石油天然气行业标准SY/T 0530-93.油田污水中含油量测定方法-分光光度法[S].
[10]Hii Y S,Law A T,Shazili N A M,et al.Biodegradation of Tapis blended crude oil in marine sediment by a consortium of symbiotic bacteria[J].International Biodeterioration& Biodegradation,2009,63(2):142-150.
[11]LI Hai-hua,SHAN Ai-qin,ZHOU Hai-xia.Study on the screening and function of degrading petroleum bacteria[J].Pollution Control Technology,2008,21(5):10-12.(in Chinese)李海花,单爱琴,周海霞.石油降解菌的筛选及降解性能研究[J].污染防治技术,2008,21(5):10-12.
[12]HE Yong-hua,HU Li-fang,SHEN Dong-sheng,et al.Progress in contaminated environmentbioremediation[J].Bulletin of Science and Technology,2007,23(2):271-276.(in Chinese)贺永华,胡立芳,沈东升,等.污染环境生物修复技术研究进展[J].科技通报,2007,23(2):271-276.
[13]YAO Yao,ZHENG Qing-song,LIU Zhao-pu,et al.Optimization of conditions for growth and petroleum degradation of two strains of petroleum-degrading bacteria[J].Journal of Ecology and Rural Environment,2011,27(5):48-53.(in Chinese)姚 瑶,郑青松,刘兆普,等.2株石油降解菌生长和降解石油条件的优化[J].生态与农村环境学报,2011,27(5):48-53.
[14]DING Ming-yu,HUANG Jian,LI Yong-qi.The degradation of crude oil by marine microorganisms[J].Acta Science Circumstantiae,2001,21(1):84-88.(in Chinese)丁明宇,黄 健,李永祺.海洋微生物降解石油的研究[J].环境科学学报,2001,21(1):84-88.
[15]WANG Zhen-di,Fingas M,Blenkinsopp S,et al.Comparisons of oil composition changes due to biodegradation and physical weathering in different oils[J].Journal of Chromatography A,1998,809(1/2):89-107.
[16]LI Jin-cheng,XIA Wen-xiang,ZHENG Xi-lai,et al.Degradation and adsorption of dissolved petroleum in the water body of sandy beach[J].Marine Science Bulletin,2007,26(2):28-32,59.(in Chinese)李金成,夏文香,郑西来,等.沙滩水体中溶解性石油烃的降解及吸附研究[J].海洋通报,2007,26(2):28-32,59.

