膜性肾病静脉血栓栓塞症的临床研究
李世军 郭锦洲 左 科 张 炯 吴 燕 周长圣 卢光明 刘志红
膜性肾病常合并有静脉血栓栓塞症(venous thromboembolism,VTE),包括肾静脉血栓(renal vein thrombosis,RVT)和深静脉血栓(deep vein thrombosis,DVT),并可导致肺动脉栓塞(pulmonary embolism,PE),严重威胁患者生命。RVT是膜性肾病最常见的并发症,由于研究方法的差异,文献报告其发生率差别很大[1]。临床症状典型的RVT并不多见,以往主要采用有创的肾静脉造影来观察RVT的发生率,限制了其临床应用。故国内外有关膜性肾病VTE的实际发生率并不清楚。近年来,随着影像技术的发展,CT血管成像在临床应用,其敏感度与特异度不断提高,在临床上完全可替代选择性肾静脉造影诊断RVT和PE[2,3 ]。为此,我们采用双源CT血管成像技术前瞻性观察了100例临床表现为NS的膜性肾病患者VTE的发生率,并对血栓组和无血栓患者进行比较,探讨影响膜性肾病静脉血栓发生的危险因素,为临床诊断与治疗静脉血栓栓塞症提供依据。
对象和方法
研究对象选择2009-06-01~2010-12-31南京军区南京总医院全军肾脏病研究所住院患者,入选标准如下: (1)经肾活检确诊为膜性肾病;(2)临床表现NS,血清白蛋白(Alb)<30 g/L;尿蛋白定量>3.5 g/d,血清肌酐(SCr)<176.8 μmol/L;(3)所有患者均未经过肝素,低分子肝素或华法令抗凝治疗;(4)排除系统性红斑狼疮,抗磷脂抗体综合征,肿瘤等继发性因素引起的膜性病变。所有患者均签署知情同意书,进行CT静脉成像和肺动脉成像。
一般资料采集患者病史,记录入选患者的年龄、性别,病程、以往激素用药史。临床表现重点观察有无腰痛,肉眼血尿,急性肾功能衰竭(ARF),有无胸痛、咯血、呼吸困难。体检重点观察双下肢水肿是否对称,测量双下肢周径是否对称。
实验室指标记录行CT检查前实验室检查结果: 24h尿蛋白定量、尿沉渣红细胞;Alb、血胆固醇、低密度脂蛋白、SCr;血红蛋白、血小板计数;肾小管功能检查。
凝血指标:凝血时间、纤维蛋白原、活化部分凝血活酶时间(APTT)、D二聚体,血浆抗凝血酶Ⅲ(AT-Ⅲ)(采用免疫速率比浊法定量检测)。
部分临床指标定义: 镜下血尿定义为尿沉渣红细胞计数>10 万/ml。 D二聚体>0.5 mg/L定义为阳性;AT-Ⅲ<25 mg/dl定义为缺乏。
CT血管成像所有患者均用西门子双源CT机(Somatom Definition)扫描。患者取仰卧位,扫描范围胸廓入口到至耻骨联合,层厚0.75 mm,重建间隔0.5 mm,采用非离子型对比剂优维显300 mg/ml,采用双筒高压注射器以4 ml/s于肘静脉注射,总量为80~100 ml。使用一次对比剂的同时行肺动脉、肾静脉及下腔静脉等多部位联合扫描,扫描结束后,在工作站上进行多平面重组(multiplanar reformation,MPR)等重建。24例患者行下肢深静脉压迫型超声检查。
血栓诊断标准RVT:双侧肾静脉或分支内,及临近下腔静脉腔内清晰出现完全或不完全低密度充盈缺损。PE:肺动脉内一支或多支分支出现完全或不完全低密度充盈缺损。所有病例均由两位影像学诊断专家独立阅片,以一致意见作为最后的诊断。血栓部位记录:不论单侧肺动脉或双侧PE均计录为PE;不论单侧RVT或双侧RVT均计录为RVT;单侧下肢DVT或双侧下肢DVT均计录为下肢DVT。
统计学方法数据采用SPSS13.0统计软件处理,计量资料中正态分布的数据以均数±标准差表示,组间比较采用t检验。非正态分布的数据用中位数表示,组间比较采用非参数秩和检验。计数资料以例数(百分率)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
100例膜性肾病患者进入本研究,其中男80例,女20例,年龄18~73岁,平均年龄38.8±17.2岁。36例(36%)患者共计发现血栓部位78处,平均每例患者2.2处。其中RVT 33例 (33%),仅3例血栓患者不伴有RVT;其他主要血栓部位为下腔静脉血栓19例(19%),PE 17例(17%)(表1)。
静脉血栓双侧RVT 9例(图1A);左肾RVT 18例,其中16例有左肾静脉主干栓塞(图1B),2例仅有左肾静脉分枝栓塞,右肾RVT 6例。下腔静脉血栓共19例,其中18例与RVT相连,2例下腔静脉血栓延伸至髂总静脉;生殖静脉血栓5例均伴有左RVT。RVT中仅5例(14.7%)患者(左侧RVT 2例,双肾RVT 2例,右肾RVT 1例)出现肾区胀痛。2例(5.9%)患者出现肉眼血尿(其中1例为左肾RVT,另1例为双肾RVT)。1例左肾RVT患者出现急性肾损伤,肾活检示急性肾小管坏死。压迫型超声检查发现下肢腘静脉血栓2例,其中1例同时伴有RVT,1例腘静脉血栓患者有下肢疼痛,患肢增粗。
肺动脉栓塞(PE) CT肺动脉造影示PE 17例,其中11例同时合并RVT和下腔静脉血栓;4例仅伴有RVT;1例合并腘静脉血栓;余1例经CT及超声检查未能发现RVT及下肢DVT。PE患者中9例(52.9%)有胸闷、呼吸困难等症状,其中仅4例(23.5%)出现胸痛、咯血、呼吸困难症状,血气分析提示有低氧血症,但未出现低血压。超声心动图检查未发现右室负荷过重及肺动脉高压。CT肺动脉造影示肺动脉主干内和近端分支有血栓栓塞(图1C)。余8例患者无肺栓塞的临床表现,仅CT肺动脉造影时发现肺动脉远端分支栓塞(图1D)。
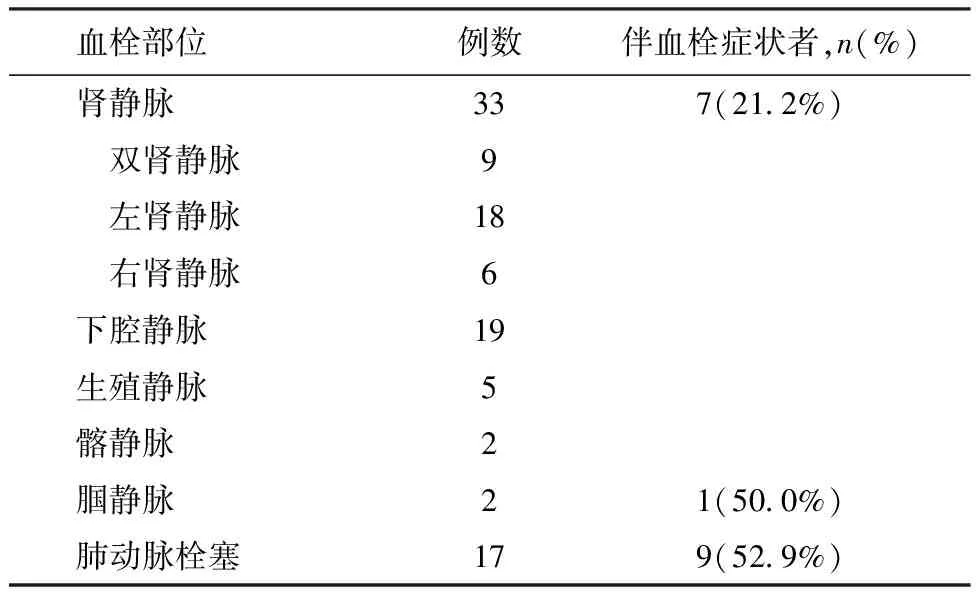
表1 膜性肾病静脉血栓血栓症发生部位及例数

图1 CT血管成像示肾静脉血栓和肺动脉栓塞
临床特点患者临床资料见表2,与无血栓组相比,血栓组患者年龄低于无血栓组,但并无统计学差异。两组性别、起病时间和肾脏病程也无明显差异。18例血栓发生于初冶病人(起病3月内),15例患者发生于起病3月后至1年以内,仅3例患者在起病1年后发现血栓。血栓组患者有19例(52.7%)、无血栓组有31例(48.4%)曾用激素治疗,两组患者激素使用时间与用量均无明显差异。血栓组两例女性,病程中曾出现肉眼血尿和明显腰痛,未发现继发性因素,经抗凝治疗后血栓消失。无血栓组无一例出现肉眼血尿,两组镜下血尿发生率无差别。血栓组尿蛋白定量高于无血栓组(P<0.05),而其他实验室指标如Alb、SCr、血脂、肾小管功能如N-乙酰-β-D-氨基葡萄糖苷酶(NAG酶),视黄醇结合蛋白(RBP)两组间无统计学差异。肾脏体积,有静脉血栓的左肾及右肾长径均大于无血栓患者,但并无统计学意义。双侧RVT与单侧RVT之间临床各项指标比较也未见差异。病理改变,血栓组两例患者在肾小球毛细血管袢腔有微血栓形成,其余患者病理改变与无血栓患者相比无明显差异。

表2 膜性肾病有无血栓栓塞症患者实验室检查结果比较
凝血指标患者的凝血功能指标见表3。静脉血栓组36例患者中有34例血清D二聚体阳性,仅2例检测阴性,其中1例患者为双肾静脉不完全血栓,1例为左肾静脉分支血栓,均不伴PE形成。而无血栓组患者行D二聚体检测,共15例患者阳性,血栓组患者D二聚体阳性率显著高于无血栓组(P<0.01)。D二聚体阳性预测值 (PPV) 69.4%,阴性预测值(NPV) 96.1%。血栓组血小板计数显著低于无血栓组(P<0.05),血栓组纤维蛋白原量低于无血栓组,但无统计学差异。两组中均有半数左右患者AT-Ⅲ水平下降并低于正常。其他指标如凝血时间、APTT,两组间均无明显差异。

表3 膜性肾病有无血栓栓塞症患者凝血相关指标比较
讨 论
VTE尤其是RVT,是膜性肾病患者常见的并发症之一。但有关膜性肾病RVT的研究多来自20世纪80年代,主要是通过有创的肾静脉造影观察患者RVT发生情况。以往研究报道RVT的发生率存在较大差异(29%~60%)[4-8]。因此,临床迫切需要进一步研究膜性肾病患者静脉血栓实际发生率。
长期以来,肾静脉血管造影被认为是诊断RVT的金标准,但肾静脉造影为有创性检查,并可能诱发PE[4],且使用对比剂用量大,易引起急性肾损伤。因此,目前已很少用于RVT的诊断。近年来,随着影像技术的发展,CT血管成像技术在临床应用,其敏感度与特异度不断提高。研究认为,采用CT肾静脉成像技术对NS患者肾静脉进行CT扫描,可明确诊断RVT[9]。Coche等[10]研究认为多源CT肺动脉成像诊断PE准确率高于肺通气-灌注扫描。因此,双源CT血管成像在临床上完全可替代选择性肾静脉造影和肺通气-灌注扫描来诊断RVT和PE[11]。为此,我们选择双源CT血管成像技术,采用非离子型对比剂以减少肾毒性。且一次注射对比剂后,同时行肺动脉和肾静脉、下腔静脉等多部位扫描,不但节约了时间,减少了对比剂的用量,同时能够获得多部位血管成像图像。本组100例患者均获得清晰的图像资料,且无一例患者出现对比剂相关肾损伤。
本研究100例膜性肾病患者中有36例(36%)发现VTE,其中以RVT(33%)发生率最高。Singhal等[1]荟萃分析了四项研究,共有108例膜性肾病患者,RVT发生率为37%,与本研究结果相近。RVT中以左侧RVT更为多见,这与左肾静脉明显长于右肾静脉,处于腹主动脉和肠系膜上动脉之间且易受压有关。腰痛、肉眼血尿和ARF为典型RVT的临床表现。但本研究中33例RVT患者中仅2例患者出现肉眼血尿和腰痛等急性RVT的症状。尽管有8例患者出现双侧RVT形成,但仅1例左侧RVT患者出现急性肾损伤症状,这可能与静脉血栓形成的快慢和侧枝循环形成有关。Llach等[5]一项前瞻性研究中,151例NS患者中有33例(22%)出现RVT,其中仅4例为急性RVT,有腰痛、肉眼血尿,ARF等症状。因此,膜性肾病慢性RVT形成较急性RVT更为常见,多数RVT患者临床并无症状,需引起重视。值得注意的是,本研究中 RVT常伴有其他部位的静脉血栓,RVT延伸至下腔静脉,生殖静脉,甚至髂静脉,出现多部位的静脉血栓。
肺动脉分枝栓塞可无症状,因此NS合并PE的发生率并不清楚。Llach等[5]对94例NS 患者行肺通气-灌注扫描结果发现,12例(12.8%)有通气-灌注不足。而另一项回顾性研究总结了89例NS(Alb<20 g/L)并行肺通气-灌注基于肺通气-灌注扫描异常和肺血管造影的结果,得出NS患者 PE 的发生率是 32%[12]。 而其他的一些前瞻性序列研究报告的NS合并PE发生率较低,可能是由于这些研究仅对有症状的、临床高度疑似患者进行肺扫描,这样就低估了NS患者PE的真实发病率。本研究中膜性肾病患者PE发生率达17%(17例),其中16例同时发现合并其他部位静脉血栓,仅1例患者未发现。此外,在CT证实半数PE患者并无胸痛、胸闷、呼吸困难等症状,如未行CT检查易造成漏诊。因此,临床医师必须高度重视膜性肾病并发PE,临床怀疑有VTE患者必须同时行肺动脉血管成像,以免漏诊而延误治疗。
D二聚体是体内发生凝血后,纤溶系统被激活并降解交联纤维蛋白形成的片断。血清D二聚体对急性血栓诊断的敏感度>90%,但特异度仅50%[13]。我们的研究也证实,D二聚体PPV为 69.4%,NPV为 96.1%。因此,尽管存在假阳性的情况,对D二聚体阳性的膜性肾病患者必须行肾静脉成像或血管超声检查,以明确是否存在静脉血栓。而对D二聚体阴性患者,VTE发生风险小,如临床未高度提示血栓形成,无需行进一步影像学检查,可临床观察。
膜性肾病RVT明显升高的原因并不清楚。NS患者大量蛋白尿、低蛋白血症导致大量小分子抗凝物质丢失,而肝脏合成代偿增强,大分子凝血因子增多,纤维蛋白原和血小板合成增加是导致血栓形成的主要原因[1,8]。既往临床研究认为,低蛋白血症与VET有关,Alb<25 g/L是发生VTE的一项危险因素[6]。本研究中,尽管血栓组尿蛋白定量明显高于无血栓患者,但血栓组患者Alb水平仅略低于无血栓组,两组间并无统计学差异,提示低白蛋白血症是静脉血栓形成的危险因素,但并非唯一因素。AT-Ⅲ是血液中重要的抗凝物质,NS由于大量蛋白尿,导致AT-Ⅲ从尿中丢失,血中AT-Ⅲ水平降低使患者处于高凝状态,可使静脉血栓发生风险增加3~7倍,有研究认为AT-Ⅲ缺乏率在NS中达40%~80%[14]。本研究中,膜性肾病伴血栓患者AT-Ⅲ水平下降率与无血栓组相比无统计学差异。汤曦等[15]研究也发现膜性肾病患者血AT-Ⅲ水平明显高于局灶节段肾小球硬化症患者,提示AT-Ⅲ水平可能并非导致膜性肾病 RVT发生的主要因素。另外,血栓患者的血小板计数明显低于无血栓患者,这可能与血栓形成时大量的血小板聚集与消耗,导致了血栓组患者血小板计数下降。本研究中,膜性肾病RVT的发生率明显高于其他部位血栓,也显著高于其他病理类型NS的RVT发生率[16]。因此,膜性肾病RVT的形成涉及多种因素,其具体机制仍待进一步研究。
至今为止,本研究是国内病例数最多的有关膜性肾病VTE的研究,但属横断面研究,可能会低估膜性肾病VTE发生的风险。因为部分无血栓的患者在今后随访中也可能会出现新的血栓并发症。另外,并非所有患者都行下肢静脉超声检查,可能低估了下肢DVT的发生率。即便如此,本研究的结果也对膜性肾病VTE的诊断与预防性抗凝治疗提供了重要的临床证据。
临床表现为NS的膜性肾病VTE发生率达36%,其中RVT 33%,PE 17%。多数患者临床并无典型血栓栓塞症状,D二聚体阳性率与血栓事件密切相关。因此,对临床表现为NS的的膜性肾病患者,临床医师必须保持高度警惕,常规监测D二聚体,必要时行CT肾静脉和肺动脉成像检查以及下肢血管超声检查,以确诊有无VTE。
1 Singhal R,Brimble KS.Thromboembolic complications in the nephritic syndrome: Pathophysiology and clinical management.Thromb Res,2006,118(3): 397-407.
2 Miniati M,Prediletto R,Formichi B,et al.Accuracy of clinical assessment in the diagnosis of pulmonary embolism.Am J Respir Crit Care Med,1999,159(3):864-871.
3 Gatewood OM,Fishman EK,Burrow CR,et al.Renal vein thrombosis in patients with nephrotic syndrome:CT diagnosis.Radiology,1986,159(1):117-122.
4 Wagoner RD,Stanson AW,Holley KE,et al.Renal vein thrombosis in idiopathic membranous nephropathy and nephritic syndrome:Incidence and significance.Kidney Int,1983,23:368-374.
5 Llach F,Papper S,Massry SG.The clinical spectrum of renal vein thrombosis:acute and chronic.Am J Med,1980,69(6):819-827.
6 Velasquez Forero F,Garcia Prugue N,Ruiz Morales N.Idiopathic nephrotic syndrome of the adult with asymptomatic thrombosis of the renal vein.Am J Nephrol,1988,8(6):457-462.
7 Chugh KS,Malik N,Uberoi HS,et al.Renal vein thrombosis in nephritic syndrome-a prospective study and review.Postgrad Med J,1981,57(671):566-570.
8 Llach F.Hypercoagulability,renal vein thrombosis,and other thrombotic complications of nephrotic syndrome.Kidney Int,1985,28(3):429-439.
9 Wei LQ,Rong ZK,Gui L,et al.CT diagnosis of renal vein thrombosis in nephrotic syndrome. J Comput Assist Tomogr,1991,15(3):454-457.
10 Coche E,Verschuren F,Keyeux A,et al.Diagnosis of acute pulmonary embolism in outpatients: comparison of thin-collimation multi-detector row spiral CT and planar ventilation-perfusion scintigraphy.Radiology,2003,229(3):757-765.
11 Stein PD,Fowler SE,Goodman LR,et al.Multidetector computed tomography for acute pulmonary embolism.N Engl J Med,2006,354(22):2317-2327.
12 Chemg SC,Huang WS,Wang YF,et al.The role of lung scintigraphy in the diagnosis of nephrotic syndrome with pulmonary embolism.Clin Nucl Med,2000,25(3):167-172.
13 Stein PD,Hull RD,Patel KC,et al.D-dimer for the exclusion of acute venous thrombosis and pulmonary embolism:a systematic review.Ann Intern Med,2004,140(8):589-602.
14 Kauffmann RH,Velgkamp JJ,Van Tilburg NH,et al.Acuqired antithrombin Ⅲ deficiency and thro,bosis in the nephrotic syndrome.Am J Med,1978,65(4):607-613.
15 汤 曦,王旭方,张丽华,等.NS患者血浆抗凝血酶III检测及其临床意义.肾脏病与透析肾移植杂志,2010,19(5):407-412.
16 张 炯,张庆燕,李世军,等.肾病综合征合并血栓栓塞症的临床特点分析.肾脏病与透析肾移植杂志,2010,19(5):401-405.

