酸牦牛乳中乳酸菌降胆固醇作用及胆盐耐受性研究
焦月华,张兰威,易华西,张莉丽,马 微
(1.哈尔滨工业大学食品科学与工程学院,哈尔滨 150090;2.黑龙江中医药大学药物安全性评价中心,哈尔滨 150040;3.黑龙江出入境检验检疫局,哈尔滨 150001)
胆固醇是人体不可缺少的营养成分,但胆固醇过高或过低都会影响人的身体健康,尤其是高胆固醇,是引发人脑血管疾病的主要危险因子之一。目前研究表明,一些人体内乳酸菌及来自发酵食品的乳酸菌具有降胆固醇功能[1-3]。张佳程、薄金岭、吕兵等分别研究了一些乳酸菌可降低食物中胆固醇含量[4-6],并从不同的食品中筛选出一些具有较好降胆固醇作用的菌株。Pereira研究了分离自人体肠道中的乳酸菌和双歧杆菌的胆固醇同化能力[1]。El-Gawad用饲喂高脂饲料的大鼠证实了酸奶和发酵豆奶中的双歧杆菌的对胆固醇血症的作用[2]。在这些研究中,乳杆菌和双歧杆菌表现出了明显的降低胆固醇的能力。前人在乳酸菌降胆固醇的研究方面做了大量工作,以期获得优良适合作为益生菌的菌株。因此,本研究以分离于甘肃的酸牦牛奶中的23株乳酸菌为研究对象,拟对不同菌株的体外同化胆固醇效果进行测定,以期筛选出具有较好降胆固醇特性的益生菌菌株应用于实践。
1 材料与方法
1.1 材料与设备
1.1.1 菌种
23株供试乳酸菌从采样于甘肃牧民家庭制作的酸牦牛奶中分离得到;嗜酸乳杆菌(Ac)由科汉森发酵剂分离得到,本实验室保存。
1.1.2 试剂与培养基
牛胆汁(OXGALL)、胆酸、牛磺脱氧胆酸钠(TDCA)、甘胆酸钠(TCA)(SIGMA 公司)、胆固醇,所用试剂均为分析纯或优级纯。所用培养基均是按照凌代文等的方法配制[7]。
胆固醇浓缩液[8]:N,N-二甲基甲酰胺10 mL,0.5 mL吐温80,胆固醇0.5 g,充分混合后121℃灭菌20 min。
胆固醇标准液[9]:用正己烷定容配制1 mg·mL-1的胆固醇标准液。
邻苯二甲醛冰醋酸溶液(0.5 g·L-1)[10]:0.250 g邻苯二甲醛,用冰醋酸定容于500 mL的容量瓶中,使用当天配制。
1.1.3 主要仪器设备
TGL-16LG高速冷冻离心机(湖南星科),756PC型紫外可见分光光度计(上海光谱),DHP9272电热恒温培养箱(上海一恒),pH计(德国赛多利斯PB-10),厌氧培养箱(美国THERMO Forma 1029),超净工作台(苏州安泰SW-CJ-IFO)。
1.2 方法
1.2.1 菌株的培养
乳酸菌在传代培养、活化后,用MRST[11]液体培养基37℃培养20 h。
1.2.2 乳酸菌菌株去除胆固醇的实验
将已灭菌的胆固醇浓缩液分别加入MRST培养基和MRST-O(MRST培养基中添加0.3%的牛胆汁)培养基使其浓度达到100 μg·mL-1,1%接种目的菌,37℃培养20 h。然后将菌液在4℃,5 200×g条件下离心10 min[11]。取1.0 mL上清液,用邻苯二甲醛法测定胆固醇的量[12],根据标准曲线计算样品中胆固醇含量。
胆固醇同化量[10(]mg·g-1)=
C1、C2分别是0 h时和20 h时的胆固醇含量(mg);
W1、W2分别是0 h时和20 h时的菌体干重(g)。
1.2.3 死亡菌体的降胆固醇试验
菌株经MRST培养基37℃培养20 h后于1 000×g,4℃离心10 min。灭菌水洗涤2次,用5 mL灭菌水悬浮,121℃灭菌15 min,制备热致死菌体。将热致死菌体加入到含有0.3%(W/V)牛胆汁和胆固醇的培养基中。同时,对热致死菌体进行平板计数,以确定灭菌效果。37℃培养20 h后,测量培养液中胆固醇的含量[13]:
A=100-[100-(B/C)×100]
其中,A-胆固醇降低率(%);
B-接种目的菌的培养液中胆固醇含量(mg);
C-没有接种目的菌的培养液中的胆固醇含量(mg)。
1.2.4 胆盐水解活性的测定
用灭菌的滤纸片沾取培养过夜的受试菌株(1×108~1×109cfu·mL-1)加入到添加 0.5%TDCA(W/V)和0.37 g·L-1CaCl2的固体培养基中,37℃厌氧培养72 h,有沉淀区形成则认为有胆盐水解活性(BSH阳性)[14]。用不加TDCA的培养基作对照,每株菌重复3次。
1.2.5 胆盐耐受性
参照文献[10]的方法,使用三种形式的胆盐:牛胆汁、胆酸、甘胆酸钠来测试各菌株的胆盐耐受性。
1.2.6 统计与分析
采用SPSS11.0软件ANOVA对试验数据进行方差分析,差异显著性比较,平均数用LSD进行多重比较。
2 结果与分析
2.1 胆固醇含量与吸光值关系曲线
胆固醇含量与吸光值关系结果见图1。
得到一元回归方程:y=0.1946x+0.0016(R2=0.9994)
其中,y代表胆固醇含量,x代表吸光值,R2=0.9994线性关系良好,说明该方法有着较高的准确度,适合用来测定胆固醇的含量。
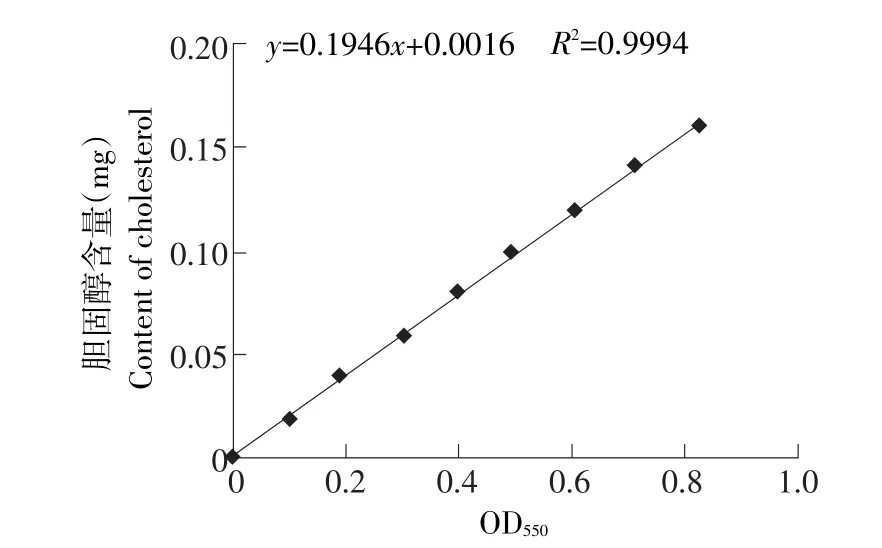
图1 胆固醇含量标准曲线Fig.1 Standard curve about the amount of cholesterol
2.2 牛胆汁对菌株降低胆固醇的影响
在不同pH条件下,所用牛胆汁对培养基中胆固醇的含量影响(见表1)不显著(P>0.05),说明培养基中加入的牛胆汁所含的游离的胆酸盐含量极低或者不含有游离胆酸,培养基中的胆固醇并没有在酸性条件下与游离胆酸共沉淀。该结论说明下述试验中胆固醇减少的量是由于菌株同化作用,而非pH影响。
表1 不同pH对培养基中胆固醇含量的影响(±S,n=3)Table 1 Effect of pH on the content of cholesterol in media

表1 不同pH对培养基中胆固醇含量的影响(±S,n=3)Table 1 Effect of pH on the content of cholesterol in media
注:中同列数据肩注标有相同字母者表示差异不显著(P>0.05)。Note:Means with the same superscripts in the same column differ insig nificantly(P>0.05).
MRSTO-C培养基MRSTO-C media pH4.5 pH6.0胆固醇含量(μg)Content of cholesterol 98.94±1.45a 99.56±2.04a
由酸牦牛乳中分离的23株乳酸菌以及嗜酸乳杆菌(Ac)培养20 h后同化胆固醇的量见表2。
结果表明,所有的菌株都具有一定降低胆固醇的能力,每克菌体干重减少的胆固醇量在0.58~10.537 mg。在23株菌中,除832在两种培养基中同化胆固醇量差异不大外,J9、I10、H11、E16、L18、67、271和AC这8株菌在添加牛胆汁时同化胆固醇量高于未添加牛胆汁的对照组,其余14株菌则与此相反。一般来说,适当增加胆盐浓度可以提高菌体细胞壁的通透性,使固醇类物质渗入细胞内部,引起环境中胆固醇浓度下降;而胆盐浓度过高,则抑制细菌的生长,不利于菌体细胞对胆固醇的吸收[1]。Liong等的研究中11株嗜酸乳杆菌和干酪乳杆菌在0.3%存在时8株菌同化胆固醇的量高于对照组,只有3株菌对照组中的量较高[10]。
Dora对19株菌培养12 h后,除Lactobacillus crispatus ATCC 33820和Enterococcus durans ATCC 59607没有在培养基中生长外[11],其他菌株每克菌体干重对胆固醇的同化量为0.09~29.73 mg,大多数在添加0.4%牛胆汁的培养基中培养的菌株同化胆固醇得量高于对照组。
上述两个结论均是多数菌在添加牛胆汁培养基中在同化胆固醇量高于对照组,在本研究中却表现为少数菌,是因为牛胆汁对菌株降低胆固醇的影响具有菌株特异性。特异性可能与菌种来源、生长条件有关,此次试验所用菌种并非来源于人体肠道(胆盐水平为0.3%~0.5%),也没有经过牛胆汁的驯化,故0.3%牛胆汁对多数受试菌的生长有较大影响。
通过显著性分析可知,W2在两种培养基中没克菌体干重同化胆固醇的量分别为10.537和9.460 mg,都显著高于其他菌株,在不加牛胆汁的培养基中,每克菌体干重降胆固醇能力强弱依次:W2>H1>J2>G17>H11>A6>M12>E5>67>AC,在加牛胆汁的培养基中,每克菌体干重降胆固醇能力强弱依次:W2>AC>H11>271>67>J2>A6>J9>E16>411>I10。
2.3 死亡菌体的降胆固醇作用
为了探究死亡的菌体细胞是否具有同化胆固醇的能力,热致死菌体与正常菌体细胞对胆固醇的同化率对比见图2。
表2 不同菌株降胆固醇能力及牛胆汁对其影响(±SD,n=3)Table 2 Cholesterol removal ability of different strains and the the effect of oxgall on it

表2 不同菌株降胆固醇能力及牛胆汁对其影响(±SD,n=3)Table 2 Cholesterol removal ability of different strains and the the effect of oxgall on it
注:#为0 h与20 h时MRST培养基中生长的菌体干重之差(g)。※为20 h时受试菌上清液在550 nm波长处的吸光值与不接种的空白培养基吸光值之差。△将※中的值代入方程y=0.196x+0.0016计算降低的胆固醇量(mg)。★同一列标注不同字母表示差异显著(P<0.05)。note:#indicates the differential dry weight of the strain grown for 0 h and 20 h in MRST media.※indicates the difference value of OD550 is the result value of the subtraction of the media without innoculant from the supernate of the strains grown for 20 h.△indicates the results come from the equation y=0.196x+0.0016 when※ instead of x.★ means with different superscripts in succession differ significantly(P<0.05).
测定值(MRST)Measured value 测定值(MRSTO)Measured value 菌体同化胆固醇结果★(mg·g-1)Results of cholesterol removal菌株Strains MRST MRSTO H1 J2 F3 E4 E5 A6 C7 J9 I10 H11 M12 N13 B14 D15 E16 G17 L18 67 271 411 832 Q9 W2 AC菌体干重增量#(g)Increased dry weight 0.0045 0.0026 0.0090 0.0066 0.0035 0.0032 0.0124 0.0102 0.0076 0.0019 0.0088 0.0057 0.0066 0.0031 0.0150 0.0039 0.0119 0.0024 0.0024 0.0028 0.0066 0.0074 0.0086 0.0118 OD550增量※Increased value of OD550-0.070-0.032-0.047-0.002-0.015-0.024-0.047-0.041-0.032-0.015-0.055-0.013-0.010-0.011-0.064-0.047-0.004-0.007-0.004-0.025-0.024-0.016-0.147-0.064同化胆固醇量△(mg)Content of cholesterol assimilation 0.0457 0.0235 0.0322 0.0060 0.0136 0.0188 0.0322 0.0287 0.0235 0.0136 0.0369 0.0124 0.0106 0.0112 0.0422 0.0322 0.0071 0.0089 0.0071 0.0194 0.0188 0.0141 0.0906 0.0422菌体干重增重#(g)Increased dry weight 0.0087 0.0028 0.0028 0.0133 0.0033 0.0021 0.0116 0.0067 0.0049 0.0028 0.0161 0.0090 0.0144 0.0069 0.0089 0.0032 0.016 0.0019 0.0022 0.0125 0.0055 0.0089 0.006 0.0031 OD550增量※Increased value of OD550-0.032-0.027-0.003-0.005-0.002-0.009-0.009-0.045-0.023-0.034-0.013-0.02-0.009-0.023-0.062-0.006-0.050-0.020-0.024-0.084-0.019-0.002-0.089-0.041同化胆固醇量△(mg)Content of cholesterol assimilation 0.0235 0.0206 0.0066 0.0077 0.0060 0.0101 0.0101 0.0311 0.0182 0.0246 0.0124 0.0165 0.0101 0.0182 0.0410 0.0083 0.0340 0.0165 0.0188 0.0538 0.0159 0.0060 0.0568 0.0287 10.148±0.741a 9.031±0.093b 3.582±0.270fg 0.904±0.088k 3.873±0.231f 5.879±1.156e 2.600±0.354ghi 2.810±0.059 ghi 3.090±1.163 hi 7.135±0.216d 4.194±0.208f 2.174±0.231i 1.612±0.079j 3.620±0.085fg 2.811±0.078hi 8.266±1.095c 0.600±0.141k 3.703±0.073fg 2.973±1.090 ghi 6.927±0.100d 2.850±1.090hi 1.911±0.073i 10.537±2.514a 3.573±0.149fg 2.699±0.213d 7.344±0.597b 2.340±1.170d 0.580±0.014e 1.808±1.076de 4.788±1.221c 0.867±0.139e 4.637±1.071c 3.720±0.673c 8.803±1.380ae 0.770±0.120e 1.831±0.305de 0.698±0.069e 2.642±1.182d 4.606±1.349c 2.595±1.074d 2.124±1.441de 8.672±2.172b 8.551±1.304b 4.307±0.288c 2.889±0.135c 0.671±0.091e 9.460±1.170a 9.270±1.309a

图2 热致死菌体对胆固醇的同化能力Fig.2 Cholesterol assimilation of strains heat killed
通过平板计数,证实菌株在121℃15 min高压灭菌后,已全部死亡。热致死菌体对胆固醇的同化率在0.3%~17.1%之间,正常菌体细胞对胆固醇的同化率在2%~70%范围内,乳酸菌的活菌对同化胆固醇的能力显著强于热致死菌体,Liong[10]及Kimoto等的试验表明乳酸菌的活菌体同化的胆固醇的能力显著高于热致死菌体及休眠菌体[14],与本试验结果一致,说明菌体可以代谢胆固醇[15],菌体细胞对胆固醇的同化吸收在胆固醇的去除中起主要作用。
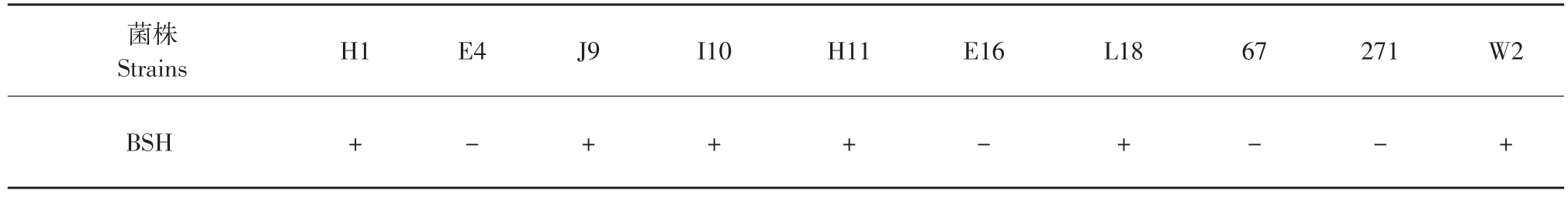
表3 不同菌株的胆盐水解活性Table 3 Bile salt hydrolase activity of different strains
2.4 胆盐水解酶活性与胆盐耐受性
综合考虑菌种同化胆固醇的能力及对抑制肠道病原菌的抑制效果(数据未列出)我们选择H1、H11、E16、L18、W2、E4、J9、I10、67和271进行胆盐水解酶活性试验及胆盐耐受性试验。胆盐水解酶活性是胆固醇降低的关键因素。乳酸菌产生的胆盐水解酶(Bile salt hydrolase,BSH)可以使结合态胆酸(盐)分解为游离胆酸。胆盐经水解后溶解度下降,从而致使胆固醇也一同沉淀下来(因胆固醇的溶解度取决于胆盐的溶解度);胆盐水解酶作用后产生的解离态的胆酸在大肠内不被重复吸收而由粪便排出,胆酸的排出导致其在肠肝系统循环次数减少,从而增加了胆酸的生物合成。添加0.5%(W/V)牛磺脱氧胆酸钠(TDCA)和0.37 g·L-1CaCl2的固体培养基上测试这10株菌的BSH活性,其中H1、J9、I10、H11、L18和W2菌的纸片周围产生了明显的沉淀圈,证明其BSH阳性。但是,沉淀圈直径均小于15 mm,说明其酶活性较低。
牛胆汁、胆酸、TCA对受试菌生长的影响结果见表4。
表4 不同菌株对不同胆盐的耐受性的影响(±S,n=2)Table 4 Effect of different bile salt tolerance on different strains
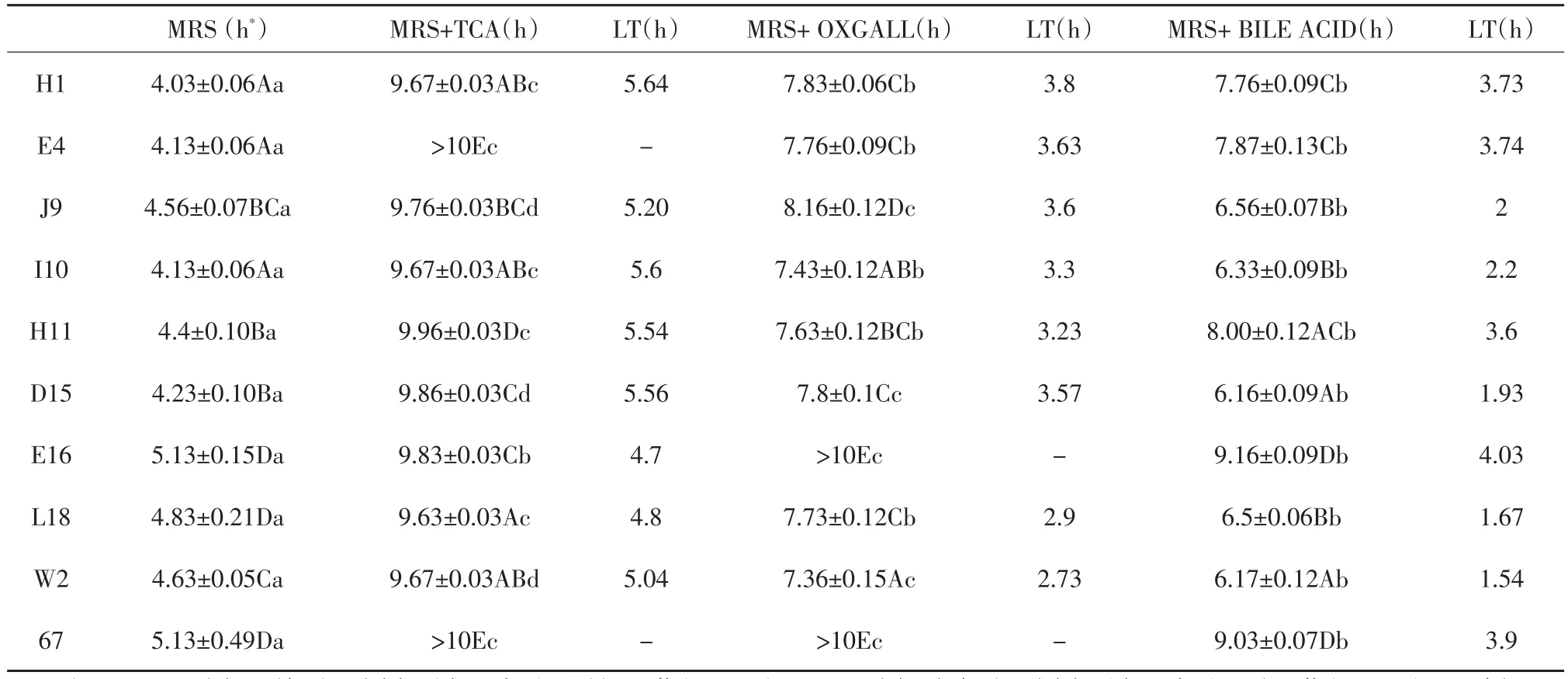
表4 不同菌株对不同胆盐的耐受性的影响(±S,n=2)Table 4 Effect of different bile salt tolerance on different strains
注:ABCD:同一列标注不同大写字母表示差异极显著(P<0.01);abcd:同一行标注不同小写字母表示差异显著(P<0.05);*波长620 nm吸光值增长0.3的单位所用的时间(h)。Note:ABCD Means in the same row followed by different lowercase letters are significant extremely difference(P<0.01);abcd Means in the same column followed by different uppercase letters are significantly different(P<0.05);*Time(h)required to increase by 0.3 absorbance units at 620 nm in each medium.
H1 E4 J9 I10 H11 D15 E16 L18 W2 67 MRS(h*)4.03±0.06Aa 4.13±0.06Aa 4.56±0.07BCa 4.13±0.06Aa 4.4±0.10Ba 4.23±0.10Ba 5.13±0.15Da 4.83±0.21Da 4.63±0.05Ca 5.13±0.49Da MRS+TCA(h)9.67±0.03ABc>10Ec 9.76±0.03BCd 9.67±0.03ABc 9.96±0.03Dc 9.86±0.03Cd 9.83±0.03Cb 9.63±0.03Ac 9.67±0.03ABd>10Ec LT(h)5.64-5.20 5.6 5.54 5.56 4.7 4.8 5.04-MRS+OXGALL(h)7.83±0.06Cb 7.76±0.09Cb 8.16±0.12Dc 7.43±0.12ABb 7.63±0.12BCb 7.8±0.1Cc>10Ec 7.73±0.12Cb 7.36±0.15Ac>10Ec LT(h)3.8 3.63 3.6 3.3 3.23 3.57-2.9 2.73-MRS+BILE ACID(h)7.76±0.09Cb 7.87±0.13Cb 6.56±0.07Bb 6.33±0.09Bb 8.00±0.12ACb 6.16±0.09Ab 9.16±0.09Db 6.5±0.06Bb 6.17±0.12Ab 9.03±0.07Db LT(h)3.73 3.74 2 2.2 3.6 1.93 4.03 1.67 1.54 3.9
培养基中添加各胆酸盐后,测量观察各培养基pH随培养时间的变化。pH降低最多的是在添加牛胆汁培养基中培养的W2(1.16)。尽管添加胆酸的一组初始pH最低,但是pH降低的平均值最大的一组是添加牛胆汁组(4.76),添加TCA的一组pH降低的最少(2.88)。这些发现表明,添加不同胆酸盐的培养基的初始pH对随后的菌种的生长、胆盐耐受性及与pH相关的胆盐抑制效果的影响是很小的。所有菌种在不含胆酸盐的培养基中生长的更好;相对于含牛胆汁的培养基,大多数菌种在含胆酸的培养基中生长的更快一些,在含TCA的培养基中生长的更慢一些。
在对0.3%的胆酸,0.3%的牛胆汁及0.3%的牛磺胆酸钠的耐受能力比较分析得出,各种形式的胆酸盐均对乳酸菌的生长有抑制作用,抑制顺序由强到弱依次为:TCA>BILE ACID>OXGALL。
由表4中各菌种的延时时间(LT)可见,E16和L18耐TCA能力最强,E4和67对TCA更为敏感;对牛胆汁的耐受性则是W2、L18较强,E16和67较弱;对胆酸而言,不同菌株对胆酸的耐受性差异很大,延时时间在1.54(W2)~4.03(E16)之间变化。胆盐耐受力是益生菌的重要特征之一,其耐受力高低意味着该菌株在肠道中的存活能力的强弱。而通过比较表4和表1发现,菌株对胆盐的耐受能力与降低胆固醇能力没有直接相关性。综合对比表1、3和4,筛选出具有较好益生特性的菌株H1、I10和W2。
3 讨论
本研究证实了牛胆汁的确能够促进乳酸菌对胆固醇的降解率[1],但是也有部分菌株在不添加牛胆汁的的情况下也能降低胆固醇,这可能与细菌产胞外多糖的能力有关,因为Tok等发现L.delbrueckiissp Bulgaricus降低培养基中的胆固醇的能力与细菌产胞外多糖的能力成正相关[16]。他们推测培养基中胆固醇的减少可能是由细菌的胞外多糖对培养基中的胆固醇产生了黏附。
另外本研究还发现很多菌株的活体细胞比热致死细胞降低胆固醇的能力更强,与Liong[10]及Kimoto等[14]的结论一致,这说明细菌除了可以通过共沉淀方式脱除培养基中的胆固醇外,同化吸收发挥了更为重要的作用,同化吸收中细胞壁的吸附作用、细胞膜的吸收作用、细胞质的积累作用还是以上三种方式的共同起作用还有待进一步的研究。
目前,心脑血管疾病已成为我国居民死亡了主要因素[17],而高血清胆固醇水平是造成心脑血管疾病的重要因素之一,因此具有降胆固醇功能的益生菌也就制剂将越来越受到人们的青睐。因此本研究通过科学的实验方法,筛选出在体外具有胆盐耐受性的降解胆固醇特性的潜在益生菌株,在进行进一步研究后将有选择的用于生产实践,造福人类,从而发挥它们良好的发酵特性和益生作用。
4 结论
经过研究发现活的菌体细胞对胆固醇的同化吸收在降低胆固醇中起主要作用。菌株的耐胆盐能力与降低胆固醇能力没有直接相关性。通过对降胆固醇、BSH及对各种胆盐的耐受性综合比较选出H1、I10、W2三株菌,可以作为降低人体血清胆固醇水平的候选菌株,应用于发酵食品或其他微生态制剂。
[1]Pereira D I A,Gibson G R.Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut[J].Appl Enviro Microbiol,2002,68:4689-4693.
[2]El-Gawad I.A.A.et al.The hypocholesterolaemic effect of milk yoghurt and soy-yoghurt containing bifidobacteria in rats fed on a cholesterol-enriched diet[J].International Dairy Journal,2005,15:37-44.
[3]王欣,刘飞,霍贵成.传统乳制品中嗜酸乳杆菌的生理特性研究[J].东北农业大学学报,2008,39(9):87-92.
[4]张佳程,骆承庠.乳酸菌对食品中胆固醇脱除作用的研究-乳酸菌菌种(株)的筛选[J].食品科学,1998,19(3):20-22.
[5]薄金岭,沙淼.高效同化胆固醇乳酸菌菌株的筛选及在食品中的应用[J].中国乳品工业,2004,32(4):31-33.
[6]吕兵,夏文水,张国农.分离自Kefir的植物乳杆菌体外降胆固醇作用的研究[J].中国乳品工业,2004,32(4):3-5.
[7]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:85-86.
[8]王成涛,牛天贵,郭三堆.构建高效降解胆固醇的融合乳酸菌的研究-原生质体融合及融合子的筛选[J].生物技术通报,2002(2):42-46.
[9]肖琳琳,董明盛.西藏干酪乳酸菌降胆固醇特性研究[J].食品科学,2003,24(10):142-145.
[10]Liong M T,Shah N P.Acid and bile tolerance and cholesterol removal ability of lactobacilli strains[J].Journal of Dairy Science,2005,88:55-66.
[11]Pereira D A,Gibson G R.Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human guts[J].Applied and Environmental Microbiology,2002,68:4689-4693.
[12]Rudel L L,Morris M D.Determination of cholesterol using o-phthalaldehyde[J].Journal of Lipid Research,1973,14:364-366.
[13]Usman,Hosono A.Bile tolerance,taurocholate deconjugation,and binding of cholesterol by Lactobacillus gasseri Strains[J].Journal of Dairy Science,1999,82:243-248.
[14]Kimoto H,Ohmomo S,Okamoto T.Cholesterol removal from media by Lactococci[J].Journal of Dairy Science,2002,85:3182-3188.
[15]袁肖寒,高学军.嗜热链球菌超浓缩培养过程中菌体生化代谢规律研究[J].东北农业大学学报,2005,36(5):621-624.
[16]Tok E,Aslim B.Cholesterol removal by some lactic acid bacteria that can be used as probiotic[J].Microbiology and Immunology,2010,54(5):257-264.
[17]He J,Gu D,Wu X.Major causes of death among men and women in China[J].The New England Journal of Medicine,2005,353(11):1124-1134.

