利用阳离子交换树脂对黄豆酱多肽脱盐作用的研究
关晴 ,阮长青 ,2
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.农业部农产品加工质量监督检验测试中心)
黄豆酱是我国传统的发酵豆制品之一,黄豆酱亦称大豆酱,豆酱,是以大豆和面粉为主要原料,通过微生物发酵酿制而成的一种半流动状态的调味品[1]。大豆和面粉经曲霉,酵母菌,乳酸菌等菌种产生的复合酶系分解,产生朊,胨,多肽,氨基酸,葡萄糖,果糖,乳酸,醋酸等物质使黄豆酱具有较高的营养和独特的风味[2]。大豆发酵食品中的生理功能性物质,可分为两大类,一类是大豆原料中固有的,如大豆蛋白质、消化酶、维生素、亚油酸、皂角甙、异黄酮、胆碱、胰蛋白酶抑制物等。另一类则是在发酵、加工过程中产生的,类黑精褐色色素、肽类等[3]。近年来,大豆发酵食品中的低聚肽因具有较高的生物活性而备受关注。Esaki等[4]报告了日本大豆发酵制品中存在抗氧化物质。韩国黄豆酱中也相继发现了ACE抑制肽[5],呈鲜味的寡肽[6]。
经水法提取的黄豆酱多肽溶液含盐量较高,不利于后期肽的分离,应予以去除。生物活性物质脱盐的方法有超滤、纳滤、电渗析、树脂吸附法等,但采用电渗析或超滤、纳滤技术处理会造成一些低肽分子的损失,影响回收率[7-8]。大孔吸附树脂和离子树脂可根据分离物分子量大小及极性不同进行分离,同时具有吸附、筛选的功能,其吸附特性与天然吸附剂特性相同[8-9]。张鹏采用阴阳离子交换树脂对大豆蛋白肽脱盐后蛋白回收率为88.2%,脱盐率为90.3%[10]。张宇昊等对花生短肽脱盐工艺进行了研究,结果显示阴阳离子混合床脱盐法效果最优[11]。试验对黄豆酱多肽溶液脱盐过程中树脂的选择、脱盐工艺条件进行研究,旨在获得最大的脱盐率和肽回收率,为后期的肽的脱色、分离、生物活性评价、一级结构鉴定提供基础。
1 材料与方法
1.1 材料
黄豆酱,黑龙江省宝泉酱业有限公司;D311树脂、201×7树脂、D301R树脂、D315树脂购于安徽省三星树脂科技有限公司;001×7树脂、D209树脂购于山东淄博东大树脂有限公司;AB-8树脂、ADS-7树脂、D152树脂购于沧州宝恩吸附材料科技有限公司;DA201-C树脂购于江西市有机化工厂。
1.2 主要仪器
QSY凯氏定氮仪(北京强盛分析仪器制造中心),Z型层析柱φ2.6 cm×40 cm(上海精科实业有限公司),HD-3紫外检测器(上海沪西分析仪器有限公司),DBS-100电脑全自动部分收集器(上海沪西分析仪器厂),SG3电导率仪(梅特勒-托利多仪器(上海)有限公司)。
1.3 试验方法
1.3.1 黄豆酱多肽的制备
称取一定质量混匀的黄豆酱,按比例加入蒸馏水,捣碎混匀,65℃水浴加热条件下提取后离心过滤,滤液用10 kDa的超滤膜包过滤,取10 kDa以下溶液冷冻干燥成粉末后备用。
1.3.2 肽含量及盐含量的测定
肽含量的测定采用GB22492-2008的方法[12],并做适当修改。操作过程如下:取40 mL滤液,加50 mL三氯乙酸,混匀并静止5 min,去除初滤液,滤液作为备用液。吸取25 mL滤液移入凯氏定氮管中,加入0.2 g硫酸铜,6 g硫酸钾及20 mL硫酸,放在数控消化炉上消化3 h。待消化液冷却后,用凯式定氮仪进行蒸馏,接收瓶中加入50 mL硼酸,蒸馏5 min,取下接收瓶,用标准盐酸滴定至蓝紫色为终点,计算酸溶性蛋白含量。氨基酸含量的测定[13]:取5.0 mL样品,定容至100 mL,吸取20.0 mL置于烧杯中,加水60 mL,开动磁力搅拌器,用0.05 mol·L-1氢氧化钠滴定至pH为8.2。加入10.0 mL甲醛溶液,混匀,再用0.05 mol·L-1氢氧化钠溶液继续滴定至pH=9.2,记下消耗氢氧化钠标准溶液的量,并计算氨基酸的含量。肽的含量为酸溶性蛋白减去氨基酸含量。
盐含量的测定采用GB/T 5009.39-2003[14],并做适当修改。操作过程如下:吸取2 mL试样于150 mL锥形瓶中,加100 mL去离子水及1 mL铬酸钾溶液(3.88 mol·L-1),混匀。用硝酸银标准溶液(0.1 mol·mL-1)滴定至初现橘红色,计算样液中盐含量。
1.3.3 静态吸附法筛选树脂
在250 mL具塞锥形瓶中加入5 mL处理好的湿树脂,向锥形瓶中加入50 mL浓度为4 mg·mL-1的黄豆酱多肽原液,将锥形瓶放入25℃恒温摇床中以120 r·min-1振荡 4 h,过滤,测定滤液的盐含量、多肽含量。
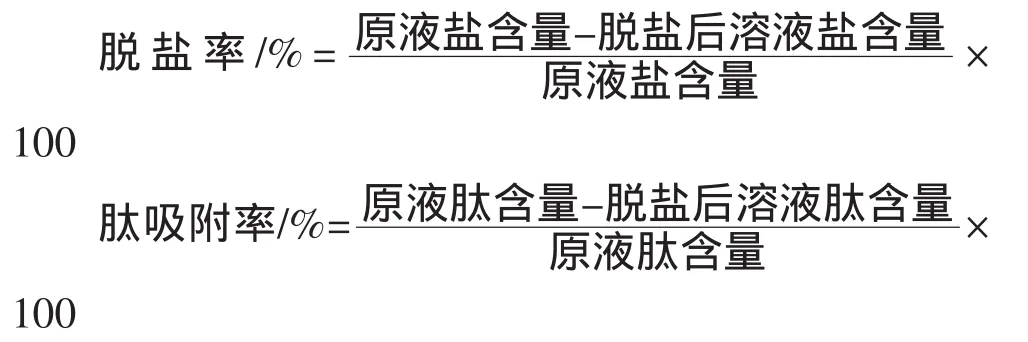
1.3.4 洗脱剂的选择
经测定,黄豆酱多肽原液的pH为4.7~5.0,由于弱酸性物质在酸性下吸附,在碱性下洗脱[15],应将洗脱液调节为弱碱性。分别选取0%、10%、30%、50%、70%、90%乙醇溶液,用1 mol·L-1NaOH调节溶液pH为8,按1∶10的比例加入饱和树脂和解析液于具塞三角瓶中,在恒温摇床中以25℃120 r·min-1振荡4 h进行解析,测定不同浓度乙醇的解析率。

1.3.5 树脂的动态吸附和解析
将处理好的树脂装入φ2.6 cm×40 cm的层析柱中,在室温下清洗0.5 h。将浓度为4 mg·mL-1的多肽溶液60 mL上柱,在220 nm的紫外吸光度下检测,先用去离子水洗涤层析柱,每10 mL收集一管,测定流出液的盐含量和肽含量。待流出液的电导率恒定后,用一定浓度的乙醇溶液进行洗脱,收集洗脱液并测定肽含量。
1.3.6 最佳样品浓度的确定
取黄豆酱多肽粉末,配置成 1、2、4、6 mg·mL-1的浓度进行上样,使用去离子水进行洗涤,待电导率恒定后,进行洗脱,测定多肽回收率[9]以便确定最佳进样浓度。

1.3.7 最佳流速的确定
洗脱时,将恒流泵的流速调节至20、30、40、50 r·min-1,测定洗脱液多肽回收率以选择最佳流速。
2 结果与分析
2.1 静态吸附法筛选树脂
不同树脂对黄豆酱多肽原液的脱盐率和肽吸附率如表1。
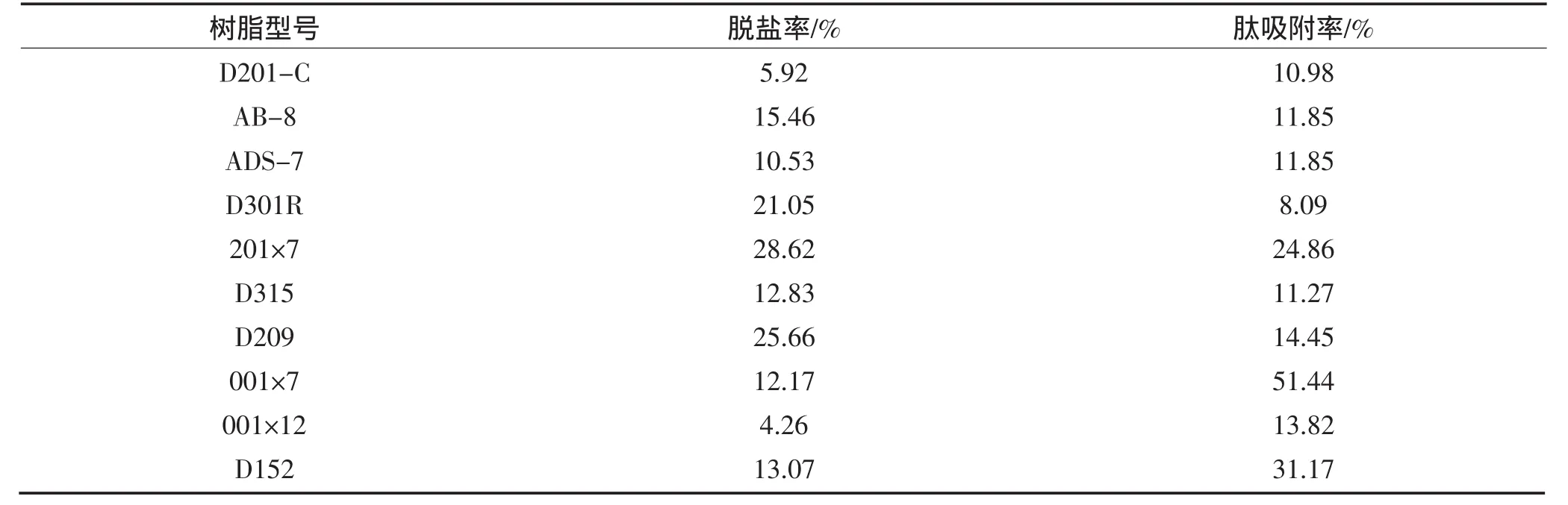
表1 不同树脂对黄豆酱多肽的吸附性能Table 1 Adsorption behavior of soybean paste peptide on the adsorbed resins
溶液中离子种类、离子强度、溶液pH决定了目的物与离子交换剂的结合能力[6]。从表1中看出,阳离子交换树脂001×7肽吸附率最高达到51.45%,脱盐率为12.17%。黄豆酱多肽溶液为弱酸性,应在酸性条件下被吸附,所以选择强酸性苯乙烯系阳离子交换树脂001×7进行下一步试验。
2.2 洗脱剂的选择
将已吸附饱和的树脂进行静态洗脱,测定洗脱液肽含量和盐含量,结果如表2。
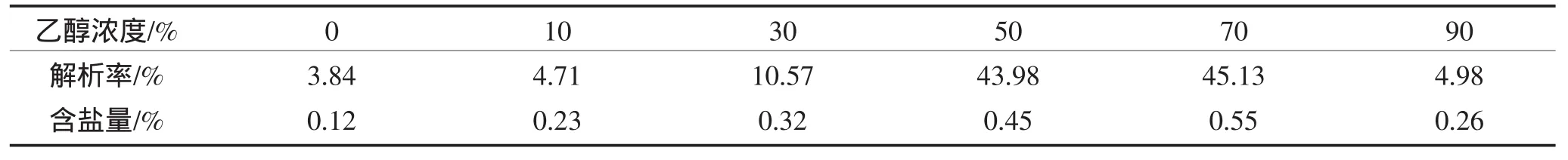
表2 不同解析剂对黄豆酱多肽的解析效果Table 2 Effect of different eluents on desorbing soybean paste peptide from 001×7 cation exchange resin
由于分子间吸附力较弱,洗脱比较容易,最常用的洗脱剂是低级醇[15]。从表2中看出,50%和70%乙醇洗脱效果较好,使样品从树脂上解析。由于70%乙醇只比50%乙醇解析率高1.15%,考虑到经济因素,选取pH为8的50%乙醇溶液为洗脱液。
2.3 树脂的动态吸附和解析
加样后,以去离子水清洗层析柱,测定流出液的盐和肽含量,绘制强酸性苯乙烯系阳离子交换树脂001×7对黄豆酱多肽的动态吸附曲线,如图1所示;以pH为8的50%乙醇溶液为解析剂,黄豆酱多肽解析量随体积变化如图2。
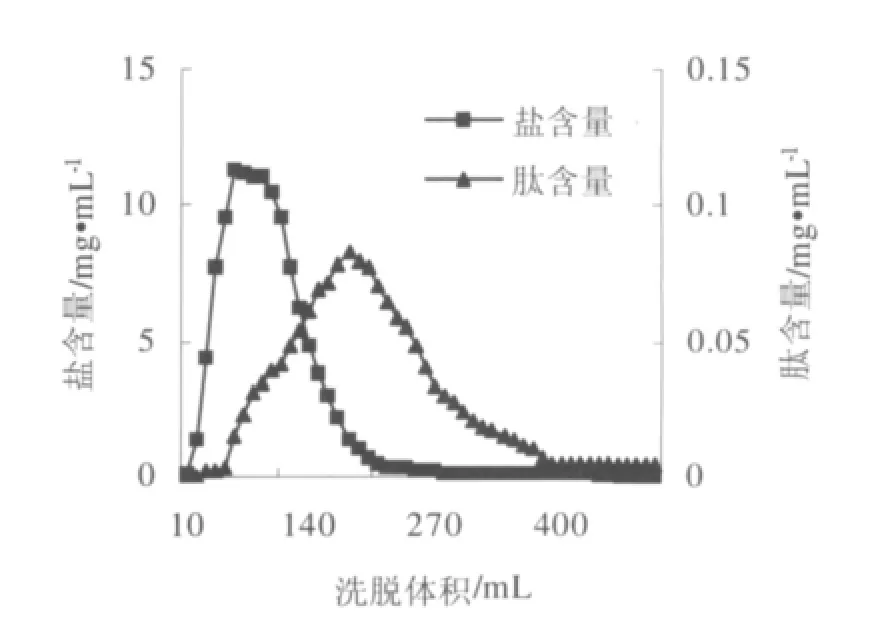
图1 黄豆酱多肽含量和盐含量随洗脱体积变化曲线Fig.1 Curve of salt and peptide content with elution

图2 黄豆酱多肽解析体积变化曲线Fig.2 Curve of soybean paste peptide content with separating volume change
图1中,在洗脱体积为60 mL时达到含盐量最大值11.34 mg·mL-1,在洗脱体积为340 mL时趋于稳定,肽含量在180 mL时达到最大值0.083 mg·mL-1,380 mL时呈稳定趋势,溶液中的盐基本被洗脱,大量肽被树脂吸附。从图2中看出,肽在60 mL到300 mL之间被洗脱,洗脱效果较好。
2.4 最佳样品浓度的确定
当进样量为60 mL,乙醇洗脱流速为30 r·min-1时,多肽回收率与样品浓度的关系如图。

图3 样品浓度对黄豆酱多肽回收率的影响Fig.3 Effects of sample densities on recovery rate of soybean paste peptides
适当的样品浓度能使多肽与树脂充分结合,增加多肽的吸附,提高多肽回收率。从图3中看出,样品浓度在1~4 mg·mL-1之间,多肽回收率呈上升趋势,在 6 mg·mL-1时有所下降。选取4 mg·mL-1为最佳进样浓度。
2.5 最佳流速的确定
进样量为60 mL,样品浓度为4 mg·mL-1时,乙醇洗脱流速与多肽回收率的关系如图4。
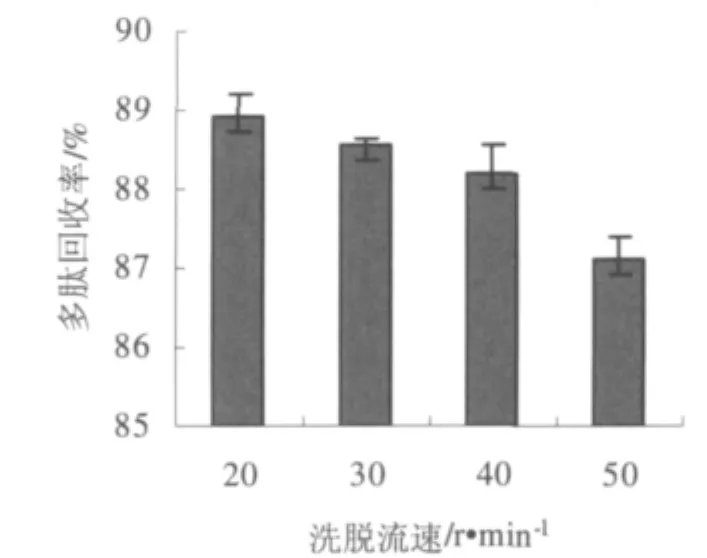
图4 流速对黄豆酱多肽回收率的影响Fig.4 Effects of flow rate on recovery rate of soybean paste peptides
从图中看出随着洗脱速度的加快,多肽的回收率呈下降趋势,说明流速越慢多肽回收率越高。但脱盐效果随之下降,综合考虑,选取30 r·min-1为最佳洗脱速度。
3 结论
3.1 静态吸附试验表明,强酸性苯乙烯系阳离子交换树脂001×7对黄豆酱多肽溶液同时具有较好的脱盐率和肽吸附率。
3.2 该树脂对黄豆酱多肽溶液动态吸附及解吸试验表明,最佳脱盐工艺条件为进样浓度4 mg·mL-1,洗脱剂为pH 8的50%乙醇溶液,流速为30 r·min-1。脱盐率达到91.28%,回收率为88.54%。
[1]赵建新,顾小红,刘杨岷,等.传统豆酱挥发性风味化合物的研究[J].食品科学,2006,27(12):684-687.
[2]徐清萍.酱类制品生产技术[M].北京:化学工业出版社,2009:53-77.
[3]杨荣华,林家莲,周凌霄.酱油、豆酱中褐色色素的生理功能[J].中国调味品,2000,30(5):21-22.
[4]Esaki H.,Onozaki H.,Osawa T.Food phytochemicals for cancer prevention I,fruits and vegetables[M].Washington DC:American Chemical Society Publication,1994.
[5]Shin Z.I.,Yu R.,Park S.A.,et al.His-His-Leu,an angiotensin I converting enzyme inhibitory peptide derived from korean soybean paste,exerts antihypertensive activity in vivo [J].Journal of Agriculture and Food Chemistry,2001,49(6):3004-3009.
[6]Mee-Ra Rhyu, Eun-Young Kim.Umamitaste characteristics of water extract of Doenjang,a Korean soybean paste:Low-molecular acidic peptides may be possible clue to the taste[J].Food Chemistry,2011,127(3):1210-1215.
[7]Tang Z G,Zhou R Q,Duan Z T.Adsorption and desorption behaviour of taurine on macroporous adsorption resins[J].JournalofChemicalTechnology and Biotechno1ogy,2001,76(7):752-756.
[8]宁芯.鲢酶解蛋白的脱盐及其对功能特性的影响[D].武汉:华中农业大学,2010.
[9]范文,阮长青,王鹤霖.DA201-C大孔吸附树脂对腐乳多肽脱盐作用的研究[J]. 中国粮油学报,2011,26(8):105-108.
[10]张鹏.大豆蛋白肽的制备和应用研究[D].沈阳:沈阳农业大学,2007.
[11]张宇昊,马良,谢祥.花生短肽脱盐工艺研究[J].中国粮油学报,2010,25(2):117-120.
[12]GB/T 22492-2008,大豆肽粉[S].
[13]吴谋成.食品分析与感官评定[M].北京:中国农业出版社,2004.
[14]GB/T5009.39-2003,酱油卫生标准的测定方法[S].
[15]严希康.生化分离技术[M].上海:华东理工大学出版社,2001.
[16]田亚平.生化分离技术[M].北京:化学工业出版社,2006.

