大豆糖蜜中高产乙醇菌株的筛选及其生长特性研究
李青川,高玉荣
(黑龙江八一农垦大学食品学院,大庆163319)
在当今的经济发展中,乙醇广泛应用于化学工业、食品、医药及军事等领域[1]。目前,世界各国日益重视能源问题,燃料乙醇由于其可再生性,被认为是最有可能代替石油的液体燃料[2]。因此燃料乙醇的需求量迅速增加,市场潜力十分巨大。
大豆糖蜜是大豆浓缩蛋白生产过程的副产物,其含糖量可达40%以上[3],目前,大豆糖蜜主要作为饲料添加剂添加于饲料中,未能进行大规模的深加工利用。目前,在我国酒精的产量中,主要以玉米、谷物、薯类、粮食与经济作物发酵[4]。利用大豆糖蜜发酵生产乙醇,不仅有利于缓解我国粮食紧张的压力,降低生产成本,而且能促进大豆浓缩蛋白生产企业副产品的有效利用。
优良的酵母菌株是决定乙醇产量的重要因素。为了获得适合利用大豆糖蜜进行发酵产乙醇的菌株,拟从大豆糖蜜中,筛选发酵性能优良的乙醇生产菌株,并进行生长特性的研究,以期为以大豆糖蜜为原料发酵生产乙醇提供高产菌株。
1 材料与方法
1.1 材料
1.1.1 样品来源
大豆糖蜜:黑龙江双河松嫩生物科技有限公司提供。
1.1.2 培养基
1.1.2.1 增殖培养基:自制麦芽汁液体培养基,12 °Brx,自然 pH。
1.1.2.2 分离培养基(YPD培养基):葡萄糖2%,蛋白胨2%,酵母提取物1%,琼脂2%,自然pH值,121℃灭菌20 min。
1.1.2.3 活化培养基:葡萄糖2%,蛋白胨2%,酵母提取物1%,自然pH值,121℃灭菌20 min。
1.1.2.4 TTC下层培养基:20%糖蜜,琼脂2%,121℃灭菌20 min。
1.1.2.5 TTC上层培养基:葡萄糖0.5%,琼脂1.5%,加水加热溶解,吸取9.5 mL加入到试管中121℃灭菌20 min,加入5%TTC浓溶液使其浓度为0.5%,混匀。
1.1.2.6 生长培养基:经3 000 r·min-1离心处理10 min处理后的大豆糖蜜,121℃灭菌20 min。
1.1.3 主要仪器和设备
SYQ·DMSX-280手提式压力蒸汽消毒器;LRH-150 S恒温恒湿培养箱;ZQ-X100振荡培养箱;752紫外可见分光光度计;分析天平(感量0.000 1 g);全玻璃蒸馏器;水浴锅。
1.2 实验方法
1.2.1 酵母菌的富集及分离
吸取1 mL大豆糖蜜液放于加有玻璃珠的20 mL增殖培养基的100 mL三角瓶中,于28℃、100 r·min-1培养24 h。吸取1 mL含菌增殖培养基进行十倍梯度稀释至1×10-6;分别吸取0.1 mL稀释液涂布于TTC下层培养基上,28±1℃倒置培养3~5 d。
1.2.2 酵母菌的筛选
1.2.2.1 TTC平板法初筛
将融化并冷却到45~50℃的TTC上层培养基,倒入菌落数量在100个左右的TTC平板上,28±1℃培养箱中避光保温3 h,取显色效果好的菌株接于YPD固体斜面培养基上[5]。
1.2.2.2 耐乙醇酵母菌的筛选
将显色效果好的菌株斜面2环,接入装有加有玻璃珠的20 mL增殖培养基中,28℃、100 r·min-1培养24 h。吸取9.5 mL增殖培养基放于试管中,放入杜氏小管并排出气体。在无菌操作条件下加无水乙醇,使乙醇浓度(v/v)分别为 12%、14%、16%、18%和20%,接种0.5 mL菌液接种于各试管中,28℃培养72 h,每天时观察产气情况,选择产气快且量大的菌株作为后续试验,并传接于分离培养基中[6]。
1.2.2.3 高产乙醇酵母菌的筛选
取耐乙醇能力强的菌株的斜面菌种,挑取2环接入加有玻璃珠的20 mL增殖培养基中,28℃、100 r·min-1培养18 h。锥形瓶中分别装入45 mL糖浓度为30%的生长培养基,接种菌悬液5 mL,在28 ℃、100 r·min-1发酵 24 h 后,静置发酵至 72 h,测定发酵液中的乙醇含量。
1.2.3 筛选菌株生长条件研究
1.2.3.1 最适生长糖浓度的测定
取筛选出来的高产乙醇的菌株,在增殖培养基经28 ℃、100 r·min-1活化培养 18 h后,将 5%(v/v)种子液分别接入糖浓度为2%、4%、6%、8%、10%的生长培养基中,装液量为 40 mL/250 mL,28 ℃、100 r·min-1振荡培养18 h后,测定其生物量。
1.2.3.2 最佳接种量的测定
取筛选出来的高产乙醇的菌株,在增殖培养基经 28℃、100 r·min-1活化培养 18 h后,分别将1%、2%、3%、4%、5%(v/v)的种子液接入到 1.2.3.1中所确定的最佳糖浓度的生长培养基中,装液量为40 mL/250 mL,28 ℃,100 r·min-1振荡培养18 h后,测定其生物量。
1.2.3.3 最适生长温度的测定
取筛选出来的高产乙醇的菌株,在增殖培养基经28 ℃、100 r·min-1活化培养 18 h后,将 5%(v/v)种子液接入1.2.3.1中所确定的最佳糖浓度的生长培养基中,装液量为 40 mL/250 mL,分别在 24、26、28、30、32℃,100 r·min-1振荡培养18 h后,测定其生物量。
1.2.3.4 最适生长pH值的测定
取筛选出来的高产乙醇的菌株,在增殖培养基经28 ℃、100 r·min-1活化培养 18 h 后,将 5%(v/v)种子液接入1.2.3.1中所确定的最佳糖浓度的生长培养基中,装液量为40 mL/250 mL,生长培养基的初始pH分别调为 4.5、5.0、5.5、6.0、6.5、7.0,28 ℃、100 r·min-1振荡培养18 h后,测定其生物量。
1.2.3.5 转速对酵母菌生长的影响
在增殖培养基经28℃、100 r·min-1活化培养18 h后,将5%(v/v)种子液接入1.2.3.1中所确定的最佳糖浓度的生长培养基中,装液量为40 mL/250 mL,28 ℃下,分别在 80、100、120、140、160 r·min-1的转速条件振荡培养18 h后,测定其生物量。
1.2.3.6 生长曲线的测定
将最适接种量的种子增殖培养基培养液接入到最适种子生长培养基中,最适培养条件下培养,每隔2 h测定其生物量[7]。
1.3 检测方法
乙醇含量的测定方法:蒸馏法[8]。
糖含量的测定方法:用手持式糖度计测定。
生物量的测定方法:采用比浊法,将发酵液混匀后稀释一定倍数,测定其在600 nm 的吸光度(OD600)[9]。
2 结果与分析
2.1 酵母菌的分离筛选
从大豆糖蜜中共分离得到12 个平板1 380 株菌供一级筛选。
2.1.1 TTC 平板法初筛
经避光保温培养后,观察比较TTC 平板中各菌株的颜色深浅,颜色比较深的菌株说明其呼吸酶活力强,产酒精能力较强,共挑出具有典型酵母菌菌落特征显色较深的的菌株156 株,进行耐乙醇能力的测定。
2.1.2 耐乙醇酵母菌的筛选
从TTC 平板法初筛得到的菌株中筛选耐乙醇能力强的菌株。通过观察菌株在含不同浓度乙醇的培养基中发酵程度的强弱,即在杜氏小管中气泡产生的快慢与多少,可知其对乙醇耐受能力。到72 h 时观察到,各菌株的在20%的乙醇浓度的发酵管里菌株B1、B2、B3、B5、B6、T1、T2、T4、T5、T6、P11、P14 仍 有着不同的产气情况,说明这些菌株比其它菌株具有更强的乙醇耐受能力,其产生乙醇的能力也可能会更大。
2.1.3 高产乙醇酵母菌的筛选
对耐乙醇能力强的菌进行产乙醇能力的测定。由表1 可看出,P14 的乙醇浓度最高,达到9.07%(v/v)。

表1 乙醇含量测定结果Table 1 The results of the ethanol content determination
2.2 P14 生长条件研究
2.2.1 最适生长糖浓度的测定
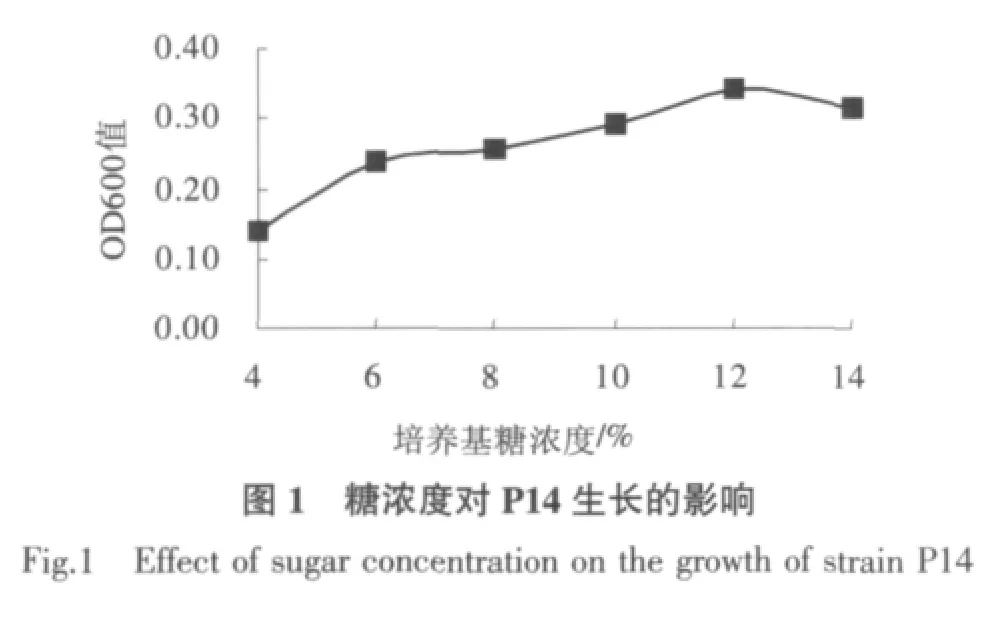
酵母菌利用大豆糖蜜中的糖作为生长所需的养分,糖浓度过低会导致酵母菌因养分不充足而生长缓慢,糖浓度过高又会使培养基的渗透压增大,从而抑制酵母菌的增殖。由图1 可看出,大豆糖蜜的糖浓度对P14 的生长影响显著,当糖浓度达到12%时P14 生长最旺盛,生物量最大。因此,确定大豆糖蜜糖浓度为12%作为P14 的最适生长糖浓度。
2.2.2 最佳接种量的测定
种子接种量的大小对酵母菌的生长影响显著。由图2 可看出,接入不同量的种子液后,经过18 h 的培养,不同接种量的培养液呈现了不同的OD600 值,接种量为1%~4%时,OD600 值随接种量的增加而增加,当接种量达到5%时,OD600 值则出现了下降的趋势。因此,P14 的最适接种量为4%。

2.2.3 最适生长温度的测定

温度对菌种生长影响显著,低温生长速度慢,高温菌种容易衰老死亡。由图3 可看出,在不同温度的条件下经过 18 h、100 r ·min-1 的培养,26 ℃时培养液的OD600 值出现了最高值。因此,选26℃作为P14的最佳生长温度。
2.2.4 最适生长pH 值的测定

酵母菌在其生长过程中,生长环境的pH 值过高或过低都会影响酵母菌细胞膜表面基团的解离,从而进一步影响到对营养物质的吸收和自身代谢物的分泌。由图4 可看出,在不同pH 值的培养基中培养,随着pH 值从4.5 增加到7.0 时,在6.0 处出现了最高值,但OD600 值的趋势线比较平缓,pH 值对其影响不显著。因此,选取6.0 作为P14 的最适生长pH。这与培养基的自然pH 值接近。
2.2.5 最佳生长转速的测定

转速是影响到培养基中的可溶性氧含量的另一个因素,因此培养过程中合适的转速可为酵母菌的快速生长补充充足的氧分。由图5 可见,140 r ·min-1时OD600 值最大,因此选取140 r ·min-1 作为P14 的摇瓶转速。
2.2.6 生长曲线的测定
在进行发酵试验时,应选择处于对数生长期的菌体,在此阶段细胞生长旺盛,代谢活性强,繁殖快,个体形态、化学组成、生理特性等均较为稳定、一致。由图6 可看出,菌株P14 没有生长的延滞期,从培养的一开始便进入对数生长期,当培养到16 h 后,OD600 值基本趋于稳定;当培养到24 h 时,其生物量开始减少,说明从22 h 开始进入了衰亡期。由P14 的生长特性可知,在糖浓度12%的大豆糖蜜培养基中,控制pH 值6.0,发酵温度26℃,转速140 r ·min-1,培养16 h 可获得最佳的种子。

3 结论
3.1 采用TTC 平板法、乙醇耐性测定以及产乙醇性能三级筛选,从大豆糖蜜中分离的1 380 株野生菌中,筛选到1 株可耐受20%(v/v)乙醇、初始发酵的乙醇浓度达9.07%的菌株P14。可为大豆糖蜜的发酵生产乙醇提供优良的菌种。
3.2 研究确定了该菌的最佳生长条件为糖浓度12%,接种量4%,生长温度26℃,pH 6.0,转速140 r ·min-1。在此条件下,培养16 h 后获得最佳的种子培养液。
[1] 姚汝华,赵继伦.酒精发酵工艺学[M].广州:华南理工大学出版社,1999.
[2] 易弋,黎娅,容元平,等.耐高温酒精酵母的筛选[J].广西工学院学报,2009,20(3):26-29.
[3] 崔元峰,田娟娟,白志明.大豆糖蜜制备酒精工艺的研究[J].中国油脂,2008,33(12):61-63.
[4] 傅其军.国内外酒精行业发展近况[J].广西轻工业,2005,87(3):12-13.
[5] 王梅,张彭湃,帅桂兰,等.TTC 在黄酒酵母选育中的应用[J].酿酒,2001,28(5):62.
[6] 张怀东,刘作易,周礼红,等.高耐性高产酒精酵母的分离和筛选[J].酿酒科技,2009,31(3):40-42.
[7] 熊海燕,李莹.不同果汁发酵液中酵母菌生长曲线的测定及 pH 值的变化[J].农产品加工学刊,2009,10(4):26-27.
[8] GB/T 15038-2006,葡萄酒、果酒通用分析方法[S].
[9] 徐大鹏,李云杰,张栩,等.耐高温酵母菌的筛选及特性[J].生物加工过程,2011,9(3):18-21.

