莠去津对土壤微生物数量的影响
杨 璐
(大理学院农学与生物科学学院,云南大理 671003)
莠去津又名阿特拉津,英文通用名Atrazine,化学名称为2-氯-4-乙氨基-6-异丙氨基-11315-三嗓,系三氮苯类农药。适用于玉米、高粱、甘蔗、果树、苗圃、林地防除十字花科、豆科杂草,对某些多年生杂草也有一定抑制作用。莠去津是一种具有较强生态毒性的除草剂,具体表现在通过水体、土壤等介质影响水生、陆生生物甚至人体,长期接触会导致动物乳腺癌和卵巢癌的发生〔1-4〕。
土壤微生物是土壤生态系统的重要组成部分。化学农药进入土壤后可通过影响微生物的数量,改变土壤微生物分泌、释放和修饰酶的强度,从而抑制或促进某些土壤酶的活性,破坏土壤中正常的生物化学过程,最终影响或破坏土壤生态环境〔5-8〕。
本次实验通过检测细菌、真菌、放线菌的数量变化,研究了莠去津施用后对土壤生物数量的影响,其结果可为了解莠去津对环境的负作用,修复被莠去津除草剂污染的土壤提供科学依据。
1 材料与方法
1.1材料土壤为红壤土,采集于云南农业大学后山实验田,用于栽培玉米等作物的农田土。38%莠去津悬浮剂,产于云南省昆明农药厂。
1.2方法〔9〕
1.2.1 莠去津处理土壤 称取2 kg土壤,过筛,去除颗粒直径大于2 mm的部分,置于大烧杯中,加入10 g腐熟猪粪、10 g水稻秸秆和10 g紫云英搅拌均匀。分别称取100 g混匀的土壤6份,每份分别加入以下浓 度 0.000 0、0.001 0、0.002 5、0.005 0、0.010 0、0.015 0 mg/kg的莠去津0.0、0.05、0.125、0.25、1.0、2.5 mL,各浓度做3个平行样,置(25±1)℃恒温生化培养箱中暗培养,培养过程中损失的水分通过称重法给予补充。分别于培养后第0、7、14、21、28、35、42 d采集土壤样品,测定微生物数量。为叙述方便将培养过程分为4个阶段,初期从0~7 d,中期从14~21 d,后期从28~35 d,末期为42 d后。
1.2.2 土壤微生物接种培养 取培养后土壤10 g,放入装有90 mL灭菌水的广口瓶中,塞上经灭菌的橡皮塞,在振荡机上振荡10 min,制成10%土壤稀释液,用10%稀释液分别配制成1%、0.1%、0.01%和0.001%的系列土壤稀释液。取上述浓度梯度的土壤稀释液分别涂布在平板培养基上。
1.3数据处理土壤微生物数量(cfu/g)=MD/W,式中M为菌落平均数;D为稀释倍数;W为土壤烘干质量(g)。
微生物抑制率(%)=(A-B)/A·100%,式中A为对照样品平均菌落生长数量;B为所测样品同一浓度下平均菌落生长数量。
2 结果与分析
2.1细菌、真菌、放线菌42 d的变化趋势分析
2.1.1 莠去津对土壤细菌数量的影响 图1显示莠去津影响下土壤细菌的数量在0~42 d的变化趋势。由图1可知,4个阶段的变化趋势大致相同,均为初期细菌数量上升,中期细菌数量较初期大幅上升,后期细菌数量较中期大幅下降,末期细菌数量较后期有所下降。并且前3个阶段添加了莠去津除草剂的土样中的细菌数量均比空白中细菌数量多。
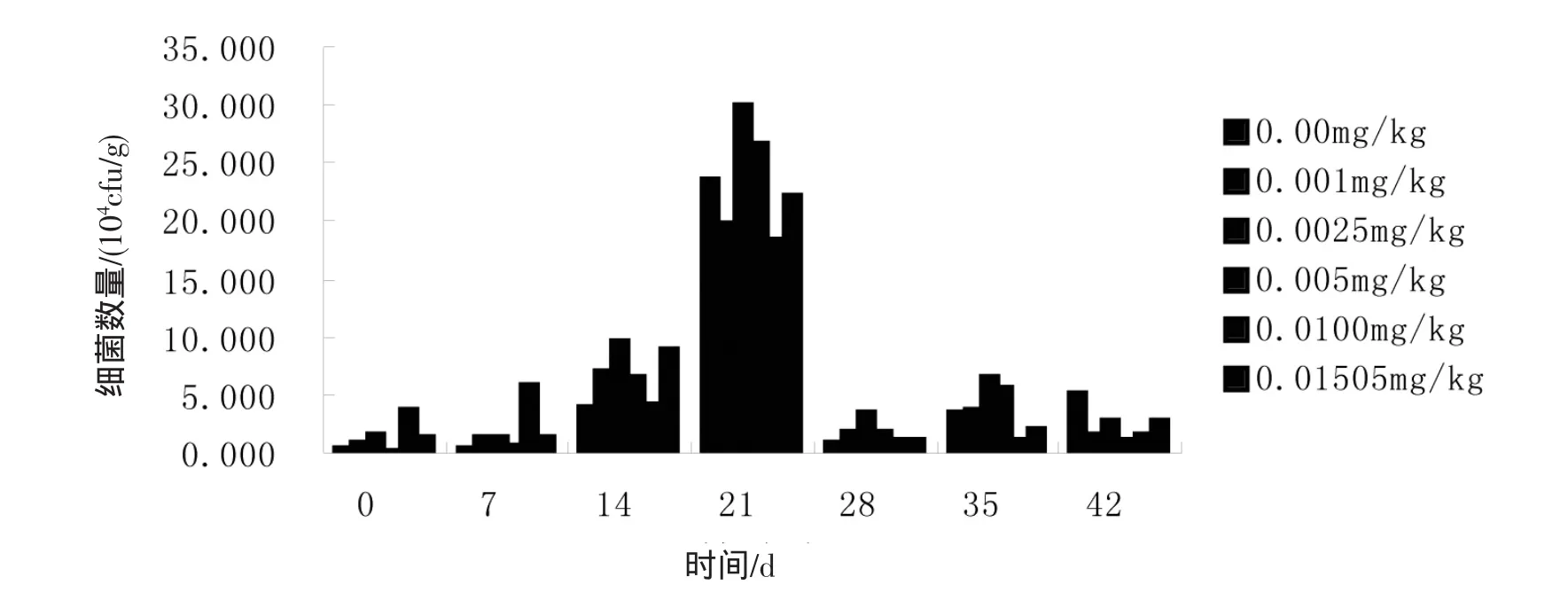
图1 莠去津对土壤中细菌数量的影响及变化趋势
2.1.2 莠去津对土壤真菌数量的影响 图2表示真菌的数量在0~42 d的变化趋势。4个阶段的变化趋势大致为:在莠去津浓度为0.000 0 mg/kg和0.002 5 mg/kg的情况下,初期真菌数量大幅上升,中期真菌数量较前期有所下降,后期真菌数量较中期有所上升,末期真菌数量较后期大幅下降;莠去津浓度为0.001 0 mg/kg时,初期真菌数量有下降,中期真菌数量较初期有所下降,后期真菌数量较中期有所上升,末期真菌数量较后期大幅下降;莠去津浓度为0.002 5、0.005 0、0.010 0、0.015 0 mg/kg时,初期真菌数量大幅上升,中期真菌数量较初期有所下降,后期真菌数量较中期有所上升,末期真菌数量较后期大幅下降,同时中期添加了莠去津除草剂的土样中的真菌数量均比空白中真菌数量大。在7 d,除了浓度为0.001 0、0.005 0 mg/kg以外,添加其他浓度的莠去津条件下土壤真菌数量均是最多的,28 d真菌数量大幅下降,35 d较28 d有所上升。
2.1.3 莠去津对土壤放线菌数量的影响 图3表示放线菌的数量在0~42 d的变化趋势:4个阶段的变化趋势大致相同,均为初期与中期相比放线菌数量有所上升,后期放线菌数量较中期有所下降,末期放线菌数量几乎为零。其中,投加了莠去津的土样中真菌数量在第7 d、14 d、21 d、28 d要比空白中相应时段的真菌数量多,在第21 d时各个浓度的放线菌数量最多,第28 d后放线菌数量大幅下降。
2.2细菌、真菌、放线菌的抑制率分析
2.2.1 细菌的抑制率分析 总体上,莠去津对细菌的抑制现象在末期才出现,不同浓度莠去津对土壤细菌抑制从大到小的排序为:0.005 0 mg/kg>0.001 0 mg/kg>0.010 0 mg/kg>0.002 5 mg/kg>0.015 0 mg/kg。但是,莠去津浓度为0.001 0 mg/kg时,在4个阶段均出现了对细菌的抑制现象;浓度为0.015 0 mg/kg和0.001 0 mg/kg时,在后期和末期也出现了对细菌的抑制现象;浓度为0.001 0 mg/kg时出现了对细菌的瞬时抑制现象。
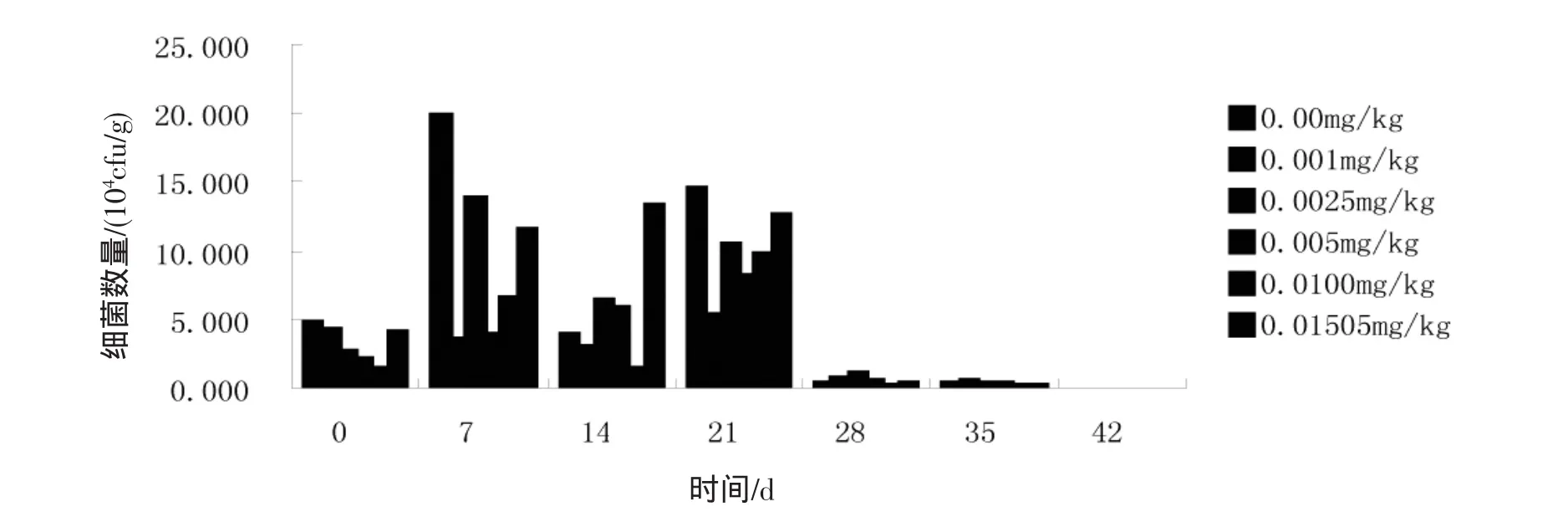
图2 莠去津对土壤中真菌的生长数量影响及变化趋势
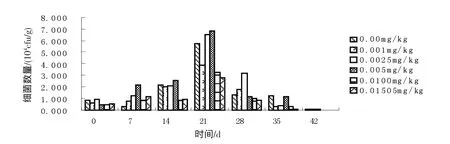
图3 莠去津对土壤中放线菌的生长数量影响及变化趋势
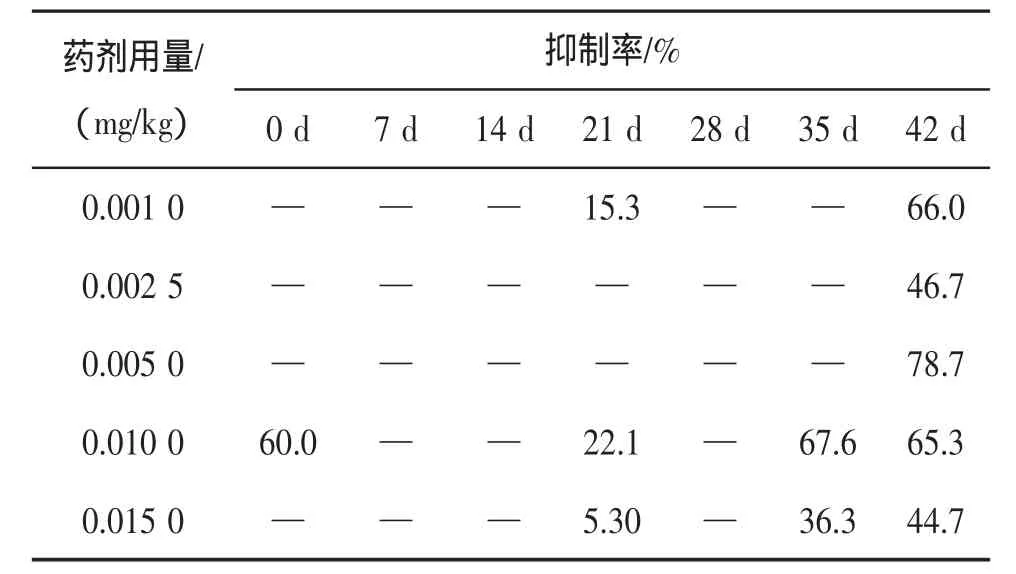
表1 莠去津对土壤中细菌种群数量的抑制率
2.2.2 真菌的抑制率分析 总体来看,莠去津在4个阶段对真菌都有抑制现象,其抑制率呈现:初期>后期>中期>末期。不同莠去津浓度下4个阶段抑制率比较:浓度为0.001 0 mg/kg、0.002 5 mg/kg及0.005 0 mg/kg时,呈现初期>后期>中期>末期;浓度为0.001 0 mg/kg时,呈现初期>后期>末期>中期;浓度为0.015 0 mg/kg时,呈现末期>初期>中期>后期。其中,莠去津浓度为0.002 5 mg/kg和0.005 0 mg/kg时,在第14、28、42 d无抑制现象;浓度为0.001 0 mg/kg时,在第28、35、42 d无抑制现象;浓度为0.015 0 mg/kg时,在第14 d、28 d无抑制现象。
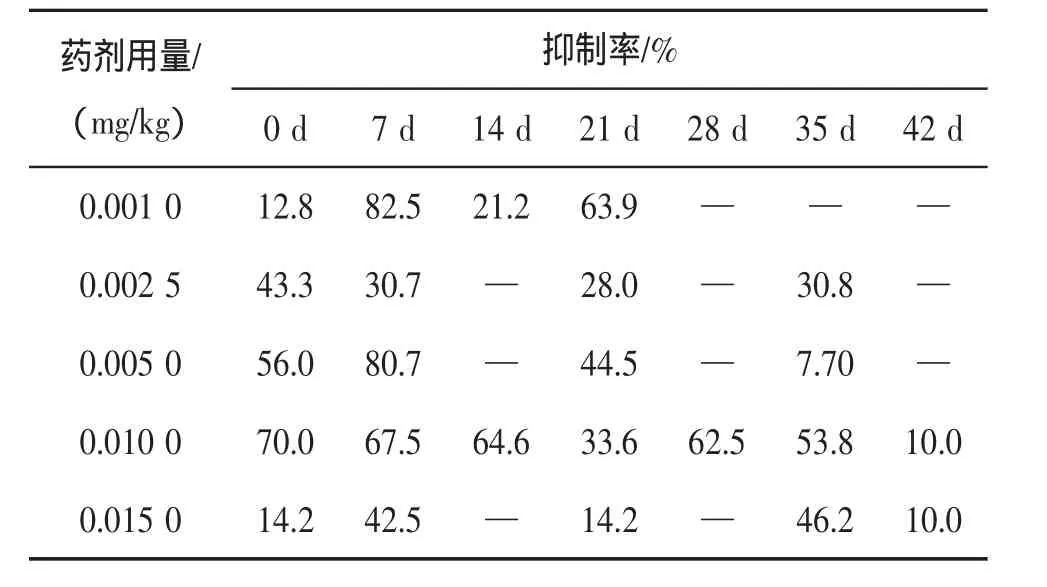
表2 莠去津对土壤中真菌种群数量的抑制率
2.2.3 放线菌的抑制率分析 总体来看,莠去津在4个阶段对放线菌都有抑制现象,其抑制率呈现:初期>后期>中期>末期。不同莠去津浓度下4个阶段抑制率比较:浓度为0.001 0 mg/kg时,呈现末期>初期>中期>后期;浓度为0.002 5 mg/kg时,呈现末期>后期>中期>初期;浓度为0.005 0 mg/kg时,呈现初期>后期>末期>中期;浓度为0.010 0 mg/kg时,呈现末期>中期>后期>初期;浓度为0.015 0 mg/kg时,呈现末期>中期>初期>后期。其中,浓度为0.010 0 mg/kg、0.015 0 mg/kg时,在第7 d、42 d无抑制现象;浓度为0.005 0 mg/kg时,在第7、14、21、42 d无抑制现象;浓度为0.002 5 mg/kg时,在第0、7、21、28 d无抑制现象;浓度为0.001 0 mg/kg时,在第7、28、42 d无抑制现象。在第7 d时,所有莠去津浓度条件下都无抑制现象。并且,除浓度0.002 5 mg/kg以外在其它莠去津浓度下均出现了对放线菌的瞬时抑制现象。
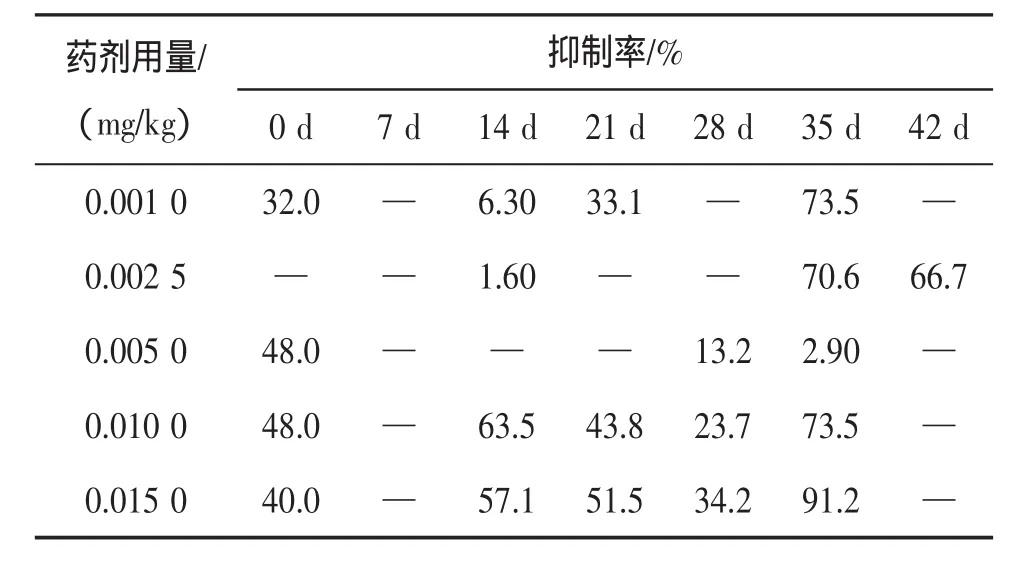
表3 莠去津对土壤中放线菌种群数量的抑制率
3 结论
在28 d以后能够看出莠去津对真菌、放线菌的抑制效果很明显,对细菌则无抑制效果。在42 d时真菌、放线菌的菌群数量几乎为零,细菌的菌群数量在0~5之间。莠去津对微生物数量的抑制效果:细菌<放线菌<真菌。农药施用浓度越高,对土壤微生物数量的影响越大。
莠去津除草剂对真菌、放线菌数量的抑制出现在1周后,而对细菌数量的抑制却出现在7周后,说明对细菌的抑制存在滞后性。
4 讨论
莠去津除草剂对真菌、放线菌数量的抑制出现在第1周,而对细菌数量的抑制却出现在第7周。说明对细菌的抑制出现滞后性。其可能的原因是:第一,当土壤环境恶劣时,细菌能呈休眠状态存活下来,当环境良好时,它们又重新繁殖。外来的细菌是随污染水、动植物残体和人畜粪便等进入土壤的,它们在土壤中可持续一段时间,并作短期的生长繁殖。第二,当莠去津除草剂进入土壤后会对原生动物有抑制效果,但除草剂对原生动物的影响比杀虫剂弱,时间仅为2周,6周后抑制作用完全消失。抑制消失后原生动物就会继续捕食细菌。第三,莠去津除草剂会减少土壤中的细菌总量,减少氨化菌和固氮菌的数量〔10-13〕。
莠去津对真菌、放线菌都出现了瞬时抑制现象,但对细菌仅在个别浓度上出现。其可能的原因为:莠去津除草剂进入土壤后首先对真菌、放线菌产生抑制作用,当真菌、放线菌的数量越来越少之后,才对细菌的数量有所抑制作用〔14〕。
〔1〕蔡思义,米长虹,郑振华.阿特拉津与农业环境〔J〕.农业环境与发展,1994,11(4):22-26.
〔2〕许光辉,郑洪元.土壤微生物分析方法手册〔M〕.北京:农业出版社,1986:255-258.
〔3〕关松荫.土壤酶及其研究〔M〕.北京:农业出版社,1983:320-323.
〔4〕弓爱君,叶常明.除草剂阿特拉津(atrazine)的环境行为综述〔J〕.环境科学进展,1997,5(2):37-47.
〔5〕盖钧镒.试验统计方法〔M〕.北京:中国农业出版社,2002.
〔6〕杨永华,姚健,华晓梅.农药污染对土壤微生物群落功能多样性的影响〔J〕.微生物学杂志,2000,5(2):37-47.
〔7〕汪海珍,徐建民,谢正苗.甲磺隆结合态残留物对土壤微生物的影响〔J〕.农药学学报,2003,5(2):37-47.
〔8〕姚槐应,黄昌勇.土壤微生物生态学及其实验技术〔J〕.北京:科学出版社,2006.
〔9〕任天志.持续农业中的土壤生物指标研究〔J〕.中国农业科学,2000,33(1):68-75.
〔10〕叶常明,王杏君,弓爱君.阿特拉津在土壤中的生物降解研究〔J〕.环境化学,2000,19(4):300-305.
〔11〕辛承友,朱鲁生,王军.阿特拉津对不同肥力土壤蔗糖酶活性的影响〔J〕.农业环境科学学报,2004,23(3):479-483.
〔12〕李宏园,马红,陶波.除草剂阿特拉津的生态风险分析与污染治理〔J〕.东北农业大学学报,2006,37(4):55-556.
〔13〕万年升,顾继东,段舜山.莠去津生态毒性与生物降解的研究〔J〕.环境科学学报,2006,26(4):552-560.
〔14〕蒋海东,杨青,吕宪国.土壤动物在农业生态系统中的研究进展〔J〕.土壤通报,2006,37(4):805-807.

