周剂量紫杉醇对局部晚期食管癌的放疗增敏作用
姜 勇,崔 林,吴兴军,何学军,刘兴祥,周向荣,刘建军
(姜堰市人民医院肿瘤科,江苏 姜堰 225500)
以放疗为中心的非手术多学科综合治疗是不宜手术的局部晚期食管癌患者的主要治疗手段[1-2]。一般而言,单纯放疗局部病灶的失败率高达80%,控制食管癌局部病灶成为食管癌治疗成败的关键。Wong等[3]的研究显示:与单纯放疗比较,放化疗综合治疗可显著提高局部晚期食管癌局部控制率和1 a生存率,降低死亡风险。有鉴于此,作者采用周剂量紫杉醇同步放疗治疗不宜手术的局部晚期食管癌,并取得了一定疗效,现报道如下。
1 资料与方法
1.1 临床资料 本组患者为姜堰市人民医院肿瘤科2011年1月至2011年8月住院患者,共随机入组44例,均经内镜活检病理学检查确诊为食管鳞癌,经食管钡餐Ⅹ线片、颈胸腹CT等证实为局部晚期。其中男性31例,女性13例;年龄48~72岁,中位年龄52岁。44例患者采用信封法随机分为放疗增敏组和单纯放疗组,每组22例。2组患者在性别、年龄、KPS评分、肿瘤位置、病变情况等方面差异无统计学意义(P>0.05),具有可比性。放疗前针对营养状态不良、脱水或其他并发症者及时营养支持对症处理,食管钡餐Ⅹ线片显示有尖刺、龛影或胸背痛或白细胞升高者积极抗感染治疗。
1.2 入组标准 1)年龄≤75岁;2)体力状况良好,KPS评分≥70分,无远处转移;3)治疗前常规行血常规、肝功能、肾功能、电解质、心电图检查,无放化疗禁忌;4)预计生存期>3个月;5)初发初治,治疗前未接受胸部放疗和(或)化疗;6)放化疗前签署特殊治疗知情同意书,符合医学伦理委员会要求。
1.3 治疗方法 44例均根据食管内镜、食管钡餐Ⅹ线片和颈胸腹CT所示肿瘤实际侵犯范围,行Ⅹ线模拟机定位,设定照射野。放疗均采用6 MV-Ⅹ线直线加速器常规分割外照射,2 Gy/次,5次/周,一期放疗剂量DT 36~40 Gy;二期缩野避脊髓推量放疗至累计总剂量DT 60~66 Gy/6~7周。放疗增敏组同步采用周剂量紫杉醇全身用药方案:紫杉醇4.0 mg·m-2,每周1次,放疗前给药,连用6周。每次化疗前常规给予抗过敏预处理及5-HT3受体拮抗剂格拉司琼预防呕吐及质子泵抑制剂奥美拉唑保护胃黏膜。
1.4 疗效及毒副反应评价 近期疗效判定均于放疗后1个月进行,参照实体瘤的疗效评价标准(RECIST 1.1版),分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。以CR+PR计算有效率。放疗急性毒副反应按美国肿瘤放射治疗协作组(RTOG)早期放射反应标准评定,分为0~Ⅳ度;化疗毒副反应按WHO制定的抗肿瘤药物急性与亚急性毒副反应标准评定,分为0~Ⅳ度。
1.5 随访 采用门诊或电话随访的方式对患者进行随访,全组患者均随访12个月,随访率100.0%。随访内容包括食管钡餐Ⅹ线片、颈胸腹CT等,对2组患者局部控制率、生存率进行比较分析。
1.6 统计学处理 采用SPSS 17.0进行统计分析,率的比较采用χ2检验,检验水准α=0.05。
2 结果
2.1 疗效 全组44例患者均可评价疗效,放疗增敏组与单纯放疗组有效率分别为86.4%和63.6%(P<0.05);1 a局部控制率分别为77.3%和50.0%(P <0.05);1 a无复发生存率分别为72.7%和45.5%(P<0.05);1 a生存率分别为 81.8% 和 54.5%(P <0.05)。见表 1、2。
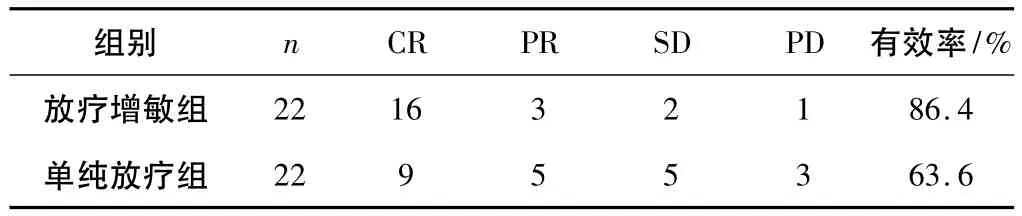
表1 2组近期疗效比较

表2 2组1 a局部控制率、无复发生存率、生存率比较 %
2.2 毒副反应 2组毒副反应主要表现为放射性食管炎、放射性肺炎、骨髓抑制和恶心呕吐等,经对症治疗后均可缓解,未影响治疗计划的顺利进行。2组毒副反应多为0~Ⅱ度,Ⅲ度毒副反应少见,未发现Ⅳ度毒副反应。放疗增敏组毒副反应发生率高于单纯放疗组,但比较差异无统计学意义(P>0.05)。见表3。
3 讨论
食管癌是我国高发恶性肿瘤之一,早期症状不典型,确诊时约80%为中晚期,失去了手术机会。放疗是食管癌重要的局部治疗手段,治疗后复发方式以局部复发和远处转移常见,80%患者由于局部未控或复发导致治疗失败。对于局部晚期食管癌,若采用非手术治疗方法,单纯放疗或单纯化疗均难以获得理想治疗效果。临床上为提高局部控制率和延长生存时间,放化同步治疗已成为身体状况良好的局部晚期食管癌患者的首选综合治疗模式。
RTOG的RDG 85-01研究是比较局部晚期食管癌放化疗综合治疗与单纯放疗间疗效差异的一项经典Ⅲ期临床试验,研究对象为129例食管鳞癌患者,分为放化疗综合治疗组和单纯放疗组,前者采用2周期的5-氟尿嘧啶+顺铂化疗,同步常规分割放疗50 Gy,同步放化疗结束后再给予2周期5-氟尿嘧啶+顺铂化疗;后者采用单纯常规分割放疗,总剂量64 Gy。结果发现放化疗综合治疗组的疗效显著优于单纯放疗组;综合治疗组局部复发率为25%,Ⅲ度毒副反应发生率为25%;而单纯放疗组局部复发率为37%,Ⅲ度毒副反应发生率为19%;放化疗综合治疗组中位生存期为12.5月,5 a生存率为26%;而单纯放疗组则为8.9个月和 0%[4-5]。
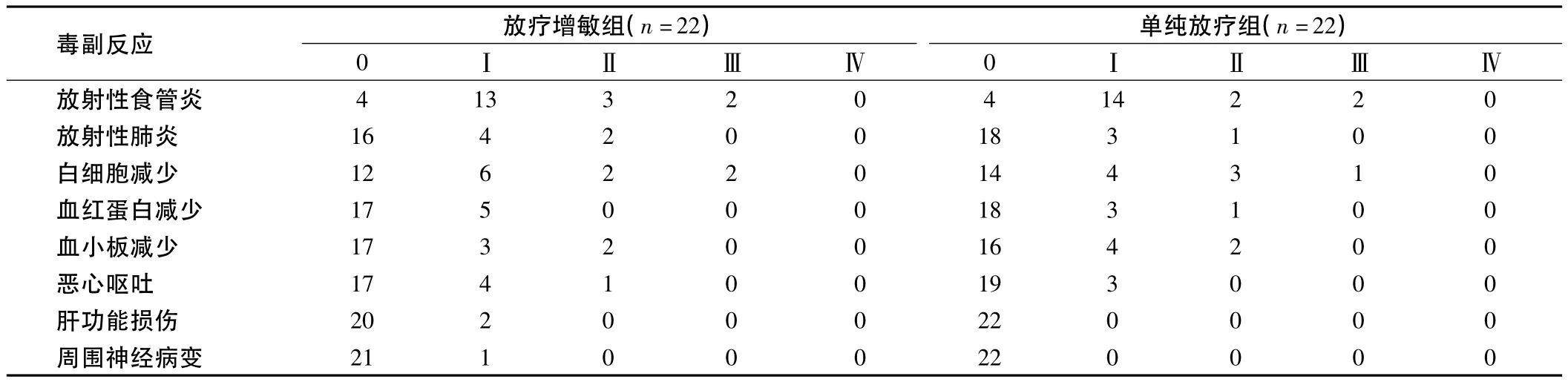
表3 2组毒副反应比较例
放化疗联合治疗是全身与局部治疗的配合,能相互协同、相互补充和相互加强。目前同步放疗的化疗药物临床常用的有顺铂、奈达铂、5-氟尿嘧啶、紫杉醇、多西他赛、长春瑞滨等[6-8]。紫杉醇是新型紫杉醇类抗肿瘤化合物,其独特的放射增敏机制表现为G2/M期细胞阻滞,诱导细胞凋亡和促进肿瘤细胞再氧合。放疗主要是杀伤G1、M、G2期细胞,对S期细胞没有杀伤作用;而化疗对G1/S期细胞杀伤力大,两者可互补,且紫杉醇还与诱导细胞凋亡和促进乏氧细胞再氧合有关。紫杉醇既提供了放疗增敏作用,同时也是一种全身治疗,可以有效杀灭放疗区域以外的微小转移灶,降低远处转移率。因此紫杉醇同步放疗可以增强对肿瘤的杀伤,缩短总疗程,减少放化疗过程中肿瘤细胞的加速再增殖。
增敏化疗的原则是其化疗的毒副反应以不影响放疗的进程为前提,化疗剂量应相对较低[9]。为了最大程度降低同步放化疗的毒副反应,避免患者身体状况差导致的治疗中断,作者将紫杉醇的给药方式设定为每周1次,每次剂量40 mg·m-2,连用6周。这样不但最大程度降低了化疗的毒副反应,同时又避免了放疗中断后放疗靶区生物剂量的下降,最终使患者顺利完成预定剂量的放疗[10]。本研究结果显示,放疗增敏组有效率、1 a局部控制率、1 a无复发生存率和1 a生存率均显著优于单纯放疗组的对应数据,且毒副反应未见明显增加,放疗增敏组患者依从性良好,均顺利完成治疗计划,产生了很好的协同增效作用。
综上所述,周剂量紫杉醇对局部晚期食管癌放疗具有增敏作用,能提高疗效,且毒副反应未见明显增加,值得临床推广应用。
[1]Enzinger PC,Mayer RJ.Esophageal cancer[J].N Engl J Med,2003,349(23):2241-2252.
[2]Kranzfelder M,Büchler P,Lange K,et al.Treatment options for squamous cell cancer of the esophagus:a systematic review of the literature[J].J Am Coll Surg,2010,210(3):351 - 359.
[3]Wong RK,Malthaner RA,Zuraw L,et al.Combined modality radiotherapy and chemotherapy in nonsurgical management of localized carcinoma of the esophagus:a practice guideline[J].Int J Radiat Oncol Biol Phys,2003,55(4):930 -942.
[4]Sarraf M,Martz K,Herskovic A,et al.Progress report of combined chemoradiotherapy versus radiotherapy alone inpatients with esophageal cancer:an intergroup study[J].J Clin Oncol,1997,15(1):277 -284.
[5]Cooper JS,Guo MD,Herskovic A,et al.Chemoradiotherapy of locally advanced esophageal cancer:long-term follow-up of a prospective randomized trial(RTOG 85-01) [J].JAMA,1999,281(17):1623-1627.
[6]Emi M,Hihara J,Hamai Y,et al.Neoadjuvant chemoradiotherapy with docetaxel,cisplatin,and 5-fluorouracil for esophageal cancer[J].Cancer Chemother Pharmacol,2012,69(6):1499 -1505.
[7]Eisterer W,DE Vries A,Kendler D,et al.Triple induction chemotherapy and chemoradiotherapy for locally advanced esophageal cancer:A phase Ⅱ study[J].Anticancer Res,2011,31(12):4407-4412.
[8]Kato K,Muro K,Minashi K,et al.Phase Ⅱ study of chemoradiotherapy with 5-fluorouracil and cisplatin for StageⅡ-Ⅲ esophageal squamous cell carcinoma:JCOG trial(JCOG 9906)[J].Int J Radiat Oncol Biol Phys,2011,81(3):684 -690.
[9]Stahl M,Budach W,Meyer HJ,et al.Esophageal cancer:Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2010,21 Suppl 5:v46 - v49.
[10]Orditura M,Galizia G,Napolitano V,et al.Weekly chemotherapy with cisplatin and paclitaxel and concurrent radiation therapy as preoperative treatment in locally advanced esophageal cancer:a phase Ⅱ study[J].Cancer Invest,2010,28(8):820 - 827.

