人食管鳞癌EC9706细胞线粒体DNA中ND1基因突变的检测及意义
刘宗文,冯天平,赵景志,田薇薇,韩 娜,孙淼淼,娄 欣,胡爱侠
(1.郑州大学第二附属医院肿瘤科,河南 郑州 450014;2.郑州大学公共卫生学院,河南 郑州 450001;3.河南省肿瘤医院病理科,河南 郑州 450003;4.郑州市中心医院,河南 郑州 450052;5.商丘市中心医院,河南 商丘 476000)
人类线粒体DNA(mitochondrial DNA,mtDNA)的全部核苷酸序列分析已由剑桥分子生物学研究所完成,人类mtDNA的核苷酸序列全长为16569 bp,呈双链闭环结构[1-2]。mtDNA分为非编码区(D-LOOP区)和编码区。mtDNA编码区含有37个编码基因,分别编码2个rRNA、22个tRNA和13个编码呼吸链复合物亚单位的蛋白质。mtDNA中ND1基因为线粒体编码的13个蛋白多肽中复合体I(NADH-CoQ还原酶)的亚基。线粒体参与细胞的代谢、凋亡、衰老以及肿瘤的发生等生理和病理的代谢过程[3-4]。研究[5]已经表明mtDNA的异常与人类多种肿瘤关系密切。通过对人食管鳞癌EC9706细胞mtDNA中ND1基因进行检测,了解mtDNA中ND1基因是否有突变,作者曾在以往的研究[6-8]中发现人食管鳞癌中mtDNA编码ND1基因拷贝数是增加的,如果使得mtDNA编码ND1基因的表达下调,就可能达到治疗目的,进而为食管癌的治疗提供了新的思路。
1 材料与方法
1.1 材料
1.1.1 人食管癌细胞系 人食管鳞癌EC9706细胞株由中国医学科学院国家分子肿瘤重点实验室馈赠。
1.1.2 主要试剂和仪器 胎牛血清(天津TBD公司);PCR扩增试剂盒(上海Sangon公司);mtDNA引物、线粒体提取试剂和mtDNA萃取试剂盒(上海杰美基因医药科技有限公司);尿嘧啶、丙酮酸(美国Sigma公司)。CO2恒温培养箱(德国GMBH公司);BCM-100A型生物洁净工作台(苏州安泰空气净化公司);高速低温离心机(德国Heraeus公司);DNA热循环扩增仪(德国Biometra公司)。
1.1.3 引物设计 mtDNA的ND1基因引物(3059~4015,956 bp)序列如下:上游引物(MAF):5’-TTACTCCTGCCATCATGACC-3’,下游引物 (MAR):5’-AGAATGATGGCTAGGGTGAC-3’,扩增片段长度为956 bp。上述引物由上海杰美基因医药科技有限公司合成。

1.2 方法
1.2.1 细胞的复苏及培养 从液氮中取出人食管鳞癌EC9706细胞冻存管,迅速放入37℃水浴1~2 min使之融化;吸取细胞悬液,加入适量培养基;1000 r·min-1离心5 min,弃上清,加入培养基,重复离心2次;用含体积分数10%胎牛血清的培养基适当稀释后,接种于培养瓶内,置于37℃、体积分数为5%CO2培养箱中培养,次日更换1次培养基。以后按常规进行培养。
1.2.2 人食管鳞癌EC9706细胞mtDNA中ND1基因测序 提取mtDNA的ND1基因,PCR扩增ND1基因,用mtDNA的ND1基因引物(3059~4015,956 bp),得到PCR反应产物。经过纯化的PCR产物由上海基康生物技术有限公司进行测序。
2 结果
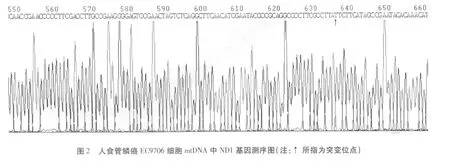
人食管鳞癌EC9706细胞mtDNA中ND1基因测序结果:经测序发现EC9706细胞中的3971处出现点突变,由C突变为T,其碱基序列和测序图见图1、2。
3 讨论
人类的mtDNA全部核苷酸序列分析测定已经完成。mtDNA存在于线粒体内膜上,是惟一的核外遗传物质。目前的研究[9]已经表明mtDNA的异常与人类多种肿瘤的关系密切。mtDNA分为非编码区(DLOOP区)和编码区。对于D-LOOP区的研究一直较热,但尚无定性结论。对于编码区的研究目前较少,对这些mtDNA突变或功能异常所发生的分子遗传机制的研究,可以阐明肿瘤的发病机制、mtDNA的表达情况、mtDNA与核DNA的相互作用及协调一致表达的机制,并为肿瘤的治疗提供理论指导[10]。
本实验对人食管鳞癌 EC9706细胞mtDNA中ND1基因进行测序,结果发现人食管鳞癌EC9706细胞mtDNA中ND1基因的3971处出现点突变,由C突变为T,这种突变可能是肿瘤发病的原因。
研究[11]显示,细胞凋亡与肿瘤的发生、发展及预后关系密切。由于mtDNA与体内能量代谢相关,所以mtDNA突变或功能异常容易导致能量合成减少,进而引发细胞衰老、死亡和凋亡,细胞发生凋亡或坏死受多种因素调控,其中mtDNA突变或功能异常或许就是诸多调控因素之一[12-16]。
根据上述研究成果,Uchida等[14]用莫法罗汀处理乳腺癌细胞系ZR-75-I和MCF-7,发现了mtDNA编码ND1基因的表达下调,提示化疗药物可能通过抑制mtDNA的转录水平达到抑制肿瘤细胞增殖的目的。本研究与上述诸多学者思路和结果一致,mtDNA的突变或功能异常可促进细胞凋亡从而达到抑制细胞增殖的目的,这为食管癌的治疗提供了新的思路,有可能通过特异性降低肿瘤细胞的mtDNA来治疗肿瘤。另外,肿瘤细胞线粒体膜极性增加,肿瘤细胞mtDNA可能成为亲脂性阳离子化疗药物的选择性作用部位。这些研究将使食管癌的治疗出现新的希望。
[1]Anderson S,Bankier AT,Barrell BG,et al.Sequence and organization of the human mitochondrial genome[J].Nature,1981,290(5806):457-465.
[2]Wallace DC.Mitochondrial diseases in man and mouse[J].Science,1999,283(5407):1482-1488.
[3]Lindholm D,Eriksson O,Korhonen L.Mitochondrial proteins in neuronal degeneration[J].Biochem Biophys Res Commun,2004,321(4):753-758.
[4]Hong SJ,Dawson TM,Dawson VL.Nuclear and mitochondrial conversations in cell death:PARP-1 and AIF signaling[J].Trends Pharmacol Sci,2004,25(5):259-264.
[5]Servidei S.Mitochondrial encephalomyopathies:gene mutation[J].Neuromuscul Disord,2002,12(5):524-529.
[6]刘宗文,赵志华,赵秋民,等.食管鳞癌组织中线粒体DNA拷贝数量的变化及意义[J].中国肿瘤临床,2007,34(12):667-669.
[7]刘宗文,李晟磊,赵志华,等.食管鳞状细胞癌组织中线粒体DNA含量及拷贝数量的变化[J].郑州大学学报:医学版,2007,42(6):1025-1027.
[8]刘宗文,赵秋民,赵志华,等.食管鳞癌组织中线粒体和细胞核DNA的提取和鉴定[J].世界华人消化杂志,2007,15(10):1146-1149.
[9]Penta JS,Johnson FM,Wachsman JT,et al.Mitochondrial DNA in human malignancy[J].Mutat Res,2001,488(2):119-133.
[10]Delsite R,Kachhap S,Anbazhagan R,et al.Nuclear genes involved in mitochondria-to-nucleus communication in breast cancer cells[J].Mol Cancer,2002,1:6.
[11]Dali-Youcef N,Mataki C,Coste A,et al.Adipose tissue-specific inactivation of the retinoblastoma protein protects against diabesity because of increased energy expenditure[J].Proc Natl Acad Sci U S A,2007,104(25):10703-10708.
[12]刘宗文,张云汉,陈奎生.线粒体DNA(mtDNA)与肿瘤的发生发展及细胞凋亡的相关性研究进展[J].河南大学学报:医学版,2007,26(1):11-15.
[13]刘宗文,张中冕,杨家梅.人食管鳞癌EC9706细胞线粒体DNA与凋亡的关系[J].肿瘤防治研究,2010,37(8):878-881.
[14]Uchida T,Inagaki N,Furuichi Y,et al.Down-regulation of mitochondrial gene expression by the anti-tumor arotinoid mofarotene(Ro 40-8757)[J].Int J Cancer,1994,58(6):891-897.
[15]Escobar-Khondiker M,Höllerhage M,Muriel MP,et al.Annonacin,a natural mitochondrial complex I inhibitor,causes tau pathology in cultured neurons[J].J Neurosci,2007,27(29):7827-7837.
[16]Lo S,Tolner B,Taanman JW,et al.Assessment of the significance of mitochondrial DNA damage by chemotherapeutic agents[J].Int J Oncol,2005,27(2):337-344.

